-
冠状病毒(coronavirus, CoV)是一类具有单股正链RNA基因组的包膜病毒,基因组长度为26~32 kb[1]。这类病毒广泛分布于哺乳动物和鸟类中,能够引起从轻微的呼吸道感染到严重的呼吸道综合征等多种疾病[2-3]。2019年底出现的SARS-CoV-2,引发了全球冠状病毒病(COVID-19)大流行,造成了巨大的公共卫生危机[4]。SARS-CoV-2是人类发现的第7种冠状病毒,属于包膜内线性单链正向RNA病毒,包含14个开放阅读框,其中,ORF1a和ORF1b编码的多聚蛋白在病毒复制和转录过程中起关键作用[5-6]。这些多聚蛋白在主蛋白酶(main protease, Mpro,也称为3C-like protease, 3CLpro)和木瓜样蛋白酶(papain-like proteinase protein, PLpro)的作用下被切割成多个非结构蛋白,进一步组装成病毒复制转录复合体,从而启动病毒RNA的复制和转录[7-9]。Mpro在病毒复制感染中扮演着至关重要的角色,其底物识别位点在所有冠状病毒中高度保守,且与人类蛋白酶没有显著的同源性,使其成为极具潜力的抗冠状病毒药物治疗靶点[10]。
近年来,针对SARS-CoV-2 Mpro的抑制剂研究取得了显著进展,已有多个药物获得临床批准用于SARS-CoV-2病毒感染的治疗,如辉瑞公司的奈玛特韦(Nirmatrelvir)、先声药业的先诺欣以及众生睿创的乐睿灵。此外,还有多个Mpro抑制剂处于新药研发阶段。然而,现有抑制剂主要通过与Mpro活性位点的可逆或不可逆结合来发挥功能,存在一些局限性[11-13]:①传统抑制剂需要较高浓度才能有效抑制病毒复制,可能增加药物毒性和副作用的风险;②病毒突变会显著降低药物结合亲和力,导致耐药性,从而降低抑制剂的疗效。例如,SARS-CoV-2 Mpro的E166V和E166A突变已被证实对奈玛特韦表现出显著的耐药性[14]。
为了克服这些问题,蛋白降解靶向嵌合体(proteolysis targeting chimera, PROTAC)作为一种新兴的药物研发技术,为抗病毒药物的研发提供了新的思路[15-17]。与传统小分子抑制剂依靠占据靶蛋白活性位点来阻断其功能不同,PROTAC分子一端与靶蛋白结合,另一端结合E3泛素连接酶形成靶蛋白-PROTAC-E3三元复合物,通过招募E3连接酶,诱导靶蛋白的泛素化和随后的蛋白酶体降解。这种事件驱动的作用机制不仅提高了药物的选择性和作用效力,还能有效克服因靶蛋白突变导致的耐药性问题[18-19]。在抗病毒药物研究中,PROTAC技术已应用于多种病毒蛋白的降解,如丙型肝炎病毒NS3蛋白和流感病毒血凝素蛋白。针对SARS-CoV-2的Mpro蛋白,也有相关研究报道。Alugubelli等[20-21]报道的Mpro PROTAC MPD2在细胞中表现出显著的Mpro蛋白降解活性和抗病毒效果。Sang等[22]也报道了一种基于CRBN配体的PROTAC分子HP211206,能够有效降解SARS-CoV-2 Mpro及其耐药突变体。
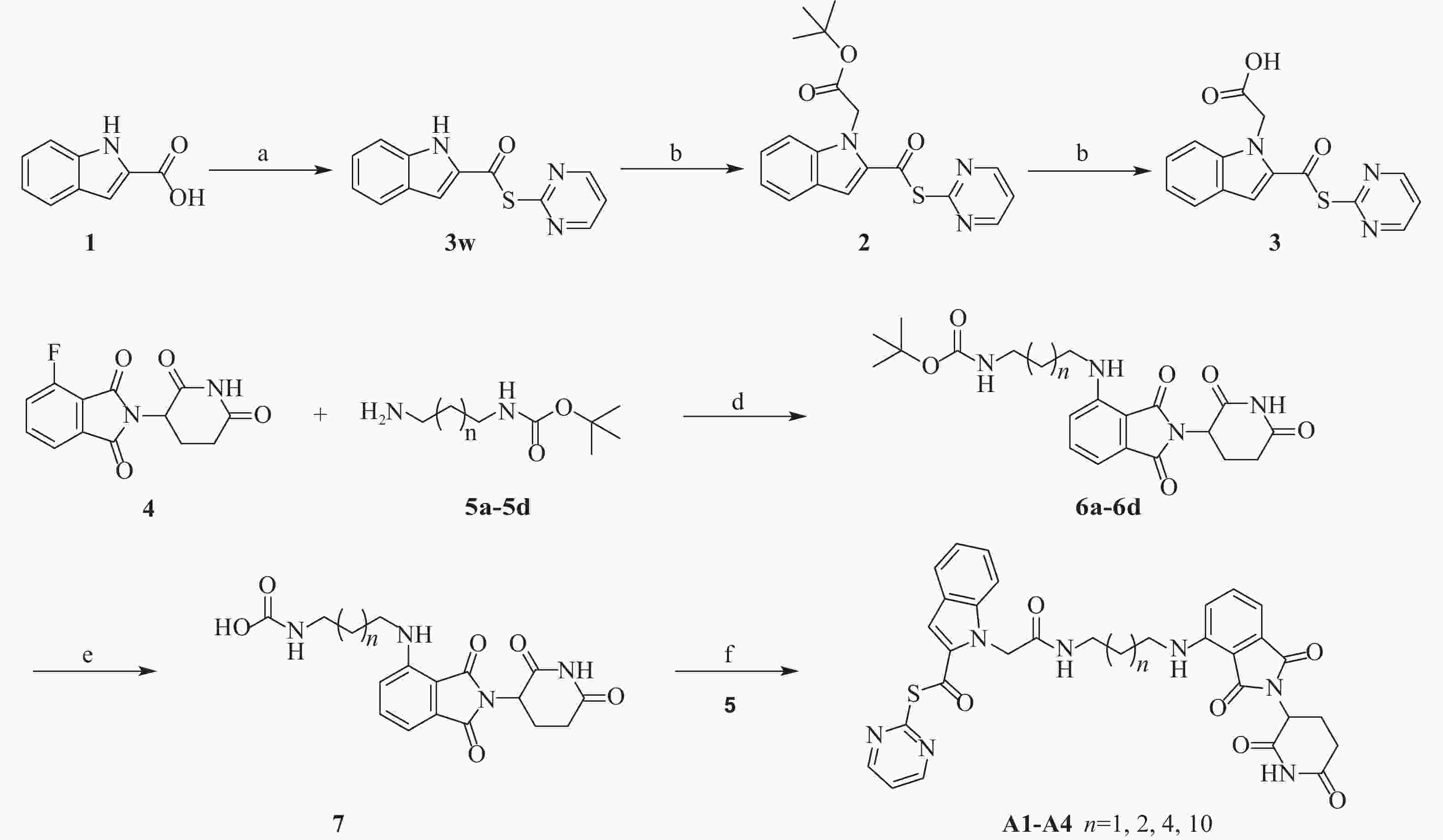
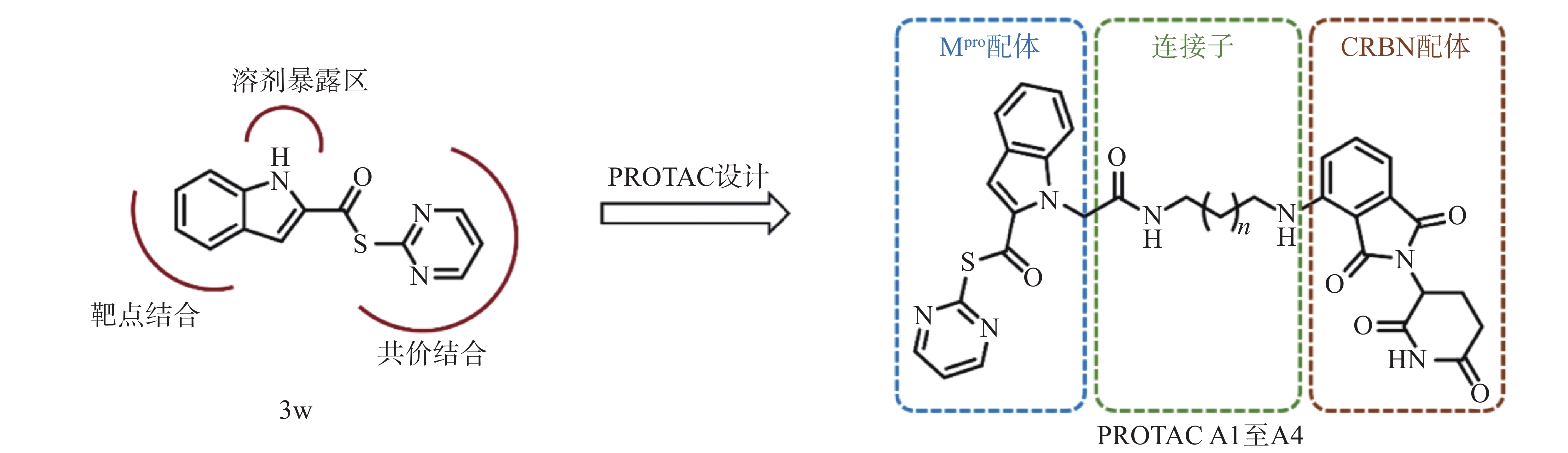
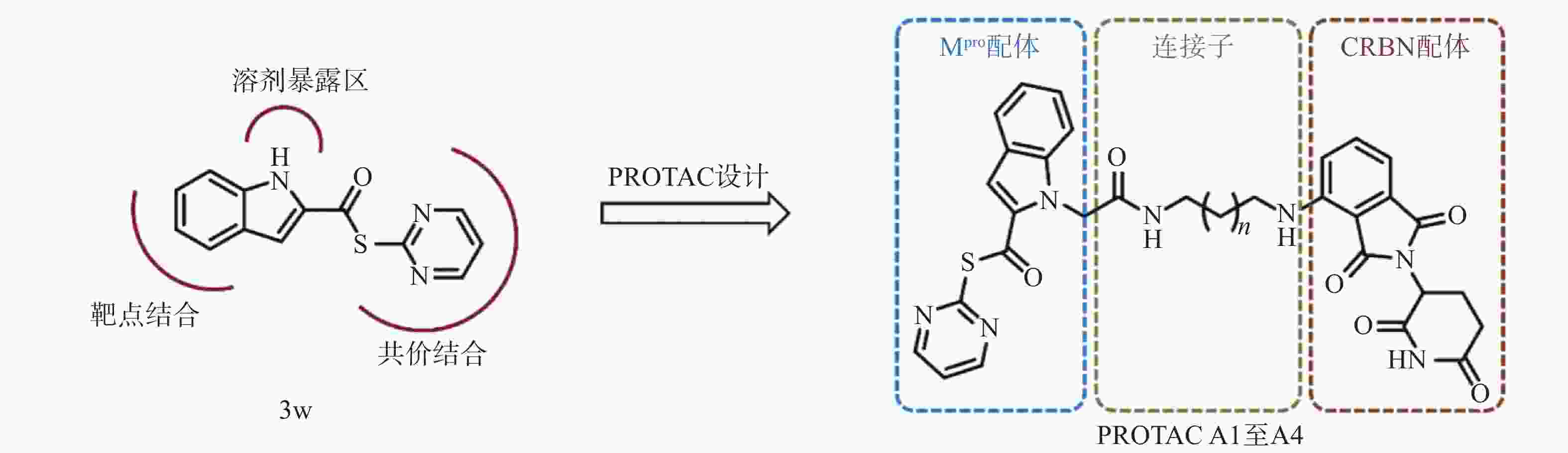
然而,当前针对Mpro的PROTAC降解剂大多基于复杂的拟肽类抑制剂,其合成的难度和成本较高,为后续研发和生产带来一定挑战[23]。为了探索更简单、高效的小分子抗新冠病毒PROTAC降解剂,我们设计并合成一类基于简单小分子抑制剂3w的Mpro PROTAC降解剂[24](图1)。化合物3w是一种硫酯类小分子Mpro共价抑制剂,与传统Mpro抑制剂相比,具有分子量小、结构简单、易于合成的优点。本研究旨在验证基于简单小分子配体的PROTAC策略在抗SARS-CoV-2药物研究中的可行性,为未来抗病毒药物的设计提供新的先导化合物。
-
化学原料均为分析纯或化学纯级别,购自探索平台、毕得等试剂公司;Rabbit anti-SARS-CoV-2 3CLpro antibody(ABclonal, A20831);Rabbit anti-β-Tubulin antibody(ABclonal,A12289);Goat anti-rabbit IgG H&L(Alexa Fluor® 680)(Abcam, ab175773);Bruker AVANCE600(Bruker Company, Germany)核磁共振仪,TMS作为内标,化学位移与偶合常数分别用ppm和Hz表示;Agilent
6538 UHD Accurate-Mass Q-TOF LC/MS高分辨质谱(HRMS)仪;Bioteck Synergy2多功能酶标仪;Biorad ChemiDoc成像仪。 -
合成路线见图2。
-
将1H-吲哚-2-羧酸(3.0 g, 18 mmol)溶于无水二氯甲烷(DCM, 30 ml),氮气保护下依次加入三氯氧磷(4.3 g, 28 mmol)和吡啶(2.2 g, 28 mmol)。室温搅拌30 min后,加入嘧啶-2-硫醇(0.70 g, 18 mmol)及吡啶(2.4 g, 30 mmol),室温反应8 h。反应液用饱和柠檬酸钠水溶液(50 ml)淬灭,DCM(20 ml× 3)萃取。合并有机相,饱和氯化钠水溶液洗涤,无水硫酸钠干燥,减压浓缩得粗产物,经硅胶柱层析纯化(石油醚/乙酸乙酯= 60:40)得白色固体(3w)1.86 g,收率61%。1H NMR(600 MHz, DMSO-d6)δ 12.14(s, 1H), 8.93(d, J = 4.9 Hz, 2H), 7.75(d, J = 8.1 Hz, 1H), 7.59(t, J = 4.9 Hz, 1H), 7.51(s, 1H), 7.48(d, J = 8.4 Hz, 1H), 7.34(t, J = 7.7 Hz, 1H), 7.14(t, J = 7.6 Hz, 1H)。 13C NMR(101 MHz, DMSO-d6)δ 178.7, 163.7, 159.1, 138.3, 132.9, 126.6, 126.3, 122.8, 120.9, 120.9, 112.9, 109.6. ESI-HRMS m/z Calcd. For C13H9N3OS [M+H]+
256.0545 , Found 256.0539。 -
将化合物3w(0.22 g,0.85 mmol)与2-溴乙酸叔丁酯(0.25 g,1.28 mmol)溶于丙酮(20 ml),随后加入Cs2CO3(0.83 g,2.55 mmol),室温搅拌6 h。反应液减压抽滤得白色固体,经硅胶柱层析纯化(石油醚/乙酸乙酯= 65∶35),得淡黄色固体(2)0.18 g,收率66%。1H NMR(600 MHz, DMSO-d6)δ 8.92(d, J = 4.9 Hz, 2H), 7.97(d, J = 8.4 Hz, 1H), 7.84(d, J = 8.0 Hz, 1H), 7.67(s,1H), 7.53(t, J = 4.9 Hz, 1H), 7.45(t, J = 7.9 Hz, 1H), 7.31(t, J = 7.5 Hz, 1H), 3.82(s, 2H), 1.40(s, 9H)。13C NMR(101 MHz, DMSO-d6)δ 184.2, 172.5, 159.5, 156.9, 138.7, 136.4, 132.1, 129.2, 127.4, 123.4, 123.3, 119.7, 113.5, 80.0, 35.2, 27.6。
-
将上述化合物2(0.18 g, 0.49 mmol)溶于DCM(20 ml),加入三氟乙酸(TFA, 4 ml),室温搅拌6 h,待反应完全后旋干溶剂和TFA,得淡黄色固体(3)0.17 g,收率95%。
-
将2-(2,6-二氧代哌啶-3-基)-4-氟异吲哚啉-1,3-二酮(0.27 g, 0.96 mmol)与N-叔丁氧羰基-1,3-丙二胺(0.25 g, 1.43 mmol)溶于N-甲基吡咯烷酮溶液中,逐滴加入N,N-二异丙基乙胺(DIPEA)(1.2 g, 9.6 mmol)。将反应混合物在90 ℃下加热搅拌5 h。待反应结束后,反应液用饱和氯化钠水溶液(20 ml)溶解,然后用乙酸乙酯萃取(10 ml× 3),合并有机相,无水硫酸钠干燥,减压浓缩。粗产物经硅胶柱层析纯化(石油醚/乙酸乙酯=55∶45),得黄色固体(6a)0.26 g,收率65%。1H NMR(600 MHz, DMSO-d6)δ 11.09(s, 1H), 7.57(t, J = 7.8 Hz, 1H), 7.08(d, J = 8.6 Hz, 1H), 7.02(d, J = 7.0 Hz, 1H), 6.92(s, 1H), 6.66(s, 1H), 5.05(dd, J = 12.9, 5.4 Hz, 1H), 3.30(t, J = 7.2 Hz, 2H), 3.03 - 2.98(m, 2H), 2.61 - 2.52(m, 2H), 1.69 - 1.61(m, 2H), 1.38(s, 9H), 1.29 - 1.23(m, 2H)。
-
中间体6b的合成步骤参照中间体6a,得到黄色固体(6b)0.19 g,收率58%。1H NMR(600 MHz, DMSO-d6)δ 11.09(s, 1H), 7.56(t, J = 8.4 Hz, 1H), 7.09(d, J = 9.0 Hz, 1H), 7.01(d, J = 9.0 Hz, 1H), 6.81(s, 1H), 6.53(s, 1H), 5.03(dd, J = 11.4, 10.8 Hz, 1H), 3.28(t, J = 9.0 Hz, 2H), 2.94 - 2.92(m, 2H), 2.69 - 2.67(m, 2H), 1.55 - 1.52(m, 2H), 1.49 - 1.38(m, 2H), 1.35(s, 9H), 1.33 - 1.08(m, 2H)。
-
中间体6c的合成步骤参照中间体6a,得到黄色固体(6c)0.22 g,收率72%。1H NMR(600 MHz, DMSO-d6)δ 11.09(s, 1H), 7.58(t, J = 7.2 Hz, 1H), 7.09(d, J = 8.7 Hz, 1H), 7.02(d, J = 7.2 Hz, 1H), 6.74(s, 1H), 6.52(s, 1H), 5.05(dd, J = 7.5, 2.8 Hz, 1H), 3.30(t, J = 3.0 Hz, 2H), 2.91 - 2.84(m, 2H), 2.61 - 2.51(m, 2H), 1.57 - 1.54 (m, 2H), 1.36(s, 9H), 1.35 - 1.03(m, 12H)。
-
中间体6d的合成步骤参照中间体6a,得到黄色固体(6d)0.21 g,收率69%。1H NMR(600 MHz, DMSO-d6)δ 11.09(s, 1H), 7.57(t, J = 7.2 Hz 1H), 7.08(d, J = 8.6 Hz, 1H), 7.01(d, J = 7.0 Hz, 1H), 6.73(s, 1H), 6.52(s, 1H), 5.04(dd, J = 12.9, 5.4 Hz, 1H), 3.28(t, J = 6.6 Hz, 2H), 2.88 - 2.87(m, 2H), 2.61 - 2.51(m, 2H), 1.60 - 1.49(m, 2H), 1.36(s, 9H), 1.30 - 1.21(m, 20H)。
-
将6a溶于DCM(20 ml),随后加入TFA(4 ml),在室温下搅拌6 h。旋蒸除去溶剂和TFA后,向残留物中加入化合物3(0.19 g, 0.62 mmol),并将其溶于DCM(15 ml)中。在室温下搅拌,缓慢滴加DIPEA,直至不产生白烟。称取1-乙基-3-(3-二甲氨基丙基)碳二亚胺盐酸盐(EDCI, 0.13 g, 0.68 mmol),1-羟基苯并三唑(HOBt, 0.092 g, 0.68 mmol)溶于DCM中,随后将混合液滴加到反应液中,最后滴加DIPEA(0.24 g, 1.86 mmol),继续在室温下搅拌反应10 h。反应结束后,反应液用饱和碳酸氢钠溶液(50 ml)淬灭,DCM(20 ml× 3)萃取。合并有机相后,用饱和氯化钠水溶液洗涤,无水硫酸钠干燥,减压浓缩除去溶剂。残余物经硅胶柱层析纯化(二氯甲烷/甲醇= 95:5),得淡黄色固体(A1)0.11 g,收率33%。1H NMR(600 MHz, DMSO-d6)δ 11.09(s, 1H), 8.91(d, J = 4.9 Hz, 2H), 8.27(t, J = 5.7 Hz, 1H), 7.96(d, J = 8.5 Hz, 1H), 7.83(d, J = 7.9 Hz, 1H), 7.66(s, 1H), 7.53 - 7.48(m, 1H), 7.49(t, J = 4.8 Hz, 1H), 7.44(t, J = 7.7 Hz, 1H) , 7.31(t, J = 7.5 Hz, 1H), 7.06(d, J = 8.6 Hz, 1H), 6.99(d, J = 7.0 Hz, 1H), 6.67(t, J = 6.2 Hz, 1H), 5.04(dd, J = 12.8, 5.5 Hz, 1H), 3.76(s, 2H), 3.31 - 3.28(m, 2H), 3.16(q, J = 6.3, 6.3, 6.3 Hz, 2H), 2.63 - 2.51(m, 2H), 1.70 - 1.65(m, 2H), 1.36 - 1.23(m, 2H)。13C NMR(101 MHz, DMSO-d6)δ 182.8, 172.8, 170.1, 168.8, 167.3, 166.8, 158.9, 156.3, 146.2, 138.4, 136.2, 135.1, 132.2, 127.1, 126.6, 123.0, 119.3, 117.1, 114.2, 112.9, 110.4, 109.2, 48.5, 36.4, 32.8, 30.9, 28.9, 28.6, 22.2。ESI-HRMS m/z Calcd. For C31H27N7O6S [M+H]+
626.1822 , Found626.1816 。 -
目标化合物A2合成步骤参照化合物A1,得淡黄色固体(A2)0.096 g,收率31%。1H NMR(600 MHz, DMSO-d6)δ 11.09(s, 1H), 8.92(d, J = 4.9 Hz, 2H), 8.19(t, J = 5.7 Hz, 1H), 7.96(d, J = 8.5 Hz, 1H), 7.82(d, J = 8.0 Hz, 1H), 7.64(s, 1H), 7.57 - 7.53(m, 1H), 7.52(t, J = 5.2 Hz, 1H), 7.44(t, J = 7.7 Hz, 1H), 7.30(t, J = 7.5 Hz, 1H), 7.08(d, J = 8.5 Hz, 1H), 6.99(d, J = 7.0 Hz, 1H), 6.54(t, J = 5.8 Hz, 1H), 5.04(dd, J = 12.5, 5.4 Hz, 1H), 3.74(s, 2H), 3.31 - 3.25(m, 2H), 3.11(q, J = 6.5, 6.5, 6.5 Hz, 2H), 2.63 - 2.52(m, 2H), 1.75 - 1.56(m, 2H), 1.62 - 1.54(m, 2H), 1.50 - 1.45(m, 2H)。13C NMR(101 MHz, DMSO-d6)δ 182.7, 172.8, 170.1, 168.9, 167.3, 166.5, 158.9, 158.5, 146.4, 138.4, 136.2, 135.1, 132.2, 127.1, 126.6, 122.9, 119.3, 117.2, 114.1, 112.9, 110.4, 109.0, 48.5, 41.5, 38.6, 32.7, 30.9, 26.1, 22.1。ESI-HRMS m/z Calcd. For C32H29N7O6S [M+H]+
640.1978 , Found640.1973 。 -
目标化合物A3合成步骤参照化合物A1,得淡黄色固体(A3)0.12 g,收率39%。1H NMR(600 MHz, DMSO-d6)δ 11.09(s, 1H), 8.93(d, J = 4.9 Hz, 2H), 8.12(t, J = 5.7 Hz, 1H), 7.96(d, J = 8.5 Hz, 1H), 7.83(d, J = 8.0 Hz, 1H), 7.65(s, 1H), 7.58 - 7.55(m, 1H), 7.53(t, J = 4.9 Hz, 1H), 7.44(t, J = 7.8 Hz, 1H), 7.30(t, J = 7.5 Hz, 1H), 7.06(d, J = 8.6 Hz, 1H), 7.01(d, J = 7.0 Hz, 1H), 6.50(t, J = 6.0 Hz, 1H), 5.05(dd, J = 12.8, 5.5 Hz, 1H), 3.73(s, 2H), 3.28 - 3.23(m, 2H), 3.05(q, J = 6.6, 6.6, 6.6 Hz, 2H), 2.64 - 2.51(m, 2H), 1.56 - 1.51(m, 2H), 1.39 - 1.37(m, 2H), 1.33 - 1.23(m, 10H)。13C NMR(101 MHz, DMSO-d6)δ 182.7, 172.8, 170.1, 168.9, 167.3, 166.3, 158.9, 156.3, 146.4, 138.4, 136.2, 135.1, 132.2, 127.1, 126.6, 122.9, 119.3, 117.1, 114.2, 112.9, 110.3, 108.9, 48.5, 41.8, 32.7, 30.9, 30.1, 28.6, 26.2, 22.1, 17.2。ESI-HRMS m/z Calcd. For C36H37N7O6S [M+H]+ 696.2604, Found 696.2599。
-
目标化合物A4合成步骤参照化合物A1,得淡黄色固体(A4)0.14 g,收率42%。1H NMR(600 MHz, DMSO-d6)δ 11.09(s, 1H), 8.92(d, J = 4.9 Hz, 2H), 8.11(t, J = 5.6 Hz, 1H), 7.96(d, J = 8.5 Hz, 1H), 7.82(d, J = 8.0 Hz, 1H), 7.64(s, 1H), 7.58 - 7.55(m, 1H), 7.52(t, J = 4.8 Hz, 1H), 7.43(t, J = 7.8 Hz, 1H), 7.30(t, J = 7.5 Hz, 1H), 7.07(d, J = 8.6 Hz, 1H), 7.01(d, J = 7.1 Hz, 1H), 6.50(t, J = 5.8 Hz, 1H), 5.05(dd, J = 12.9, 5.4 Hz, 1H), 3.73(s, 2H), 3.27 - 3.24(m, 2H), 3.04(q, J = 6.7, 6.6, 6.6 Hz, 2H), 2.62 - 2.52(m, 2H), 1.56 - 1.51(m, 2H), 1.38 - 1.36(m, 2H), 1.32 - 1.25(m, 18H)。 13C NMR(101 MHz, DMSO-d6)δ 182.7, 172.8, 170.0, 168.9, 167.3, 166.3, 158.9, 158.5, 146.4, 138.4, 136.2, 135.1, 132.2, 127.1, 126.6, 122.9, 119.2, 117.1, 114.1, 112.9, 110.3, 109.0, 64.9, 48.5, 41.8, 32.7, 30.9, 28.9, 26.3, 22.1, 15.1。ESI-HRMS m/z Calcd. For C40H45N7O6S [M+H]+ 752.3230, Found 752.3230。
-
构建携带Mpro基因的质粒,并在其中插入编码荧光蛋白的基因序列,然后进行质粒抽提以获得高纯度的重组质粒。使用HG TransgeneTM Reagent转染试剂将构建好的质粒及慢病毒载体共转染进HEK-293T细胞。转染10~12 h后加Enhancing buffer,8 h后更换新鲜培养基,继续培养48 h,收集富含慢病毒颗粒的细胞上清液,对其浓缩后得到高滴度的慢病毒浓缩液。将HEK-293T细胞以2 × 105个细胞/孔密度接种于12孔板中,用800 μl完全培养基按感染复数(MOI)= 10稀释慢病毒原液,感染16 h后换成完全培养基,继续培养72 h,使细胞充分表达目标蛋白,最终获得稳定表达Mpro的HEK-293T细胞株(Mpro-HEK-293T)。通过蛋白印迹法(Western Blot)检测Mpro蛋白的表达水平,验证基因过表达效果。
-
将Mpro-HEK-293T细胞以4 × 105个/孔的密度接种于6孔板中,置于37 ℃、5% CO2的培养箱培养24 h,使细胞贴壁生长。取对数生长期的Mpro-HEK-293T细胞接种至6孔板。设置含不同药物浓度的完全培养基作为实验组,加入适量DMSO的完全培养基作为阴性对照组,只有完全培养基的作为空白对照组。各组细胞在相同条件下孵育24 h后提取细胞总蛋白。采用Western Blot检测细胞中Mpro的降解情况。首先,使用以10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离蛋白样品。随后,在恒压25 V条件下转膜8 min,将蛋白转移至聚偏二氟乙烯膜(PVDF)上。转膜后,将PVDF膜置于快速封闭液中,室温孵育封闭30 min。封闭结束后,用TBST缓冲液洗涤膜3次,每次5 min,然后与Mpro兔单克隆抗体(稀释比例1∶1 000)在4 ℃条件下孵育过夜。再次用TBST洗涤膜3次,每次5 min。随后与化学荧光兔二抗在室温下孵育2 h。最后,将膜置于BioRad ChemiDoc成像仪中进行化学发光信号检测并曝光成像。
-
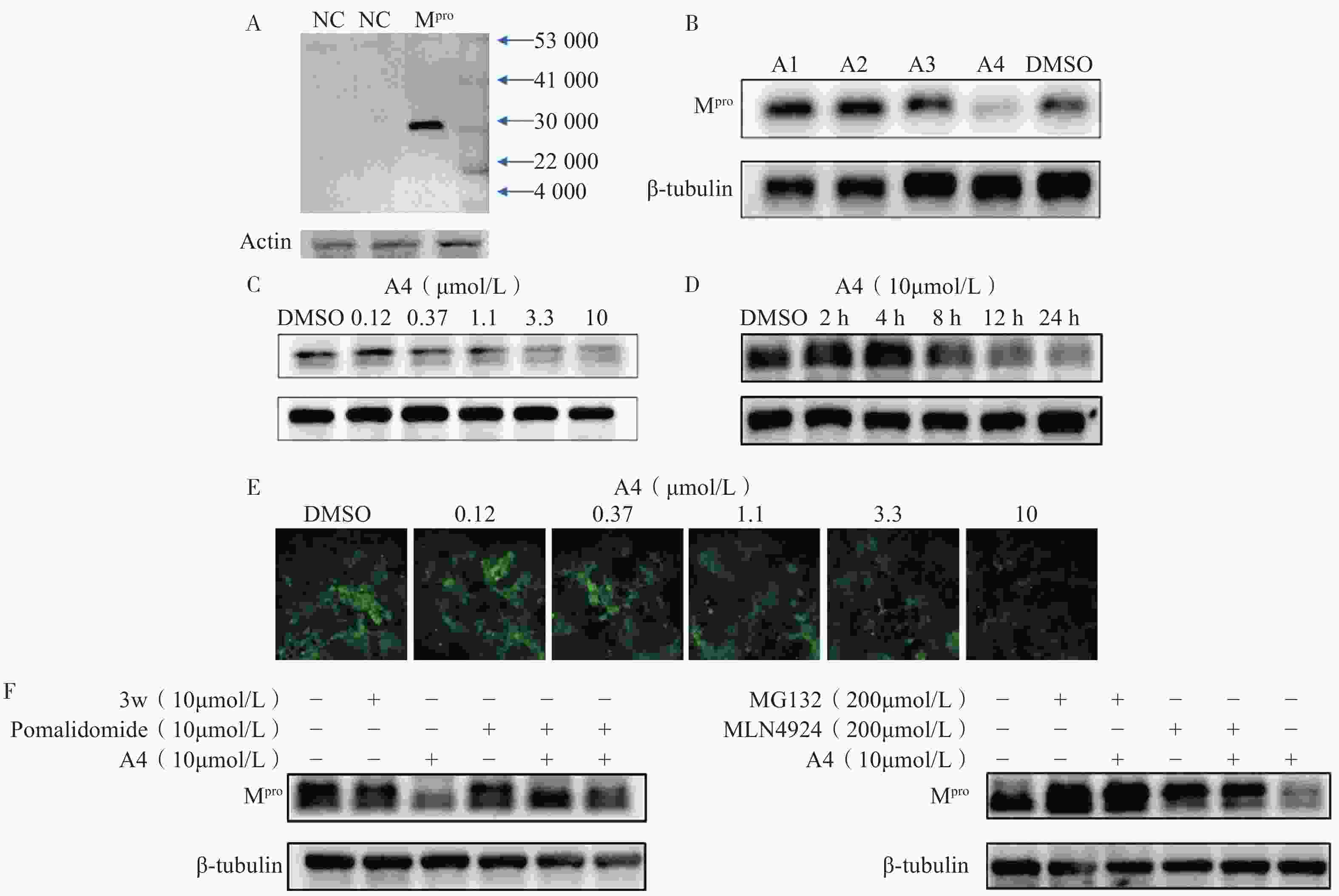
为了评估目标化合物对Mpro在细胞中的降解活性,我们构建了稳定表达SARS-CoV-2 Mpro的HEK-293T细胞。Western Blot分析显示,Mpro特征蛋白条带清晰可见,表明经慢病毒转染后的HEK-293T细胞能够持续稳定表达Mpro蛋白(图3A)。在此基础上,对化合物A1至A4开展降解活性评价和作用机制研究。Western Blot实验结果表明,在10 μmol/L浓度下,化合物A4近乎完全降解Mpro(图3B),表现出显著的降解活性,而化合物A1至A3几乎无活性,表明较长的连接子可能有助于提升Mpro PROTAC降解活性。为进一步测定化合物A4的降解活性,我们通过浓度梯度实验结合Image J软件对蛋白条带灰度值进行定量分析,计算得到化合物A4诱导Mpro降解的DC50值为5.2 μmol/L(图3C)。前期在构建质粒时,我们同时插入了编码荧光蛋白(GFP)的基因,以便更直观地观察Mpro的降解情况。用梯度浓度化合物A4处理HEK-293T细胞,孵育24 h后在荧光显微镜下进行观察,结果显示,随着化合物浓度上升,细胞内荧光强度逐渐减弱,表明化合物A4浓度依赖性下调Mpro蛋白水平(图3E),该结果与Western Blot分析一致,进一步验证了化合物A4的降解效果。
为进一步探究化合物A4的降解动力学特性,我们测定了其在不同孵育时间下导致的Mpro蛋白含量变化(图3D)。结果显示,给药8 h时后Mpro开始降解,24 h达到最大降解效果,表明化合物A4能够以时间依赖性方式诱导Mpro蛋白降解。机制研究表明,在10 μmol/L浓度下化合物A4能够显著下调Mpro蛋白含量。Mpro抑制剂3w或CRBN配体泊马度胺分别与化合物A4共孵育时,均能够阻断化合物A4对Mpro的降解作用(图3F),而两者单独使用时,Mpro蛋白含量未发生改变,表明化合物A4需要两端结合Mpro和CRBN才能发挥相应的降解活性。此外,加入蛋白酶体抑制剂MG132[29]或类泛素化抑制剂MLN4924[30]均可逆转化合物A4对Mpro的降解作用,而单独使用这些抑制剂时,细胞内Mpro的含量不变(图3G)。以上实验结果说明,化合物A4通过与Mpro蛋白和CRBN蛋白的同时结合,诱导Mpro蛋白泛素化修饰并促进其被蛋白酶体降解,从而证明了化合物A4是一种通过泛素-蛋白酶体途径介导Mpro降解的降解剂。
-
基于PROTAC技术,我们设计并合成得到4个靶向SARS-CoV-2 Mpro的PROTAC小分子化合物,所有目标化合物均经过了核磁共振和高分辨质谱确证其化学结构,并通过高效液相色谱确认纯度均达到95%以上。为评估目标化合物对Mpro的降解活性,构建了稳定表达SARS-CoV-2 Mpro的HEK-293T细胞系,并通过Western Blot和荧光显微镜观察验证了Mpro的持续稳定表达。初步筛选结果显示,连接子长度显著影响PROTAC降解效率,其中,连接子最长的化合物A4表现出最优的Mpro降解活性,DC50值为5.2 μmol/L。机制研究进一步证实,化合物A4同时结合靶蛋白Mpro和E3连接酶CRBN,触发泛素-蛋白酶体途径,诱导Mpro蛋白特异性降解。
本研究首次探索了以结构简单的抑制剂3w为Mpro配体的PROTAC分子的设计与生物活性,验证了新型Mpro PROTAC A4在细胞内降解Mpro的有效性,为开发新型抗冠状病毒的PROTAC降解剂提供了先导化合物。尽管化合物A4展现出一定的降解活性,但其DC50值仍有进一步优化的空间,后续的结构优化正在进行中。
Design, synthesis and degradation activity of PROTAC degraders of SARS-CoV-2 main protease
-
摘要:
目的 基于蛋白降解靶向嵌合体(PROTAC)技术设计合成靶向SARS-CoV-2主蛋白酶(Mpro)的PROTAC降解剂。 方法 以化合物 3w 为Mpro靶向配体,选择其溶剂暴露区吲哚N原子作为连接位点,通过不同长度连接子与CRBN(cereblon)的配体泊马度胺偶联,设计并合成一系列靶向Mpro的PROTAC分子,采用蛋白免疫印迹(Western Blot)技术评估其在稳定表达Mpro的HEK-293T细胞中的降解活性,并探索其作用机制。 结果 成功合成了4个新型Mpro PROTAC目标分子( A1 至 A4 ),其结构经1H NMR、13C NMR与HRMS确证。其中,最优化合物 A4 对Mpro的降解活性DC50值达5.2 μmol/L,其可同时结合靶蛋白Mpro和E3连接酶CRBN,触发泛素-蛋白酶体途径,诱导Mpro蛋白特异性降解。 结论 本研究成功设计合成了一类新型Mpro PROTAC降解剂,验证了其蛋白降解能力,并阐明了作用机制,为抗新冠病毒药物研发提供了先导化合物。 Abstract:Objective To design and synthesize PROTAC degraders targeting the SARS-CoV-2 main protease (Mpro)based on PROTAC technology. Methods Compound 3w was used as the Mpro ligand, and the indole N atom in the solvent-exposed region was selected as the linker attachment site. A series of Mpro PROTACs were designed and synthesized by conjugating compound 3w with the CRBN ligand pomalidomide through alkane linkers of different lengths. The structures of the target compounds were confirmed by 1H NMR, 13C NMR, and HRMS. Western Blot analysis was employed to evaluate their degradation activity and explore its mechanism in Mpro-HEK-293T cells. Results Four novel Mpro PROTACs( A1 - A4 )were successfully synthesized. The most potent compound A4 demonstrated Mpro degradation activity with a DC50 value of 5.2 μmol/L, and its degradation mechanism was validated. Conclusion A novel class of Mpro PROTAC degraders were successfully designed and synthesized, and their protein degradation capability and mechanism of action were demonstrated. These results provided lead compounds for the research and development of antiviral degraders against SARS-CoV-2. -
Key words:
- SARS-CoV-2 /
- main protease /
- PROTAC /
- protein degradation activity /
- antiviral drug
-
图 3 靶向Mpro的PROTAC分子的Western Blot实验结果
A.Mpro在HEK-293T细胞中的表达验证;B.化合物A1至A4(10 μmol/L)HEK-293T细胞内的Mpro含量;C.不同浓度的A4作用24 h,HEK-293T细胞内Mpro含量;D.化合物A4(10 μmol/L)与HEK-293T细胞株孵育后,细胞内的Mpro含量随时间的变化;E.化合物A4(0~10 μmol/L)与HEK-293T细胞株孵育24 h后,荧光显微镜拍摄图片;F.经A4、3w或CRBN配体作用24 h,HEK-293T细胞内的Mpro含量以及经Neddylation抑制剂或蛋白酶体抑制剂作用24 h,HEK-293T细胞内的Mpro含量
-
[1] WALDMAN R H, GANGULY R. Immunity to infections on secretory surfaces[J]. J Infect Dis, 1974, 130(4):419-440. doi: 10.1093/infdis/130.4.419 [2] FEHR A R, PERLMAN S. Coronaviruses: an overview of their replication and pathogenesis[J]. Methods Mol Biol, 2015, 1282:1-23. [3] SHANNON A, SELISKO B, LE N, et al. Favipiravir strikes the SARS-CoV-2 at its Achilles heel, the RNA polymerase[J]. bioRxiv, 2020. [4] C E. WHO coronavirus disease(COVID-19)[M]. Weekly Epidemiological Update, 2021. [5] FORNI D, CAGLIANI R, CLERICI M, et al. Molecular evolution of human coronavirus genomes[J]. Trends Microbiol, 2017, 25(1):35-48. doi: 10.1016/j.tim.2016.09.001 [6] CUI J, LI F, SHI Z L. Origin and evolution of pathogenic coronaviruses[J]. Nat Rev Microbiol, 2019, 17(3):181-192. doi: 10.1038/s41579-018-0118-9 [7] GÜNTHER S, REINKE P Y A, FERNÁNDEZ-GARCÍA Y, et al. X-ray screening identifies active site and allosteric inhibitors of SARS-CoV-2 main protease[J]. Science, 2021, 372(6542):642-646. doi: 10.1126/science.abf7945 [8] GHOSH A K, GONG G L, GRUM-TOKARS V, et al. Design, synthesis and antiviral efficacy of a series of potent chloropyridyl ester-derived SARS-CoV 3CLpro inhibitors[J]. Bioorg Med Chem Lett, 2008, 18(20):5684-5688. doi: 10.1016/j.bmcl.2008.08.082 [9] ZHOU P, YANG X L, WANG X G, et al. A pneumonia outbreak associated with a new coronavirus of probable bat origin[J]. Nature, 2020, 579(7798):270-273. doi: 10.1038/s41586-020-2012-7 [10] GORDON D E, JANG G M, BOUHADDOU M, et al. A SARS-CoV-2 protein interaction map reveals targets for drug repurposing[J]. Nature, 2020, 583(7816):459-468. doi: 10.1038/s41586-020-2286-9 [11] LAN J, GE J W, YU J F, et al. Structure of the SARS-CoV-2 spike receptor-binding domain bound to the ACE2 receptor[J]. Nature, 2020, 581(7807):215-220. doi: 10.1038/s41586-020-2180-5 [12] XIA S, LIU M Q, WANG C, et al. Inhibition of SARS-CoV-2(previously 2019-nCoV)infection by a highly potent pan-coronavirus fusion inhibitor targeting its spike protein that harbors a high capacity to mediate membrane fusion[J]. Cell Res, 2020, 30(4):343-355. doi: 10.1038/s41422-020-0305-x [13] LI G D, HILGENFELD R, WHITLEY R, et al. Therapeutic strategies for COVID-19: progress and lessons learned[J]. Nat Rev Drug Discov, 2023, 22(6):449-475. doi: 10.1038/s41573-023-00672-y [14] LU Y, MING W, LI CZ, et al. Advances in peptidomimetic inhibitors of corona virus main protease[J]. Acta Pharm Sin, 2022(57):1977-1990. [15] PETTERSSON M, CREWS C M. PROteolysis TArgeting chimeras(PROTACs): past, present and future[J]. Drug Discov Today Technol, 2019, 31:15-27. doi: 10.1016/j.ddtec.2019.01.002 [16] CROMM P M, CREWS C M. Targeted protein degradation: from chemical biology to drug discovery[J]. Cell Chem Biol, 2017, 24(9):1181-1190. doi: 10.1016/j.chembiol.2017.05.024 [17] ZENG S X, HUANG W H, ZHENG X L, et al. Proteolysis targeting Chimera(PROTAC)in drug discovery paradigm: Recent progress and future challenges[J]. Eur J Med Chem, 2021, 210:112981. doi: 10.1016/j.ejmech.2020.112981 [18] CHIRNOMAS D, HORNBERGER K R, CREWS C M. Protein degraders enter the clinic: a new approach to cancer therapy[J]. Nat Rev Clin Oncol, 2023, 20:265-278. doi: 10.1038/s41571-023-00736-3 [19] YIN L N, HU Q Z. Chimera induced protein degradation: PROTACs and beyond[J]. Eur J Med Chem, 2020, 206:112494. doi: 10.1016/j.ejmech.2020.112494 [20] ALUGUBELLI Y R, XIAO J, KHATUA K, et al. Discovery of first-in-class PROTAC degraders of SARS-CoV-2 main protease[J]. J Med Chem, 2024, 67(8):6495-6507. doi: 10.1021/acs.jmedchem.3c02416 [21] NALAWANSHA D A, CREWS C M. PROTACs: an emerging therapeutic modality in precision medicine[J]. Cell Chem Biol, 2020, 27(8):998-1014. doi: 10.1016/j.chembiol.2020.07.020 [22] SANG X H, WANG J, ZHOU J, et al. A chemical strategy for the degradation of the main protease of SARS-CoV-2 in cells[J]. J Am Chem Soc, 2023, 145(50):27248-27253. doi: 10.1021/jacs.3c12678 [23] GADD M S, TESTA A, LUCAS X, et al. Structural basis of PROTAC cooperative recognition for selective protein degradation[J]. Nat Chem Biol, 2017, 13:514-521. doi: 10.1038/nchembio.2329 [24] PILLAIYAR T, FLURY P, KRÜGER N, et al. Small-molecule thioesters as SARS-CoV-2 main protease inhibitors: enzyme inhibition, structure-activity relationships, antiviral activity, and X-ray structure determination[J]. J Med Chem, 2022, 65(13):9376-9395. doi: 10.1021/acs.jmedchem.2c00636 [25] DE WISPELAERE M, DU G Y, DONOVAN K A, et al. Small molecule degraders of the hepatitis C virus protease reduce susceptibility to resistance mutations[J]. Nat Commun, 2019, 10(1):3468. doi: 10.1038/s41467-019-11429-w [26] BOND M J, CREWS C M. Proteolysis targeting chimeras (PROTACs) come of age: entering the third decade of targeted protein degradation[J]. RSC Chem Biol, 2021, 2(3):725-742. doi: 10.1039/D1CB00011J [27] TOURE M, CREWS C M. Small-molecule PROTACS: new approaches to protein degradation[J]. Angew Chem Int Ed, 2016, 55(6):1966-1973. doi: 10.1002/anie.201507978 [28] PETZOLD G, FISCHER E S, THOMÄ N H. Structural basis of lenalidomide-induced CK1α degradation by the CRL4(CRBN)ubiquitin ligase[J]. Nature, 2016, 532(7597):127-130. doi: 10.1038/nature16979 [29] ZHANG X H, LEE H C, SHIRAZI F, et al. Protein targeting chimeric molecules specific for bromodomain and extra-terminal motif family proteins are active against pre-clinical models of multiple myeloma[J]. Leukemia, 2018, 32(10):2224-2239. doi: 10.1038/s41375-018-0044-x [30] HAN K K, ZHAO D M, LIU Y Z, et al. The ubiquitin-proteasome system is necessary for the replication of duck Tembusu virus[J]. Microb Pathog, 2019, 132:362-368. doi: 10.1016/j.micpath.2019.04.044 -




 下载:
下载: