-
抗生素的发现是人类健康史的一大进步,但由于抗生素在医疗卫生领域和动物卫生领域的过度使用,导致抗生素病原菌耐药性的产生,临床效果减弱。伴随着耐药性的产生,很多人类赖以生存的药物正在迅速失效,治疗手段日益减少,人类的健康和生命受到严重威胁[1]。因此开发新的抗生素和建立新的治疗模式迫在眉睫。
群体感应(QS)是病原菌自发产生某些特定的小分子物质,随着浓度变化,调节自身特定基因的表达,从而改变群体行为的现象。群体感应抑制剂(QSI)作为一种新型抑菌方式,在治疗病原菌感染方面有重要作用,通过不同的方式干扰或阻断病原菌群体感应现象的产生[2],其作用机制不同于目前抗生素以抑制或杀灭病原菌为目的,而是在不对病原菌生长产生压力的前提下,通过阻断病原菌群体感应通路来减少紫色色素、生物被膜、几丁质酶等毒力因子的产生或表达,达到降低病原菌致病性。由于不影响细菌正常生长,因此避免了细菌的生存选择压力,也就减少严重的耐药性问题[3]。
研究表明,很多中药活性成分具有群体感应抑制作用,如肉桂中的肉桂醛对荧光假单胞菌生物膜形成的抑制作用[4],药用植物金丝雀花中提取的邻苯三酚及其类似物对群体感应信号分子呋喃硼酸二酯具有拮抗作用[5],槲皮素和柚皮素能抑制哈维菌BB120和大肠杆菌O157∶H7的生物膜形成[6]。川白芷提取物对铜绿假单胞菌生物膜形成的具有抑制作用[7],马齿苋、板蓝根等中药提取物能明显抑制铜绿假单胞菌的浮游迁移,这些研究为筛选新型抗感染药物提供新的思路,具有非常重要的研究意义和实用价值[8]。
黄酮类化合物因其抗氧化、抗菌和抗癌作用而成为研究的热点[9-11]。淫羊藿(E. brevicornum)为小檗科(Berbridacese)淫羊藿属植物,其主要有效成分中黄酮类化合物含量最高,如宝藿苷、淫羊藿苷、朝藿定A/B/C等黄酮苷类化合物。淫羊藿具有抗炎,提高人体免疫力,抗氧化等多种药理活性,而且黄酮类成分在抗感染以及抗菌防霉有良好的应用前景[12-13]。但淫羊藿在群体抑制方面的研究目前是鲜有报道。
因此,本实验拟测定淫羊藿提取物及5个主要的黄酮苷类化合物对常见条件病原菌(紫色杆菌CV026和铜绿假单胞菌 PAO1)的群体感应抑制作用,为寻找高效的群体感应抑制剂奠定基础,为淫羊藿的进一步开发应用提供理论依据。
-
超声细胞破碎仪(JY99-IIDN,宁波新芝);低温高速离心机(Avanti J-26S XP,美国贝克曼);高压灭菌锅(SANYO MLS-3020,日本);真空干燥箱(DHG-9053A,上海一恒科技有限公司);酶标仪(TECAN infinite M200 pro,瑞士);旋转蒸发仪(BUCHI Rotavator R-200,瑞士);光学显微镜(80i,日本尼康)。
-
化学试剂乙醇(批号:XW00641751)、二甲基亚砜DMSO(批号:XW00676851(均购自国药集团化学试剂有限公司;本实验中所用的抗生素包括妥布霉素(批号:014241281)、硫酸奈替米星(批号:014138073)、庆大霉素(批号:014321472)、环丙沙星(批号:014252858)、淫羊藿苷(批号:01230870)、宝藿苷(批号:014125028)、朝藿定A(批号:045930800)、朝藿定B(批号:045930801)、朝藿定C(批号:041603427)、对照品水杨酸(批号:013474062)、LB培养基(批号:041417503)均购自上海泰坦科技股份有限公司;几丁质酶活性检测试剂盒(批号:BC0825,购自北京索莱宝公司);淫羊藿(购自湖北十堰丹江口铜架山村毛家坪淫羊藿种植基地,由海军军医大学中药鉴定学教研室张成中副教授鉴定);紫色杆菌CV026、铜绿假单胞菌 PAO1(购自广东省微生物菌种保藏中心,菌种均于−80℃冰箱冻存)。
-
淫羊藿药材50℃烘干,粉碎,过40目筛,保存备用。称取5.0 g淫羊藿粉末,加入100 ml 75% 乙醇,超声破碎30 min,过夜静置,过滤取上清,上清液减压浓缩至浸膏。溶于1% DMSO溶液中,过滤,分装,−20℃保存备用。淫羊藿提取物的质量浓度为 0.5 mg/ml。
将淫羊藿苷、宝藿苷、朝藿定A/B/C、水杨酸分别称取2.00 mg 溶于1 ml DMSO溶液(1%)中,得到浓度为2 000 μg/ml的标准品母液,−20℃保存备用。将抗生素妥布霉素、硫酸奈替米星、庆大霉素、环丙沙星溶于1 ml DMSO溶液(1%)中,得到浓度为100 μg/ml的标准品母液,−20℃保存备用。
-
菌株活化后按1%接种量接种于现配LB培养基,37℃,220 r/min震荡培养至OD600nm为0.4~0.6。加入上述制备的样品,采用2倍稀释法梯度稀释,DMSO为阴性对照,在2、4、6、8、10 h分别测定OD620nm值,实验进行3个重复,测定最小抑菌浓度(MIC)。
-
按1.4实验结果,本实验按200 μg/ml以下浓度进行,制备不同浓度样品(最终浓度分别为25、50、100 μg/ml)的CV026菌液,加入C6-HSL终浓度为5 μmol/L,28℃培养24 h。DMSO为阴性对照。取3 ml培养液,12 000 r/min离心10 min,弃上清液,加入1 ml 酸化乙醇(4%,1 mol/L HCl),充分混匀,离心,取上清液,534 nm处测定吸光值[14]。按下式计算抑制率[15]。
$$ \text{抑制率(\%)}=\frac{\text{对照组}\mathrm{O}\mathrm{D}\text{值}-\text{实验组}\mathrm{O}\mathrm{D}\text{值}}{\text{对照组}\mathrm{O}\mathrm{D}\text{值}}\times 100\text{%} $$ -
将铜绿假单胞菌 PAO1培养物稀释至现配LB中,将样品(终浓度100 μg/ml)加入到实验组,并将DMSO作为阴性对照组,水杨酸作为阳性对照。将200 μl样品添加到96孔平板中,在37℃下温育24 h,除去悬浮培养物。利用光学显微镜观察后,用无菌磷酸盐缓冲盐水PBS(pH 7.2)洗涤,保持不破坏底部生物被膜。将200 μl的LB培养基和溶解有样品(终浓度100 μg/ml),DMSO(阴性对照)及具有抗生素的LB培养基添加到96孔板中。适当摇动,将平板在37℃下再温育24 h。使用酶标仪在620 nm(OD620)处测量光密度[16]。
-
将铜绿假单胞菌 PAO1培养物稀释至现配LB中,将样品(终浓度100 μg/ml)加入到实验组,并将DMSO作为阴性对照组,水杨酸作为阳性对照。使用几丁质酶活性检测试剂盒,将1 ml的提取液加入到1 ml培养物中,10 000 r/min,4℃离心20 min,取上清液,分别沸水浴反应 10 min,置于冰上暂存。在540 nm下测定每管的吸光度,对比标准曲线计算几丁质酶活性[17]。
-
根据紫色杆菌CV026和铜绿假单胞菌 PAO1的生长情况,以及测定培养物的OD值,确定淫羊藿提取物及活性成分对紫色杆菌CV026和铜绿假单胞菌 PAO1的MIC值见表1。淫羊藿提取物及五种黄酮苷的MIC都在500 μg/ml。因此,后续实验测定选择200 μg/ml以下的浓度对于紫色杆菌CV026和铜绿假单胞菌PAO1生长均无抑制作用。
表 1 样品对紫色杆菌CV026和铜绿假单胞菌 PAO1的MIC值
样品 MIC(μg/ml) CV026 PAO1 淫羊藿提取物 >2 000 >2 000 宝藿苷 500 500 淫羊藿苷 500 500 朝藿定A 500 500 朝藿定B 500 500 朝藿定C 500 500 妥布霉素 0.25 0.5 奈替米星 2 1 庆大霉素 1 1 环丙沙星 2 2 -
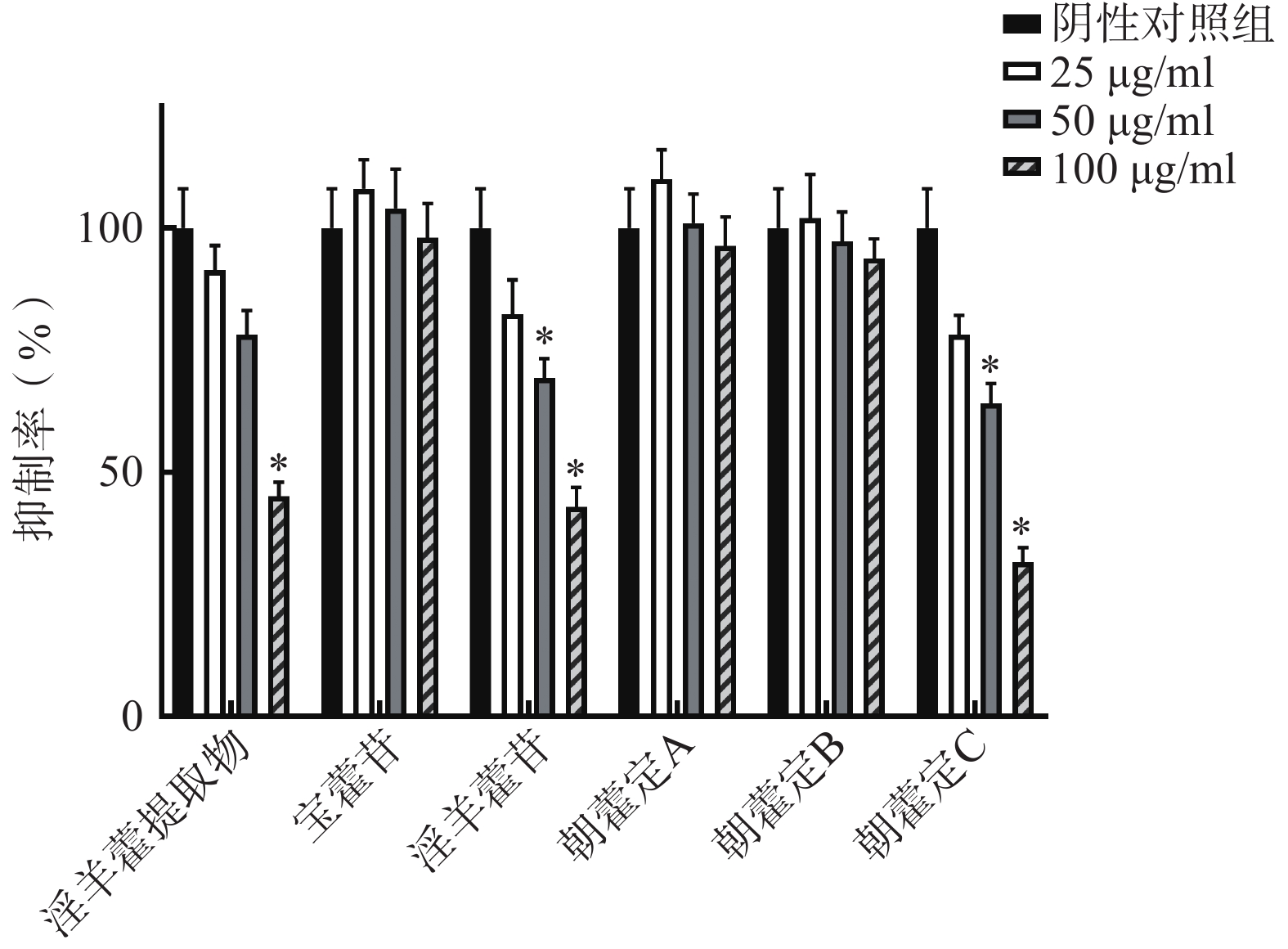
紫色杆菌群体感应的特殊现象就是产生紫色色素,对6个样品进行浓度梯度实验,样品对于CV026群体感应的抑制作用可以通过检测紫色色素的产生量进行判定。实验结果显示,淫羊藿提取物、淫羊藿苷和朝藿定C对CV026紫色色素的产生有抑制作用,且随着样品浓度升高而增强,淫羊藿苷和朝藿定C浓度达到100 μg/ml时,其抑制率可达到42.9%和31.9%,与阴性对照组(DMSO)相比有显著差异(P<0.05,图1)。结果表明,淫羊藿苷和朝藿定C在不影响CV026生长的情况下,具有良好的群体感应抑制作用。
-
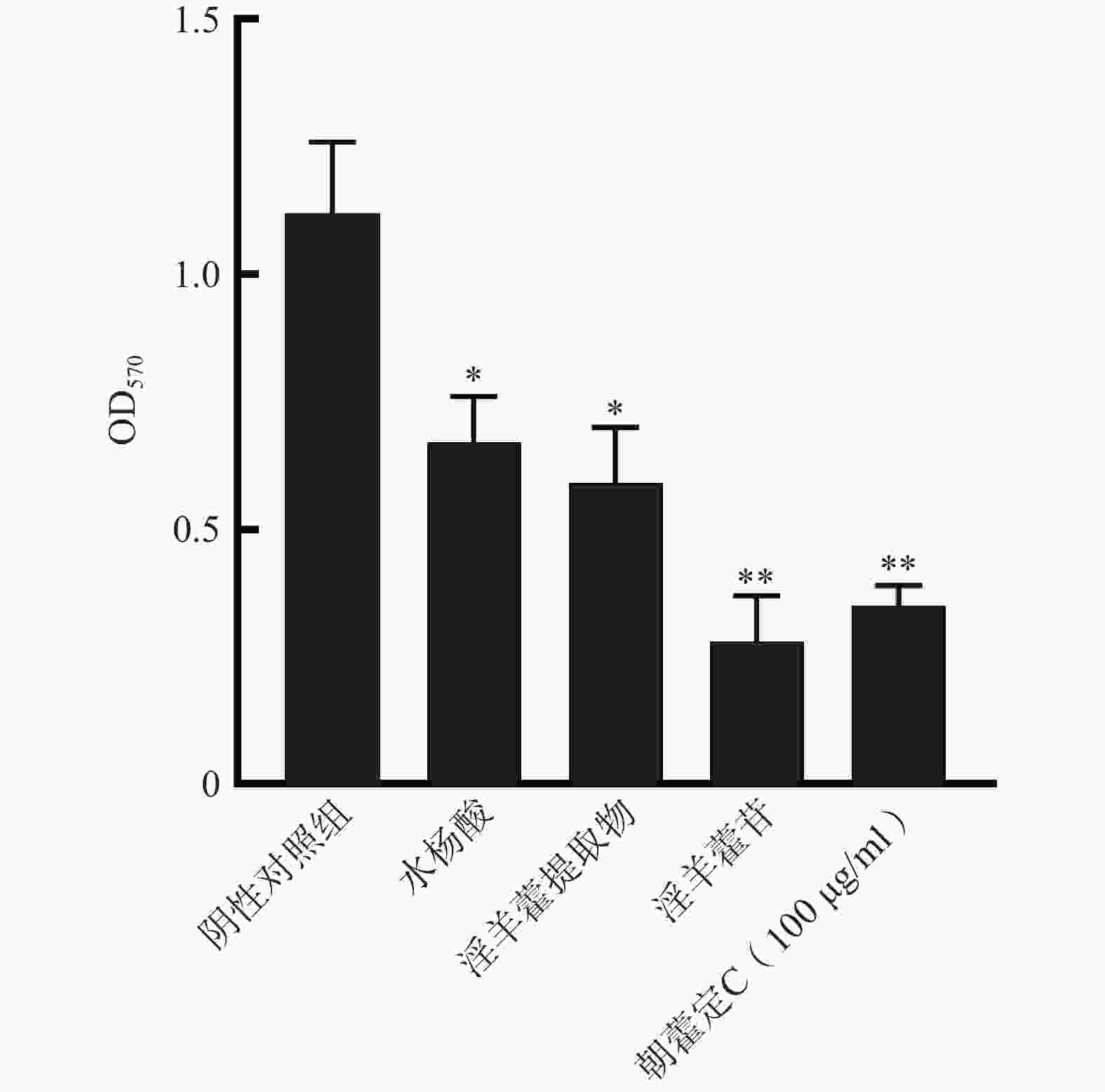
生物被膜的产生是导致抗生素耐药的主要原因之一。铜绿假单胞菌能生成高度结构化和致密的生物被膜,多与群体感应有关。本实验利用光学显微镜对细胞爬片上的生物膜进行观察,利用酶标仪对其定量测定,结果如图2所示。淫羊藿苷与朝藿定C(100 μg/ml)均表现出优于阳性对照水杨酸的抑制活性,与阴性对照组(DMSO)相比有显著差异(P<0.05, P<0.01)。
-
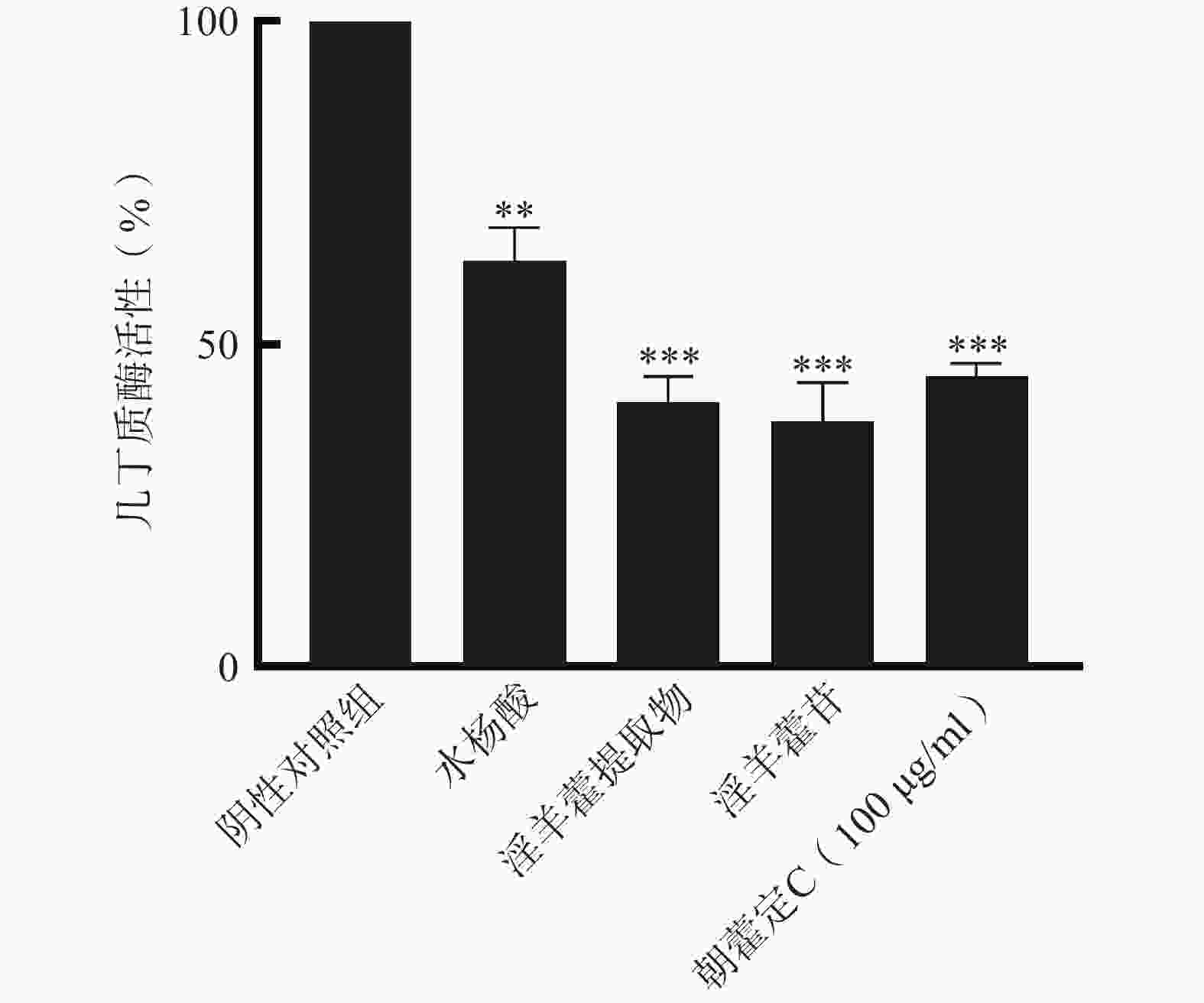
几丁质酶是真菌和细菌生物被膜中的重要成分,是一种中药的毒力因子,能够帮助病原菌穿透组织侵袭宿主。本实验通过淫羊藿提取物、淫羊藿苷、朝藿定C(100 μg/ml)对铜绿假单胞菌 PAO1培养物进行处理,结果表明淫羊藿提取物、淫羊藿苷、朝藿定C(100 μg/ml)可大大降低几丁质酶活性。几丁质酶活性分别降低了41%、38%和45%(图3),与阴性对照组比较有显著差异(P<0.01,P<0.001)。
-
本实验利用群体感应抑制研究的模式菌株CV026紫色杆菌、PAO1铜绿假单胞菌对淫羊藿提取物及其主要的黄酮苷类成分进行了MIC的测定,发现其在500 μg/ml浓度下不影响病原菌的正常生长,随后分别对紫色色素、生物被膜、几丁质酶等毒力因子进行测定,发现淫羊藿苷、朝藿定C(100 μg /ml)对紫色杆菌CV026和铜绿假单胞菌 PAO1的群体感应具有抑制作用。
随着常见致病菌的耐药性的增多,通过抑制或沉默致病菌群体感应的方法被认为是解决耐药性的途径之一,本实验中涉及到的作为研究群体感应的模式菌株得到了大量的应用,在此基础上挖掘出大量具有潜力的QSI,例如绿茶中的茶多酚、西柚中的香豆素、百里香中的香芹酚以及白藜芦醇、山奈酚、槲皮素等[9-11,18-19]。淫羊藿中的黄酮苷类成分与上述的潜力QSI有着结构上的相似性,因此推测可能是黄酮类的化合物结构与QS系统的信号分子相似,当其处于高浓度时可能会与QS系统中的某些信号分子受体产生竞争性结合,以此抢占活性受体靶标,阻断了QS系统传导,最终导致细菌毒力因子的表达下降。
黄酮苷类成分作为淫羊藿的主要活性成分,尤其是本实验中发现的淫羊藿苷和朝藿定C两个活性单体可以作为抗感染治疗的一种潜在前体,与上述潜力QSI有一定差异性,前者大多是以苷元的形式存在,其水溶性较差,而本文中提到的淫羊藿苷和朝藿定C分别带有二糖和三糖基修饰,其水溶性大大的增强,在进入生物体后,水解生成黄酮苷元发挥抑制作用,可能具有更高的生物利用度。
Quorum-sensing inhibition of flavonoid glycosides from Epimedium brevicornum
-
摘要:
目的 从淫羊藿中发现具有群体感应抑制作用的黄酮苷类成分,并对其活性进行评价。 方法 首先测定淫羊藿中5个主要的黄酮苷类化合物(宝藿苷、淫羊藿苷、朝藿定A/B/C)及淫羊藿提取物的最小抑菌浓度(MIC)值,随后利用酶标仪测定对紫色杆菌CV026的紫色色素产生的抑制作用,再利用对铜绿假单胞菌 PAO1的生物被膜以及几丁质酶进行定量测定。 结果 淫羊藿提取物及其主要成分具有群体感应抑制活性作用,其中,淫羊藿苷、朝藿定C(100 μg /ml)作用明显。 结论 中药淫羊藿具有对紫色杆菌CV026和铜绿假单胞菌 PAO1的群体感应系统有抑制作用,其中,淫羊藿苷和朝藿定C有望发展成为一种群体感应抑制剂的新药。 -
关键词:
- 淫羊藿 /
- 群体感应 /
- 紫色杆菌CV026 /
- 铜绿假单胞菌 PAO1
Abstract:Objective To identify flavonoid glycosides with quorum sensing inhibitory activity from Epimedium brevicornum and evaluate their bioactivity. Methods The minimum inhibitory concentrations (MICs) of five major flavonoid glycosides (baohuoside, icariin, epimedin A/B/C) and the extract of E. brevicornum were firstly determined. Subsequently, the inhibitory effects on the production of purple pigments in Chromobacterium violaceum CV026 were measured. Additionally, the biofilm formation and chitin quantification of Pseudomonas aeruginosa PAO1 were assessed. Results The extract of E. brevicornum and its primary components exhibited significant quorum sensing inhibitory activity. Particularly, icariin and epimedin C demonstrated superior inhibitory activity. Conclusion E. brevicornum demonstrates the ability to inhibit the quorum sensing system of Chromobacterium violaceum CV026 and Pseudomonas aeruginosa PAO1. Furthermore, icariin and epimedin C (100 μg/ml) show promise for development into novel drugs for quorum sensing inhibitor. -
表 1 样品对紫色杆菌CV026和铜绿假单胞菌 PAO1的MIC值
样品 MIC(μg/ml) CV026 PAO1 淫羊藿提取物 >2 000 >2 000 宝藿苷 500 500 淫羊藿苷 500 500 朝藿定A 500 500 朝藿定B 500 500 朝藿定C 500 500 妥布霉素 0.25 0.5 奈替米星 2 1 庆大霉素 1 1 环丙沙星 2 2 -
[1] COATES A R M, HU Y M, HOLT J, et al. Antibiotic combination therapy against resistant bacterial infections: synergy, rejuvenation and resistance reduction[J]. Expert Rev Anti Infect Ther, 2020, 18(1):5-15. doi: 10.1080/14787210.2020.1705155 [2] NEALSON K H, PLATT T, HASTINGS J W. Cellular control of the synthesis and activity of the bacterial luminescent system[J]. J Bacteriol, 1970, 104(1):313-322. doi: 10.1128/jb.104.1.313-322.1970 [3] RASMUSSEN T B, BJARNSHOLT T, SKINDERSOE M E, et al. Screening for quorum-sensing inhibitors(QSI)by use of a novel genetic system, the QSI selector[J]. J Bacteriol, 2005, 187(5):1799-1814. doi: 10.1128/JB.187.5.1799-1814.2005 [4] 綦国红, 井佳丽, 杨志萍, 等. 肉桂醛对荧光假单胞菌生物膜形成的抑制作用[J]. 食品工业科技, 2017, 38(21):147-150. [5] NI N, CHOUDHARY G, LI M, et al. Pyrogallol and its analogs can antagonize bacterial quorum sensing in Vibrio harveyi[J]. Bioorg Med Chem Lett, 2008, 18(5):1567-1572. doi: 10.1016/j.bmcl.2008.01.081 [6] NIKOLAKAKIS K, AMBER S, WILBUR J S, et al. The toxin/immunity network of Burkholderia pseudomallei contact‐dependent growth inhibition(CDI) systems[J]. Mol microbiol, 2012, 84(3):516-529. doi: 10.1111/j.1365-2958.2012.08039.x [7] 刘洋, 冉聪, 刘琼, 等. 川白芷抑菌活性及对铜绿假单胞菌群体感应的抑制作用[J]. 天然产物研究与开发, 2019, 31:135-141. [8] 石倩, 谢林香, 陈立志, 等. 17种中草药细菌群体感应抑制剂的筛选[J]. 广东农业科学, 2014, 41(10):77-80. doi: 10.3969/j.issn.1004-874X.2014.10.019 [9] NICHOLSON R L, HAMMERSCHMIDT R. Phenolic compounds and their role in disease resistance[J]. Annu Rev Phytopathol, 1992, 30:369-389. doi: 10.1146/annurev.py.30.090192.002101 [10] PACKIAVATHY I A, PRIYA S, PANDIAN S K, et al. Inhibition of biofilm development of uropathogens by curcumin - an anti-quorum sensing agent from Curcuma longa[J]. Food Chem, 2014, 148:453-460. doi: 10.1016/j.foodchem.2012.08.002 [11] MYSZKA K, SCHMIDT M T, MAJCHER M, et al. Inhibition of quorum sensing-related biofilm of Pseudomonas fluorescens KM121 by Thymus vulgare essential oil and its major bioactive compounds[J]. Int Biodeterior Biodegrad, 2016, 114:252-259. doi: 10.1016/j.ibiod.2016.07.006 [12] 齐芸, 郑永先. 淫羊藿苷抗肿瘤作用机制研究进展[J]. 中医药导报, 2022, 28(8):153-157. [13] 胡梅, 梁政, 黎天良, 等. 淫羊藿水提取物联合抗菌药对耐药大肠杆菌的体外抑制效果[J]. 南方农业学报, 2016, 47(10):1778-1783. doi: 10.3969/jissn.2095-1191.2016.10.1778 [14] SHEPHERD J, SWIFT T, CHANG C Y, et al. Highly branched poly(N-isopropyl acrylamide)functionalized with an inducer molecule suppresses quorum sensing in Chromobacterium violaceum[J]. Chem Commun, 2019, 55(66):9765-9768. doi: 10.1039/C9CC02524C [15] EVANS K C, BENOMAR S, CAMUY-VÉLEZ L A, et al. Quorum-sensing control of antibiotic resistance stabilizes cooperation in Chromobacterium violaceum[J]. ISME J, 2018, 12(5):1263-1272. doi: 10.1038/s41396-018-0047-7 [16] SETHUPATHY S, ANANTHI S, SELVARAJ A, et al. Vanillic acid from Actinidia deliciosa impedes virulence in Serratia marcescens by affecting S-layer, flagellin and fatty acid biosynthesis proteins[J]. Sci Rep, 2017, 7(1):16328. doi: 10.1038/s41598-017-16507-x [17] D’ALMEIDA R E, MOLINA R D I, VIOLA C M, et al. Comparison of seven structurally related coumarins on the inhibition of Quorum sensing of Pseudomonas aeruginosa and Chromobacterium violaceum[J]. Bioorg Chem, 2017, 73:37-42. doi: 10.1016/j.bioorg.2017.05.011 [18] 郭冰怡, 董燕红. 细菌群体感应抑制剂研究进展[J]. 农药学学报, 2018, 20(4):408-424. [19] WANG J H, LU X Y, WANG C J, et al. Research progress on the combination of quorum-sensing inhibitors and antibiotics against bacterial resistance[J]. Molecules, 2024, 29(7):1674. doi: 10.3390/molecules29071674 -




 下载:
下载: