-
胰腺癌是一种病死率极高的消化道恶性肿瘤 [1]。超过80%以上的患者一旦确诊即是晚期,手术难以根治,需在术后进行辅助化疗、放疗、对症支持治疗等 [2]。盐酸吉西他滨(hcGEM)是治疗胰腺癌的一线化疗药。由于存在半衰期短、产生耐药性及不可避免的毒副作用等问题,其疗效不尽如人意[3]。因此,hcGEM的临床应用需要联合化疗来提高疗效[4]。
铁死亡是一种铁依赖的非凋亡性细胞死亡形式,针对铁死亡的治疗策略可能为传统疗法难以攻克的癌症提供新的治疗思路 [5]。埃拉斯汀 (Era)作为一种高效持久的铁死亡诱导剂,它可以激活多种信号通路来触发癌细胞的铁死亡 [6]。柳氮磺胺吡啶(SASP)是一种能抑制铁死亡相关的胱氨酸-谷氨酸逆向转运蛋白的抗炎药,可通过降低癌细胞对胱氨酸的摄取以及胞内谷胱甘肽水平来抑制胰腺癌细胞的生长[7]。青蒿琥酯(Art)是一种青蒿素的衍生物,除用作抗疟治疗外,可通过促进铁蛋白吞噬来增加细胞内游离铁水平,进而引发癌细胞的铁死亡[8]。铁死亡诱导剂与盐酸吉西他滨联合应用可能是胰腺癌治疗的潜在策略[9]。
本研究分别考察Era、SASP和Art这三种铁死亡诱导剂单独或联合hcGEM使用,对人胰腺癌PANC-1细胞的增殖抑制作用,以期发现具有潜在协同抑制的联合方案,为今后开发胰腺癌新疗法奠定基础。
-
盐酸吉西他滨、柳氮磺胺吡啶、埃拉斯汀(美国MCE公司);青蒿琥酯(上海泰坦科技股份有限公司);胎牛血清、青链霉素、胰酶(以色列BI公司);DMEM高糖培养基、PBS缓冲液(上海泰坦科技股份有限公司),CCK- 8细胞毒性试剂盒(日本同仁化学研究所)。
-
人胰腺癌PANC-1细胞,来源于海军军医大学第一附属医院消化内科,冻存复苏后培养于含10%胎牛血清的DMEM高糖培养基。
-
人胰腺癌PANC-1细胞用DMEM完全培养基(含10 %胎牛血清,1 %青-链霉素)于5 % CO2、37 ℃的恒温培养箱中培养。待细胞融合度达80 %~90 %时,移除旧培养基,PBS缓冲液清洗2遍后加入适当体积的胰蛋白酶消化3 min。待大部分细胞镜下变圆,小部分细胞脱落时,加入2倍胰酶体积的完全培养基终止消化,充分吹打使细胞脱离。将细胞悬液以1 000 r/min转速,离心5 min,弃上清液,加入2 ml完全培养基重悬,并按1∶2的比例均匀接种于两个培养皿,加入8 ml完全培养基水平摇匀后置于恒温细胞培养箱内培养,取对数生长期的细胞进行后续细胞毒性实验。
-
将实验细胞单独用药组根据药物种类与浓度不同,分为hcGEM单药组(hcGEM: 0.015 625、0.031 25、0.062 5、0.125、0.25、0.5、1、2、4 μmol/L),Era单药组(Era:0.25、0.5、1、2、4、8、16、32、64 μmol/L),SASP单药组(SASP: 6.25、12.5、25、50、100、200、400、800、1600 μmol/L)以及Art单药组(Art:0.5、1、2、4、8、16、32、64、128 μmol/L),每种药物都按2倍比率设置浓度梯度,每组各9个浓度;联合用药组根据联合药物组成与比例不同分为hcGEM-Era联合用药组(包括4∶1、1∶1、1∶4和1∶16 联合组)、hcGEM-SASP联合用药组(包括4∶1、1∶1、1∶20和1∶400联合组)、hcGEM-Art联合用药组(包括 2∶1、1∶1、1∶4和1∶16联合组)。每个联合用药组中,hcGEM的浓度均为相同的浓度梯度(hcGEM: 0.015 625、0.031 25、0.062 5、0.125、0.25、0.5、1、2、4 μmol/L),并与恒定比例的联合药物共同作用于细胞。hcGEM-Era 1∶16联合组的药物浓度梯度为0.015 625 μmol/L hcGEM+0.25 μmol/L Era、0.031 25 μmol/L hcGEM+0.5 μmol/L Era、0.062 5 μmol/L hcGEM+1 μmol/L Era、0.125 μmol/L hcGEM+2 μmol/L Era、0.25 μmol/L hcGEM+4 μmol/L Era、0.5 μmol/L hcGEM+8 μmol/L Era、1 μmol/L hcGEM+16 μmol/L Era、2 μmol/L hcGEM+32 μmol/L Era、4 μmol/L hcGEM+64 μmol/L Era。
-
取对数生长的PANC-1细胞接种于96孔板,密度为5 000个细胞/孔。待细胞贴壁24 h后,弃上清液,每3个复孔加入100 μl不同浓度的每种药物,另设空白对照组与药物未处理组各3个复孔。药物与细胞共培养48 h后,每孔加入含10% CCK-8的DMEM培养基。于恒温培养2 h后,用酶标仪测量450 nm波长下各孔的吸光度值(A值)。使用GraphPad Prism 8.0.2软件对数据进行非线性回归分析,得到各组药物作用于细胞的半数抑制浓度(IC50) 以及细胞增殖抑制率,具体公式为:抑制率=[1−(A用药组−A空白组)/(A未用药组−A空白组)]×100%。
-
根据单独用药组与联合用药组的摩尔浓度与细胞增殖抑制率,使用CompuSyn软件计算联合指数(CI),并依据CI值判断药物的联合效果: CI>1表示拮抗作用;CI=1表示相加作用;CI<1表示协同作用,且协同抑制效果随CI值的减小而增强。
-
实验结果以(
$\bar x $ ±s)表示,采用GraphPad Prism 8.0.2软件进行数据的处理分析,多组间比较采用单因素方差分析,两组间比较采用t检验。P<0.05表示组间差异有统计学意义。 -
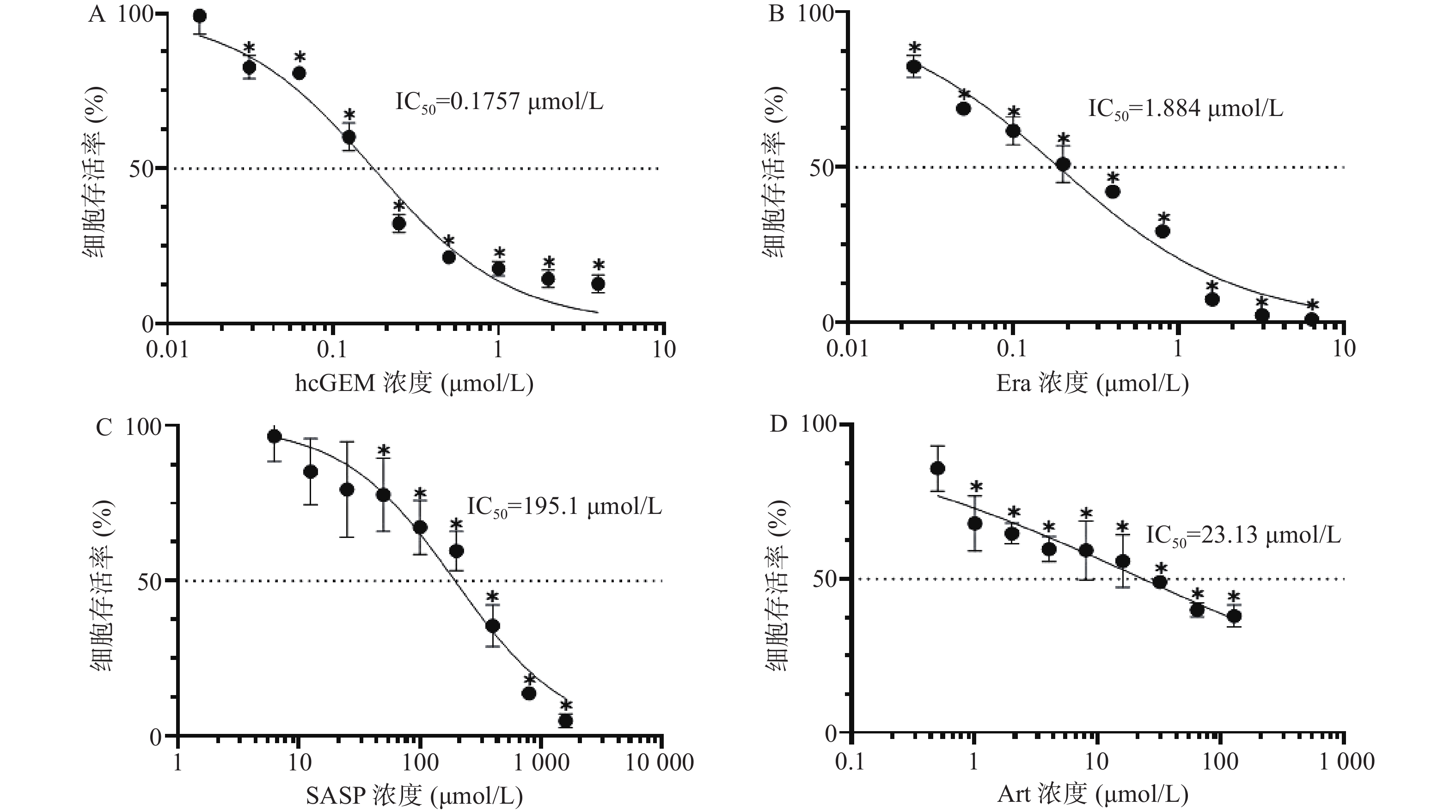
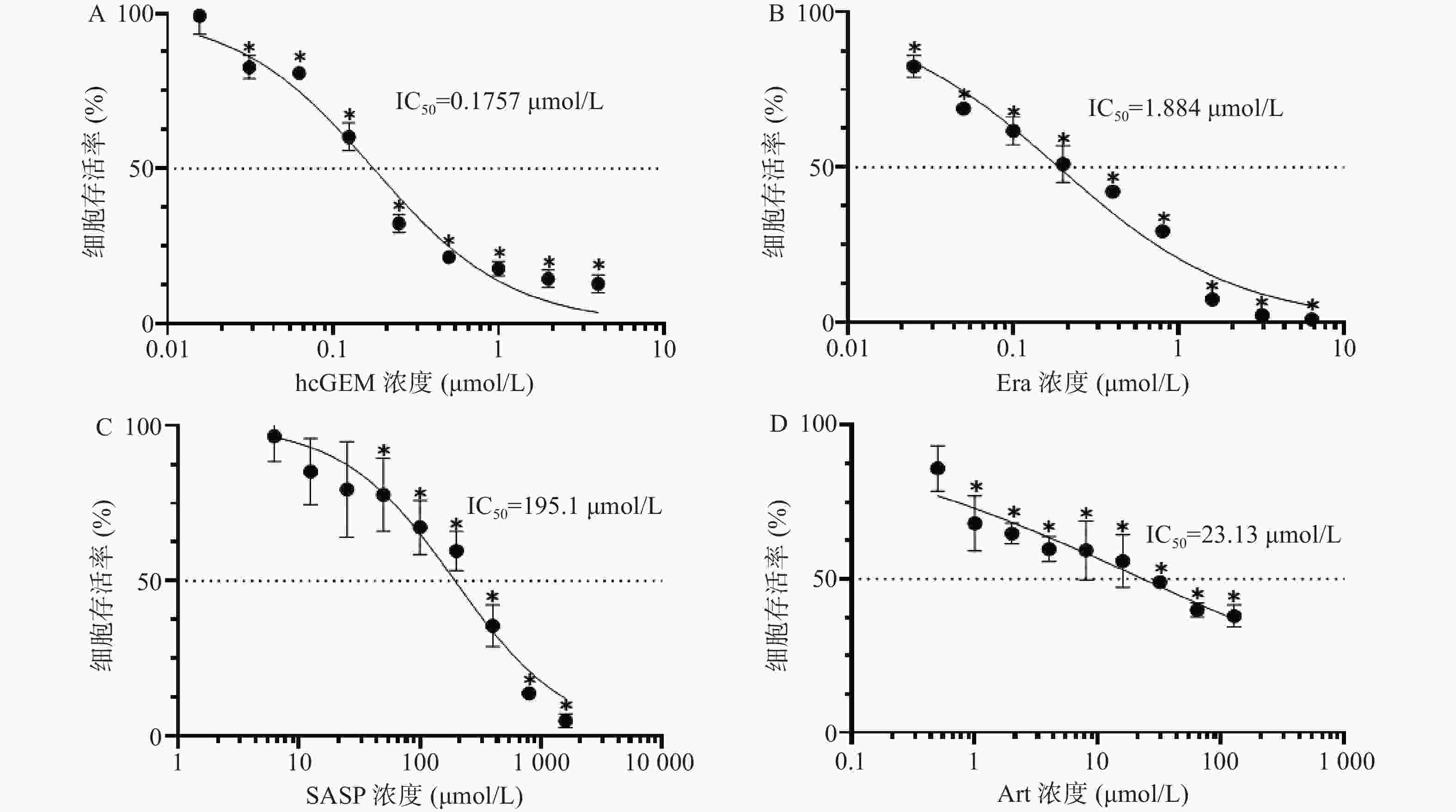
如图1所示,hcGEM、Era、SASP、Art单独作用于PANC-1细胞时可明显抑制细胞的增殖,并且这种抑制作用呈现剂量依赖性。hcGEM、Era、SASP、Art作用于PANC-1细胞的IC50值分别为0.175 7、1.884、195.1、23.13 μmol/L。hcGEM单独用药时,小于0.015 625 μmol/L的剂量对PANC-1细胞的生长几乎无抑制作用,存活率>95%(P>0.05);剂量大于2 μmol/L时,细胞的活性受到显著抑制,存活率<15%(P<0.05)。Era单独用药时,大于16 μmol/L 的剂量能显著抑制PANC-1细胞的生长,存活率<10%(P<0.05),而小于0.25 μmol/L的剂量会使80%以上的细胞存活。SASP单独用药时,大于800 μmol/L的剂量能抑制PANC-1细胞的生长,存活率<15%(P<0.05),而小于12.5 μmol/L的剂量仅轻微抑制PANC-1细胞存活,存活率>85%(P>0.05)。Art单独用药时,大于128 μmol/L的剂量能显著抑制PANC-1细胞的生长,存活率<40%(P<0.05),而小于0.5 μmol/L时,仅能轻微抑制细胞增殖,存活率>85%(P>0.05)。
-
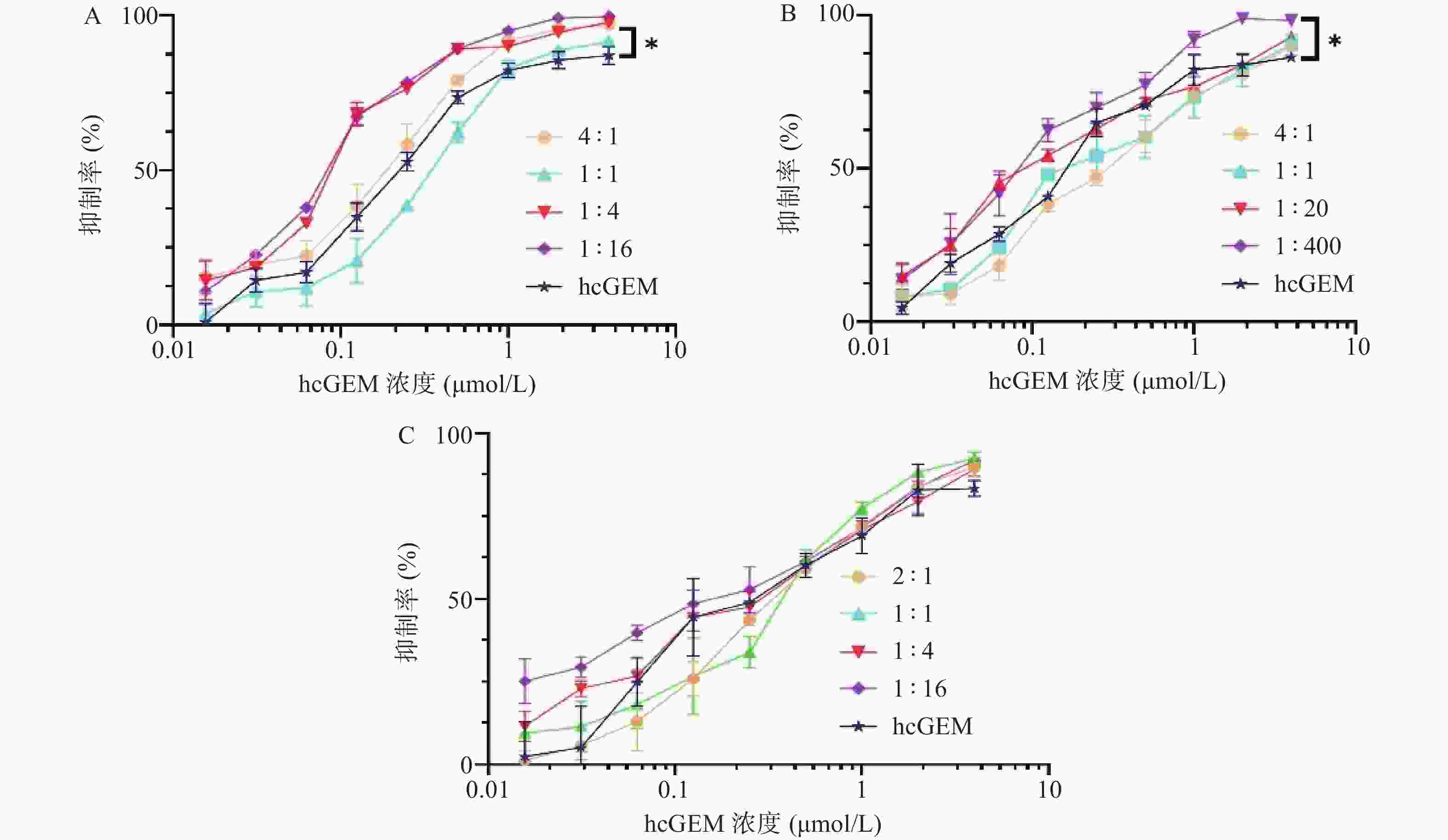
在研究单药对PANC-1细胞抑制效果的基础上,我们进一步探究了hcGEM-Era 4∶1、1∶1、1∶4和1∶16 联合用药,hcGEM-SASP 4∶1、1∶1、1∶20和1∶400联合用药,以及hcGEM-Art 2∶1、1∶1、1∶4和1∶16联合用药,对PANC-1细胞的抑制效果。如图2所示, hcGEM-Era、hcGEM-SASP以及hcGEM-Art联合用药组的抑制效果随着浓度的增加而提高。其中,hcGEM-Era 4∶1、1∶4、1∶16联合组,以及hcGEM-SASP 1∶400联合组对PANC-1细胞抑制效果在所有浓度梯度范围均优于hcGEM组(P<0.05)。此外,hcGEM-Era 4∶1、1∶4、1∶16联合用药组,hcGEM-SASP 1∶20、1∶400联合组,和hcGEM-Art 1∶16联合组的IC50值均小于0.1757 μmol/L(hcGEM单药组的IC50),说明上述联合用药能在一定程度上提高对PANC-1细胞的抑制效果。不同联合用药组hcGEM的IC50值见表1。
表 1 hcGEM联合三种铁死亡诱导剂对胰腺癌PANC-1细胞作用时的IC50值
组别 摩尔浓度比 IC50(μmol/L,hcGEM) hcGEM-Era联合组 1∶0.25 0.140 3±0.009 1 1∶1 0.340 2±0.018 3 1∶4 0.091 3±0.005 1 1∶16 0.083 3±0.002 5 hcGEM-SASP联合组 1∶0.25 0.297 5±0.016 1 1∶1 0.240 2±0.021 2 1∶20 0.120 8±0.008 9 1∶400 0.092 6±0.006 7 hcGEM-Art联合组 1∶0.5 0.366 4±0.018 7 1∶1 0.344 4±0.026 3 1∶4 0.249 3±0.015 7 1∶16 0.154 6±0.013 5 -
为了研究hcGEM分别与Era、SASP、Art联合用药,对PANC-1细胞是否具有协同抑制作用,我们分别设计了hcGEM与三种铁死亡诱导剂的4种不同比例的联用方案,来探讨不同联合用药组对PANC-1细胞的协同抑制效果。CompuSyn软件分析结果显示,hcGEM-Era 4∶1或1∶4联用组在所有药物浓度下均能对PANC-1细胞产生良好的协同抑制效果(CI<1),且4∶1联用组的协同抑制效果略优于1∶4联用组。对于hcGEM-Era 1∶16联用组,CI值随着联合药物浓度的增加而减小,说明该比例下两药协同抑制效果随着浓度增大有所增强,而hcGEM-Era 1∶1联用组的CI值,仅除1 μmol/LhcGEM+1 μmol/L Era、0.031 25 μmol/L hcGEM+0.031 25 μmol/L Era联用组的CI<1外,其余浓度组CI>1,说明hcGEM-Era 1∶1联用组对PANC-1细胞几乎无协同抑制效果(图3A)。
对于hcGEM与SASP联合用药组对PANC-1细胞的协同抑制效果,CompuSyn分析结果提示,hcGEM-SASP 4∶1联用对PANC-1细胞没有协同作用(CI>1),而hcGEM-SASP 1∶1联用组除了0.25 μmol/L hcGEM+0.25 μmol/L SASP、0.125 μmol/L hcGEM+0.125 μmol/LSASP联用组CI<1外,其余联用浓度组的CI>1,表明hcGEM-SASP 1∶1联合用药对PANC-1细胞几乎无协同抑制作用。hcGEM-SASP 1∶20联合用药对PANC-1细胞,除了1 μmol/LhcGEM+20 μmol/L SASP、2 μmol/L hcGEM+40 μmol/LSASP联用组CI>1外,其余浓度组CI<1,提示hcGEM-SASP 1∶20联合用药对PANC-1细胞主要是协同抑制效果,且协同效果随着浓度的增加而减弱。hcGEM-SASP 1∶400联合用药对PANC-1细胞有良好的协同抑制效果(CI<1),且协同效果随着浓度的增加而增强(图3B)。
对于hcGEM与Art联合用药组对PANC-1细胞的协同抑制效果,CompuSyn结果提示,hcGEM-Art 2∶1联用组在0.031 25 ~0.25 μmol/L hcGEM联合浓度范围内CI <1,且接近1,其余联合浓度组的CI>1,表明hcGEM-Art 2∶1联合用药对PANC-1细胞几乎无协同抑制作用。hcGEM-Art 1∶1联用组CI>1,表明hcGEM-Art 1∶1联合用药对PANC-1细胞无协同抑制作用。hcGEM-Art 1∶4联用组仅在0.031 25~0.125 μmol/L hcGEM联合浓度范围内CI<1,其余联合浓度范围内CI>1,表明hcGEM-Art 1∶4联合用药对PANC-1细胞仅在0.031 25~0.125 μmol/L hcGEM联合浓度范围内存在协同抑制作用。 hcGEM-Art 1∶16联用组在0.015 625~0.25 μmol/L hcGEM联合浓度范围内CI <1,其余联合浓度范围内CI>1,表明hcGEM-Art 1∶16联用组在0.015 625~0.25 μmol/L hcGEM联合浓度范围内对PANC-1细胞有协同抑制作用 (图3C)。
-
目前,胰腺癌的一线治疗标准为吉西他滨联合白蛋白结合型紫杉醇或者FOLFIRONOX组合(5-氟尿嘧啶、亚叶酸钙、伊立替康和奥沙利铂)[10]。吉西他滨在一定程度上能提高患者的生存率,但耐药性的出现以及毒副作用限制了临床治疗效果,故临床上常将其与其他化疗药联合使用来提高其疗效[11]。近来大量研究证实,诱导癌细胞铁死亡可能对包括胰腺癌在内的多种类型癌症有效[12]。自2003年发现小分子铁死亡诱导剂埃拉斯汀至今,研究人员已发现多种铁死亡诱导剂,如RSL3、Sorafeni、SASP、Art等[13]。本研究选取了三种铁死亡诱导剂Era、SASP以及Art,首先研究了三种铁死亡诱导剂单独应用对PANC-1细胞的增殖抑制作用。通过CCK-8法检测了三种铁死亡诱导剂的细胞毒性作用,我们发现Era对PANC-1细胞的IC50最小,而SASP的IC50最大,表明在这三种铁死亡诱导剂中,Era对PANC-1细胞的抑制作用最强,而SASP最弱。三种铁死亡诱导剂单独使用对PANC-1细胞的增殖抑制作用呈现剂量依赖性,即浓度越大抑制效果越强。
为了进一步探究三种铁死亡诱导剂Era、SASP、Art与hcGEM联用是否对胰腺癌PANC-1细胞具有协同抑制作用,本研究设计了不同比例的联合用药组来探索最佳的联合协同方案。本次研究结果显示,当三种铁死亡诱导剂分别与hcGEM联合使用时, hcGEM-Era 4∶1或1∶4联用组,hcGEM-SASP 1∶400联用组对PANC-1细胞具有良好的协同抑制效果。hcGEM-Art 1∶4或1∶16联用组仅在一定浓度范围内对PANC-1细胞有协同抑制效果。胰腺导管腺癌患者中,90%存在KRAS突变, 而致癌KRAS将胰腺导管腺癌细胞重新编程为高度抗凋亡的状态。由于KRAS信号突变的副产物是生成大量的ROS,为了上调抗氧化能力,胰腺导管腺癌转而增强葡萄糖和谷氨酰胺代谢途径,使细胞对ROS诱导的、铁依赖性非凋亡的铁死亡模式敏感[13]。激活铁死亡可有效阻止肿瘤进展,增强化疗、放疗和免疫治疗的效果[14]。在治疗胰腺癌的过程中,吉西他滨通过NF-κB信号途径诱导内源性活性氧的产生,进而导致Nrf2信号通路的激活以及细胞内谷胱甘肽增加,最终使胰腺癌细胞对吉西他滨不敏感[15]。埃拉斯汀可通过抑制胱氨酸-谷氨酸逆向转运蛋白的活性来减少胱氨酸进入肿瘤细胞,从而降低胞内谷胱甘肽的合成,抑制线粒体的电压依赖性阴离子通道等多种途径促进线粒体代谢紊乱、活性氧类物质以及脂质过氧化物的大量积累,增强吉西他滨对胰腺癌细胞的杀伤效果[16]。柳氮磺胺吡啶可通过抑制胱氨酸-谷氨酸逆向转运蛋白的功能促进胰腺癌细胞的铁死亡,逆转癌细胞的耐药性 [17]。青蒿琥酯通过诱导铁依赖性氧化损伤促进胰腺癌细胞的死亡,并且这种脂质过氧化性细胞死亡可被铁死亡抑制剂阻断[18]。本研究中三种铁死亡诱导剂联合hcGEM对PANC-1细胞的协同抑制的效果可能与这三种铁死亡诱导剂引起的氧化应激反应的强弱有关,具体相关机制还有待进一步实验。
综上所述,本研究发现三种铁死亡诱导剂分别与hcGEM联合应用时存在对PANC-1细胞的协同抑制联合方案。hcGEM-Era 4∶1或1∶4联合用药以及hcGEM-SASP 1∶400联合用药对PANC-1细胞的协同抑制效果良好,而hcGEM-Art 1∶4或1∶16联合用药仅一定浓度范围能对PANC-1细胞产生协同抑制效果。
Inhibitory effects of gemcitabine hydrochloride combined with ferroptosis inducers on the proliferation of PANC-1 cells
-
摘要:
目的 研究三种铁死亡诱导剂埃拉斯汀(Era)、柳氮磺胺吡啶(SASP)和青蒿琥酯(Art)与盐酸吉西他滨(hcGEM)单独或联合应用对人胰腺癌PANC-1细胞的抑制作用。 方法 采用CCK-8法检测不同浓度的Era、SASP、Art单独或联合hcGEM对PANC-1细胞的增殖抑制作用,并根据联合指数(CI) 判断三种铁死亡诱导剂联合hcGEM对 PANC-1细胞是否具有协同抑制作用。 结果 hcGEM与三种铁死亡诱导剂单独或联合应用均能显著抑制PANC-1细胞活性,并且这种抑制作用随着浓度增大而增强。hcGEM-Era 4∶1或1∶4联用组、hcGEM-SASP 1∶400联用组 CI 值小于1。hcGEM-Art 1∶4或1∶16联用组仅在一定浓度范围内CI值小于1。 结论 hcGEM与三种铁死亡诱导剂单独或联合应用对PANC-1细胞的增殖抑制作用呈现剂量依赖性。hcGEM与三种铁死亡诱导剂联用能协同抑制PANC-1细胞的增殖。 Abstract:Objective To study the effects of three ferroptosis inducers Erastin (Era), sulfasalazine (SASP) and artesunate (Art) alone or combined with gemcitabine hydrochloride (hcGEM) on the proliferation inhibition of Human pancreatic cell line PANC -1. Methods The CCK-8 method was used to detect the inhibitory effects of different concentrations of Era, SASP and Art alone or combined with hcGEM on the proliferation of PANC-1, and the combination index (CI) was used to judge whether three ferroptosis inducers combined with hcGEM had synergistic inhibitory effect on PANC-1. Results The three ferroptosis inducers and hcGEM alone or in combination could significantly inhibit the activity of PANC-1. The inhibitory effects were enhanced with the concentration increasing. The CI values of hcGEM-Era 4∶1 or 1∶4 combination group and hcGEM-SASP 1∶400 combination group were less than 1.The CI values of hcGEM-Art 1∶4 or 1∶16 combination group were less than 1 only within a certain concentration range. Conclusion The inhibitory effects of the three ferroptosis inducers and hcGEM alone or in combination were dose-dependent. The combination of hcGEM and three ferroptosis inducers could synergistically inhibit the proliferation of PANC-1. -
表 1 hcGEM联合三种铁死亡诱导剂对胰腺癌PANC-1细胞作用时的IC50值
组别 摩尔浓度比 IC50(μmol/L,hcGEM) hcGEM-Era联合组 1∶0.25 0.140 3±0.009 1 1∶1 0.340 2±0.018 3 1∶4 0.091 3±0.005 1 1∶16 0.083 3±0.002 5 hcGEM-SASP联合组 1∶0.25 0.297 5±0.016 1 1∶1 0.240 2±0.021 2 1∶20 0.120 8±0.008 9 1∶400 0.092 6±0.006 7 hcGEM-Art联合组 1∶0.5 0.366 4±0.018 7 1∶1 0.344 4±0.026 3 1∶4 0.249 3±0.015 7 1∶16 0.154 6±0.013 5 -
[1] BRAY F, FERLAY J, SOERJOMATARAM I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA A Cancer J Clin,2018,68(6):394-424. doi: 10.3322/caac.21492 [2] MIZRAHI J D, SURANA R, VALLE J W, et al. Pancreatic cancer[J]. Lancet,2020,395(10242):2008-2020. doi: 10.1016/S0140-6736(20)30974-0 [3] PAROHA S, VERMA J, DUBEY R D, et al. Recent advances and prospects in gemcitabine drug delivery systems[J]. Int J Pharm,2021,592:120043. doi: 10.1016/j.ijpharm.2020.120043 [4] General Office of National Health Commission;. 胰腺癌诊疗指南(2022年版)[J]. 临床肝胆病杂志, 2022, 38(5):1006-1030. doi: 10.3969/j.issn.1001-5256.2022.05.007 [5] LEI G, ZHUANG L, GAN B Y. Targeting ferroptosis as a vulnerability in cancer[J]. Nat Rev Cancer,2022,22(7):381-396. doi: 10.1038/s41568-022-00459-0 [6] CHEN M J, LI X N, DU B L, et al. Upstream stimulatory factor 2 inhibits erastin-induced ferroptosis in pancreatic cancer through transcriptional regulation of pyruvate kinase M2[J]. Biochem Pharmacol,2022,205:115255. doi: 10.1016/j.bcp.2022.115255 [7] LO M, LING V, LOW C, et al. Potential use of the anti-inflammatory drug, sulfasalazine, for targeted therapy of pancreatic cancer[J]. Curr Oncol,2010,17(3):9-16. doi: 10.3747/co.v17i3.485 [8] WANG K, ZHANG Z Y, WANG M, et al. Role of GRP78 inhibiting artesunate-induced ferroptosis in KRAS mutant pancreatic cancer cells[J]. Drug Des Devel Ther,2019,13:2135-2144. doi: 10.2147/DDDT.S199459 [9] CHEN X, KANG R, KROEMER G, et al. Targeting ferroptosis in pancreatic cancer: a double-edged sword[J]. Trends Cancer,2021,7(10):891-901. doi: 10.1016/j.trecan.2021.04.005 [10] WOOD L D, CANTO M I, JAFFEE E M, et al. Pancreatic cancer: pathogenesis, screening, diagnosis, and treatment[J]. Gastroenterology,2022,163(2):386-402.e1. doi: 10.1053/j.gastro.2022.03.056 [11] HAN H, LI S, ZHONG Y, et al. Emerging pro-drug and nano-drug strategies for gemcitabine-based cancer therapy[J]. Asian J Pharm Sci,2022,17(1):35-52. doi: 10.1016/j.ajps.2021.06.001 [12] LI C, YIN X Z, LIU Z J, et al. Emerging potential mechanism and therapeutic target of ferroptosis in PDAC: a promising future[J]. Int J Mol Sci,2022,23(23):15031. doi: 10.3390/ijms232315031 [13] STOCKWELL B R. Ferroptosis turns 10: emerging mechanisms, physiological functions, and therapeutic applications[J]. Cell,2022,185(14):2401-2421. doi: 10.1016/j.cell.2022.06.003 [14] CHEN X, KANG R, KROEMER G, et al. Broadening horizons: the role of ferroptosis in cancer[J]. Nature reviews Clinical oncology,2021,18(5):280-296. doi: 10.1038/s41571-020-00462-0 [15] DAHER B, PARKS S K, DURIVAULT J, et al. Genetic ablation of the cystine transporter xCT in PDAC cells inhibits mTORC1, growth, survival, and tumor formation via nutrient and oxidative stresses[J]. Cancer Res,2019,79(15):3877-3890. doi: 10.1158/0008-5472.CAN-18-3855 [16] OHMAN K A, HASHIM Y M, VANGVERAVONG S, et al. Conjugation to the sigma-2 ligand SV119 overcomes uptake blockade and converts dm-Erastin into a potent pancreatic cancer therapeutic[J]. Oncotarget,2016,7(23):33529-33541. doi: 10.18632/oncotarget.9551 [17] WANG K, ZHANG Z Y, TSAI H I, et al. Branched-chain amino acid aminotransferase 2 regulates ferroptotic cell death in cancer cells[J]. Cell Death Differ,2021,28(4):1222-1236. doi: 10.1038/s41418-020-00644-4 [18] ELING N, REUTER L, HAZIN J, et al. Identification of artesunate as a specific activator of ferroptosis in pancreatic cancer cells[J]. Oncoscience,2015,2(5):517-532. doi: 10.18632/oncoscience.160 -




 下载:
下载: