-
慢性非萎缩性胃炎(CNAG)作为慢性胃炎的一种类型,在中国发病率高达49.3%,严重影响患者的生活[1]。柴胡桂枝干姜汤(CGGD)源自张仲景的《伤寒论》,由柴胡、桂枝、干姜、天花粉、黄芩、牡蛎、甘草七味药组成,主治胆热脾寒之症[2]。现代研究发现,柴胡桂枝干姜汤治疗消化系统疾病效果显著[3]。然而,目前的研究多聚焦于典型病案分析与临床疗效上,缺乏其体内外成分的表征,更未见其治疗CNAG的机制研究[4]。
因此,本研究基于血清药物化学分析方法,采用超高效液相色谱-四级杆-飞行时间串联质谱(UHPLC-Q-TOF/MS)技术对柴胡桂枝干姜汤的入血成分进行分析,同时结合网络药理学技术对其治疗CNAG的作用机制进行探讨,为后续开展实验验证提供数据支撑。
-
柴胡(甘肃,批号:1051843)、黄芩(山东,批号:1032223)、干姜(四川,批号:1045063)、天花粉(河北,批号:1037043)、桂枝(广西,批号:1035433)、牡蛎(广东,批号:1041073)、炙甘草(内蒙古,批号:1040593)、清半夏(甘肃,批号:1042863)均购自上海蔡同德中药饮片有限公司。汉黄芩苷(批号:O0903AS)购自大连美仑生物技术有限公司;柠檬酸(批号:SM0425GA14)购自上海源叶生物科技有限公司。质谱级甲醇、乙腈购自德国Merck公司;质谱级甲酸购自美国Fisher公司;纯净水购自中国屈臣氏公司。1%氨水、脱氧胆酸钠、无水乙醇、二甲苯、双氧水(货号:10011218)购自国药集团化学试剂有限公司;柠檬酸(PH 6.0)抗原修复液、磷酸缓冲盐溶液(PBS)、苏木素染液(货号:R1004)购自上海睿宝和生物科技有限公司;STAT3抗体(货号:9139)与PTGS2抗体(货号:12282)购自Cell Signaling Technology公司;TNF-α抗体(货号:ab6671)与IL-6抗体(货号:ab9324)购自abcam公司。
-
UHPLC-Q-TOF/MS,包含1290 Infinity型UHPLC及6530型Q-TOF/MS系统(美国Agilent公司);L-200型冷冻干燥机(瑞士Buchi公司);Centrifuge 5810 R型高速冷冻离心机、Mini spin微型离心机(德国Eppendorf公司);BSA124S-CW型分析天平(德国Sartorius公司);SK7200H型超声波清洗器(上海科导超声仪器有限公司);VX200涡旋振荡器(美国Labnet公司)脱水机与包埋机(浙江金华科迪仪器设备有限公司);RM2016型病理切片机(上海徕卡仪器有限公司)。
-
分别精密称取汉黄芩苷和柠檬酸对照品1 mg,加入适量甲醇,配制成二者浓度为10 μg/ml的混合对照品溶液备用。
-
将柴胡、黄芩、干姜、桂枝、天花粉、牡蛎、炙甘草、清半夏按照8∶3∶2∶3∶4∶10∶2∶2的配比称取后,加入8倍量水浸泡过夜,回流提取1 h,重复2次,滤过,合并滤液,100 ℃下常压浓缩得到浸膏,出膏率为33.77%。精密称取浸膏2.45 g,加入24.5 ml 20%甲醇溶解,超声处理(500 W,40 kHz)30 min,放冷,摇匀,提取液于3 000 r/min离心10 min,取上层溶液于1.5 ml离心管中,于14 500 r/min离心10 min,静置10 min后,再次取上清液14 500 r/min离心10 min,吸取上清液150 μl于进样小瓶中待分析。
-
SPF级雄性SD大鼠18只,体重为200~220 g,购自常州卡文斯实验动物有限公司,许可证号为SCXK(苏)2021-0013。饲养环境温度20~24 ℃,湿度50%~70%,12 h光照与黑暗交替循环,自由饮食进水。适应性喂养1周后,随机分为正常组(6只)、模型组(6只)与给药组(6只)。除正常组外,其余两组大鼠每日饮用0.02%氨水、每周5次20 mmol/L脱氧胆酸钠溶液灌胃、饥饱交替饮食(禁食1 d,饱食2 d),连续给予10周。最后4周内,给药组每日给予柴胡桂枝干姜汤36.72 g/kg(相当于临床剂量的4倍)灌胃,正常组大鼠每日给予同体积生理盐水灌胃。末次给药后,分别于第 0.5、1 、2 、4、8 h进行眼内眦取血 1.0 ml 置于抗凝管中,于4 ℃下3 500 r/min 离心15 min,取上清液,将不同组别血浆分装,置于−80 ℃冰箱保存;同时取不同组别大鼠胃组织置于多聚甲醛中固定,待后续免疫组化分析。
-
将同一只大鼠不同时间点的血浆各取50 μl混合,加入4倍体积(含200 ng/ml华法林)甲醇溶液,涡旋振荡3 min,4 ℃ 3 000 r/min离心10 min,取上清液后继续在4 ℃、13 000 r/min条件下离心10 min,取上清液,置于冷冻干燥机中冻干。残渣用130 μl 80 %甲醇溶液复溶,涡旋振荡3 min,在4 ℃、13 000 r/min条件下继续离心10 min,收集上清液至进样小瓶待进样分析。
-
采用Waters ACQUITY UPLC BEH C18色谱柱(2.1 mm×100 mm,1.7 μm);柱温为35 ℃;流动相为0.1 %甲酸水溶液(A)-乙腈(B),梯度洗脱(0~15 min,5 %~22 %B;15~20 min,22 %~24 %B;20~28 min,24 %~40 %B;28~47 min,40 %~95 %B;47~50 min,95%B);流速为0.3 ml/min;检测波长为254、280、360 nm;进样量3 μl。
电喷雾离子源(ESI),分别在正、负离子模式下采集数据;离子源温度350 ℃;毛细管电压分别为3.5 kV(正离子)和4.0 kV(负离子);雾化气压力45 Psi;干燥气流速11 L/min;鞘气流速11 L/min;鞘气温度350 ℃;碎片电压140 V。
-
通过中国知网(CNKI)、重庆维普、PubMed、Web of Science等数据库查阅国内外最新文献,采集柴胡桂枝干姜汤组方8种药材的化学成分信息,构建各单味药材及柴胡桂枝干姜汤化学成分数据库。利用Agilent MassHunter Qualitative Analysis 10.0、MSdial 4.70及MSfinder 3.60等软件,结合相关标准品二级碎片信息、相关文献及公共数据库Massbank、PubChem及HMDB的一、二级离子碎片信息对化学成分进行分析鉴定,筛选出质量数匹配容差< ±8 ppm的化学成分,并对其来源药材进行归属。同样的,以体外成分分析结果为数据库,对其入血原型成分进行识别。
-
通过PubChem网站获取已鉴定的柴胡桂枝干姜汤入血化学成分的分子结构式与Canonical SMILES号,导入SwissTargetPrediction网站 [5],获取其作用的靶点信息,并与Uniprot网站比对获取其基因信息[6]。分别在OMIM、DrugBank、GeneCard、DisGeNet网站以“Chronic Gastritis”为关键词,搜索整理疾病相关靶点[7-9]。在线绘制韦恩图,输入成分作用靶点与疾病相关靶点,获取交集靶点。
-
将获取到的交集靶点导入STRING 12.0数据库,Organisms选择“Homo sapiens”,最低要求交互分数设为0.4,生成靶点蛋白间相互作用的关系网络,导出数据后使用Cytoscape v3.9.1软件,计算其度值,按照度值大小,构建PPI网络互作图[10]。
-
将交集靶点导入DAVID在线数据库进行GO生物富集分析及KEGG通路分析,物种选择为“Homo sapiens”,Select Identifier选择为“Official_Gene_Symbol”,将结果按照P值大小进行排序,选取P<0.05的前10条通路进行可视化处理[11]。
-
将上述结果导入Cytoscape v3.9.1,构建“疾病-成分-靶点-通路”网络关系可视化图。
-
应用免疫组化方法对上述靶点进行验证。将胃组织切片依次放入二甲苯I和二甲苯II中浸泡15 min,而后依次放入无水乙醇I、无水乙醇II、85%酒精和75%酒精中浸泡5 min,最后用蒸馏水洗将石蜡切片脱蜡,高温修复抗原。加入3%的过氧化氢溶液,室温避光孵育25 min,加入3%的牛血清进行封闭。分别加入一抗TNF-α、IL-6、STAT3和PTGS2,在4 ℃条件下孵育过夜。加入辣根过氧化物酶标记的二抗覆盖组织,室温孵育50 min。经DAB显色、细胞核复染、脱水封片后进行显微镜镜检,图像采集分析。
-
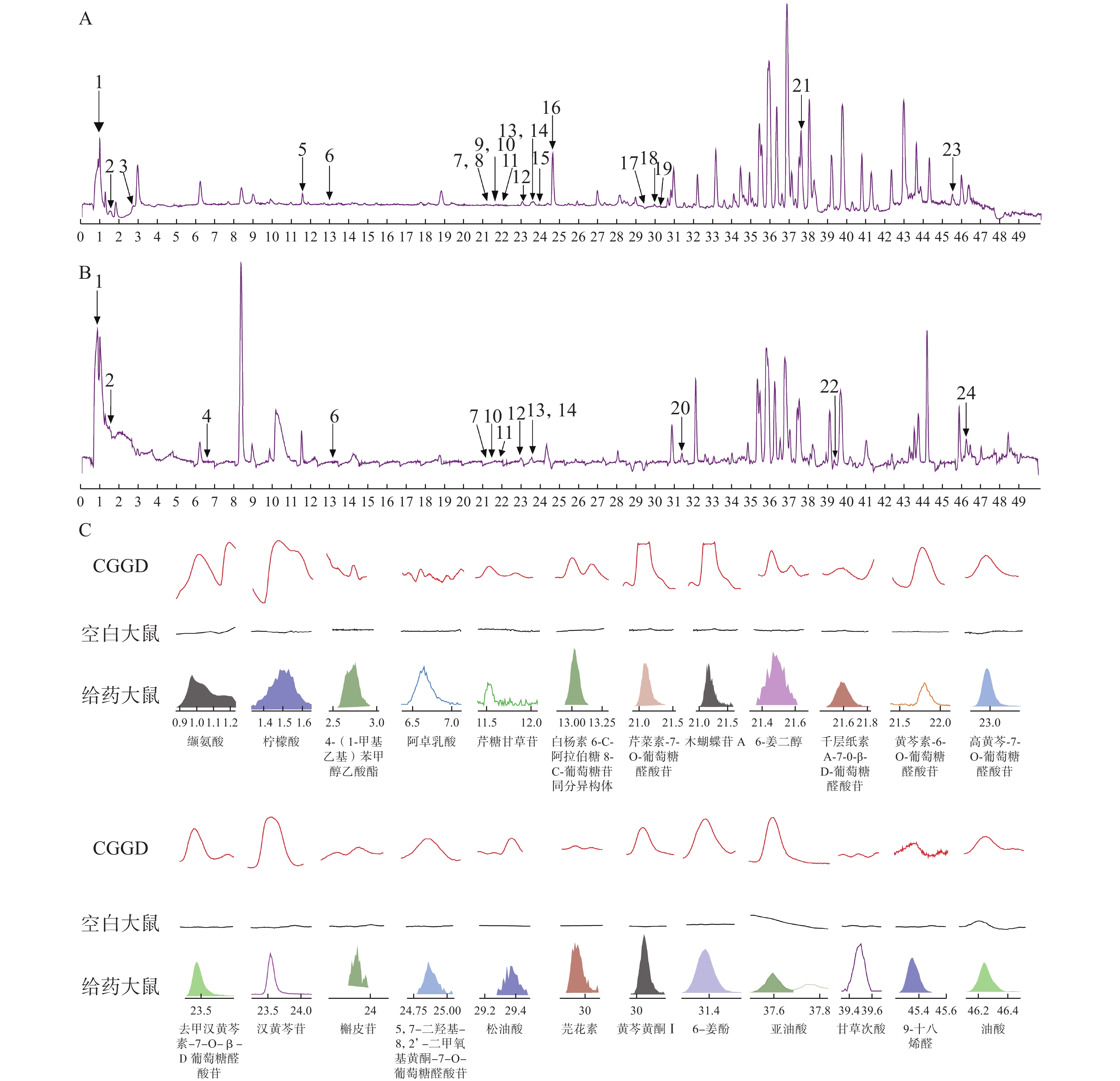
按“1.8”项下方法,在柴胡桂枝干姜汤中共表征出248种化学成分。在此基础上,通过比较含药大鼠血浆、体外成分以及空白大鼠血浆,我们进一步确定了柴胡桂枝干姜汤的24种入血原型成分,其中2种经过对照品比对,主要包含黄酮苷类11种,脂肪酸类3种,有机酸类2种,姜辣素类2种,黄酮类2种,脂类、三萜类、苯丙素类及氨基酸类各1种,其具体信息参见表1。总离子流图及入血成分提取离子流图见图1。
表 1 柴胡桂枝干姜汤入血原型成分分析
编号 RT/min m/z 理论分子量 分子式 离子模式 MS/MS 误差(ppm) 名称 类别 B1 0.973 118.085 7 117.079 0 C5H11NO2 [M+H]+ 58.065 4, 72.080 9 −4.74 缬氨酸 氨基酸类 116.071 0 [M-H]− −5.65 B2* 1.508 215.015 8 192.027 0 C6H8O7 [M+Na]+ 85.028 2 −1.26 柠檬酸 有机酸类 191.018 9 [M-H]− 111.007 7 −3.92 B3 2.678 231.078 4 192.115 0 C12H16O2 [M+K]+ 127.039 3, 149.899 7 1.62 4-(1-甲基乙基)苯甲醇乙酸酯 有机酸类 B4 6.645 165.055 0 166.063 0 C9H10O3 [M-H]− 91.914 5, 103.920 7 −3.98 阿卓乳酸 苯丙素类 B5 11.509 568.202 8 550.168 6 C26H30O13 [M+NH4]+ 116.070 0, 175.118 3,
217.081 5, 403.228 43.64 芹糖甘草苷 黄酮苷类 B6 13.018 549.160 9 548.153 0 C26H28O13 [M+H]+ 237.993 4 0.45 白杨素 6-C-阿拉伯糖 8-C-
葡萄糖苷同分异构体黄酮苷类 547.145 8 [M-H]- 520.907 8 −0.93 B7 21.096 447.092 2 446.084 9 C21H18O11 [M+H]+ 271.060 7 −0.31 芹菜素-7-O-葡萄糖醛酸苷 黄酮苷类 445.075 6 [M-H]− 267.044 7 −4.00 B8 21.169 433.113 4 432.105 6 C21H20O10 [M+H]+ 271.062 1 1.21 木蝴蝶苷A 黄酮苷类 B9 21.464 314.232 4 296.198 8 C17H28O4 [M+NH4]+ 127.123 1 −0.63 6-姜二醇 姜辣素类 B10 21.585 461.108 1 460.100 6 C22H20O11 [M+H]+ 270.053 3, 285.075 9 0.02 千层纸素A-7-0-β-D-
葡萄糖醛酸苷黄酮苷类 459.092 4 [M-H]− 268.037 4, 283.062 7 −2.58 B11 21.799 447.092 3 446.084 9 C21H18O11 [M+H]+ 271.059 3 −0.30 黄芩素-6-O-葡萄糖醛酸苷 黄酮苷类 445.075 9 [M-H]− 269.046 5 −2.28 B12 22.976 477.103 5 476.095 5 C22H20O12 [M+H]+ 301.071 4 0.88 高黄芩-7-O-葡萄糖醛酸苷 黄酮苷类 475.087 2 [M-H]− 284.031 3, 299.055 5 −1.89 B13 23.434 447.093 0 446.084 9 C21H18O11 [M+H]+ 271.061 1 1.59 去甲汉黄芩素-7-O-β-D-
葡萄糖醛酸苷黄酮苷类 445.076 4 [M-H]− 269.044 4 −2.63 B14* 23.530 461.108 7 460.100 6 C22H20O11 [M+H]+ 285.076 6 1.69 汉黄芩苷 黄酮苷类 459.091 8 [M-H]− 268.036 4, 283.060 2 −2.29 B15 23.824 449.107 8 448.100 6 C21H20O11 [M+H]+ 271.060 7 −1.07 槲皮苷 黄酮苷类 B16 24.858 491.120 2 490.111 1 C23H22O12 [M+H]+ 315.089 3 3.30 5,7-二羟基-8,2'-二甲氧基
黄酮-7-O-葡萄糖醛酸苷黄酮苷类 B17 29.363 353.230 9 330.240 6 C18H34O5 [M+Na]+ 109.100 4 −0.11 松油酸 脂肪酸类 B18 29.920 285.076 2 284.068 5 C16H12O5 [M+H]+ 270.052 2 2.31 芫花素 黄酮类 B19 30.079 315.086 9 314.079 0 C17H14O6 [M+H]+ 285.040 5 2.01 黄芩黄酮 I 黄酮类 B20 31.364 293.174 9 294.183 1 C17H26O4 [M-H]− 68.995 7, 177.089 7 −2.97 6-姜酚 姜辣素类 B21 37.594 298.274 0 280.240 2 C18H32O2 [M+NH4]+ −1.11 亚油酸 脂肪酸类 B22 39.448 471.346 8 470.339 6 C30H46O4 [M+H]+ 121.096 5, 235.169 6 −0.51 甘草次酸 三萜类 469.330 8 [M-H]− 225.924 4 −3.47 B23 45.358 284.294 9 266.261 0 C18H34O [M+NH4]+ 83.086 0, 95.085 7 0.88 9-十八烯醛 脂类 B24 46.217 281.249 1 282.255 9 C18H34O2 [M-H]− 1.43 油酸 脂肪酸类 注:“*”表示经过对照品比对鉴定的化学成分。 -
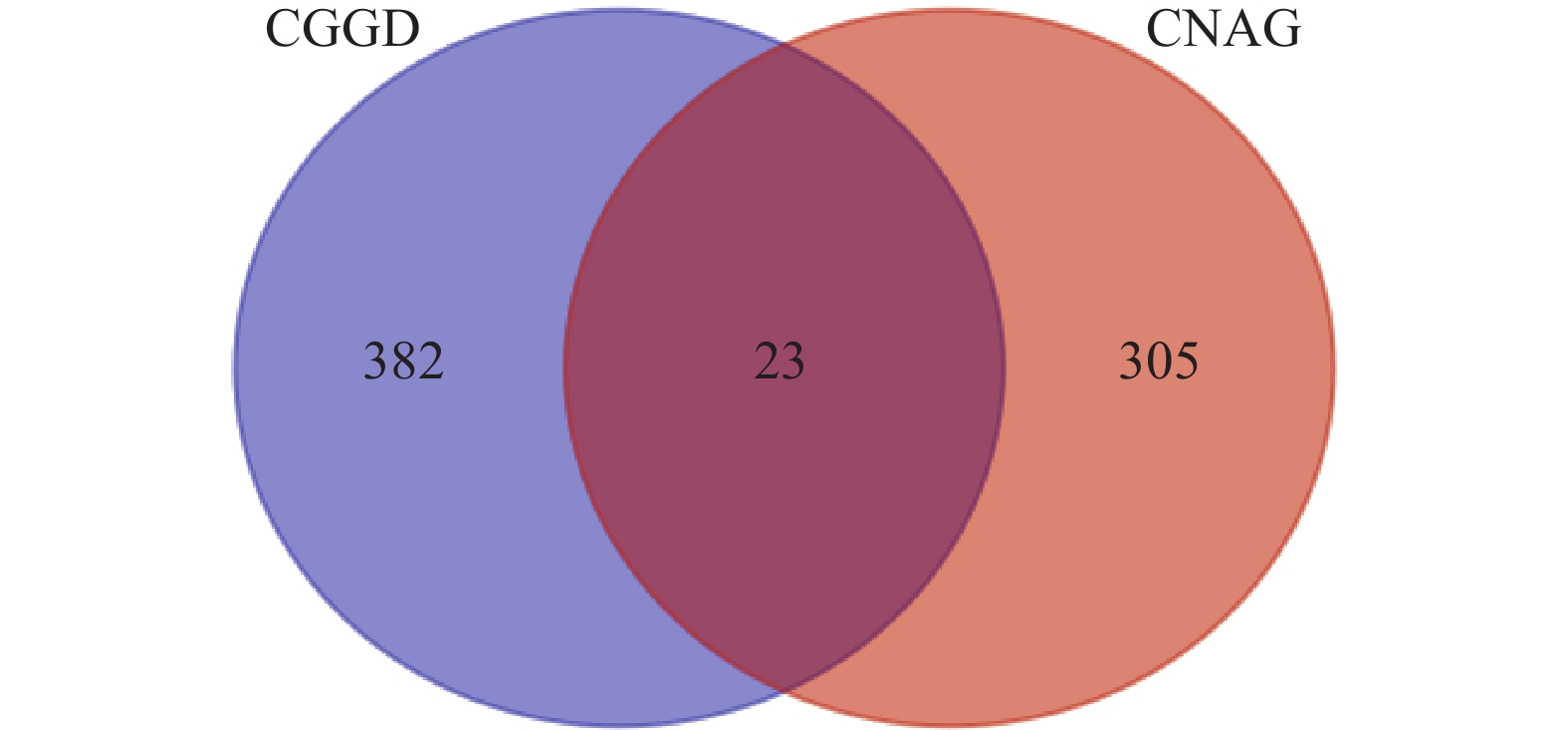
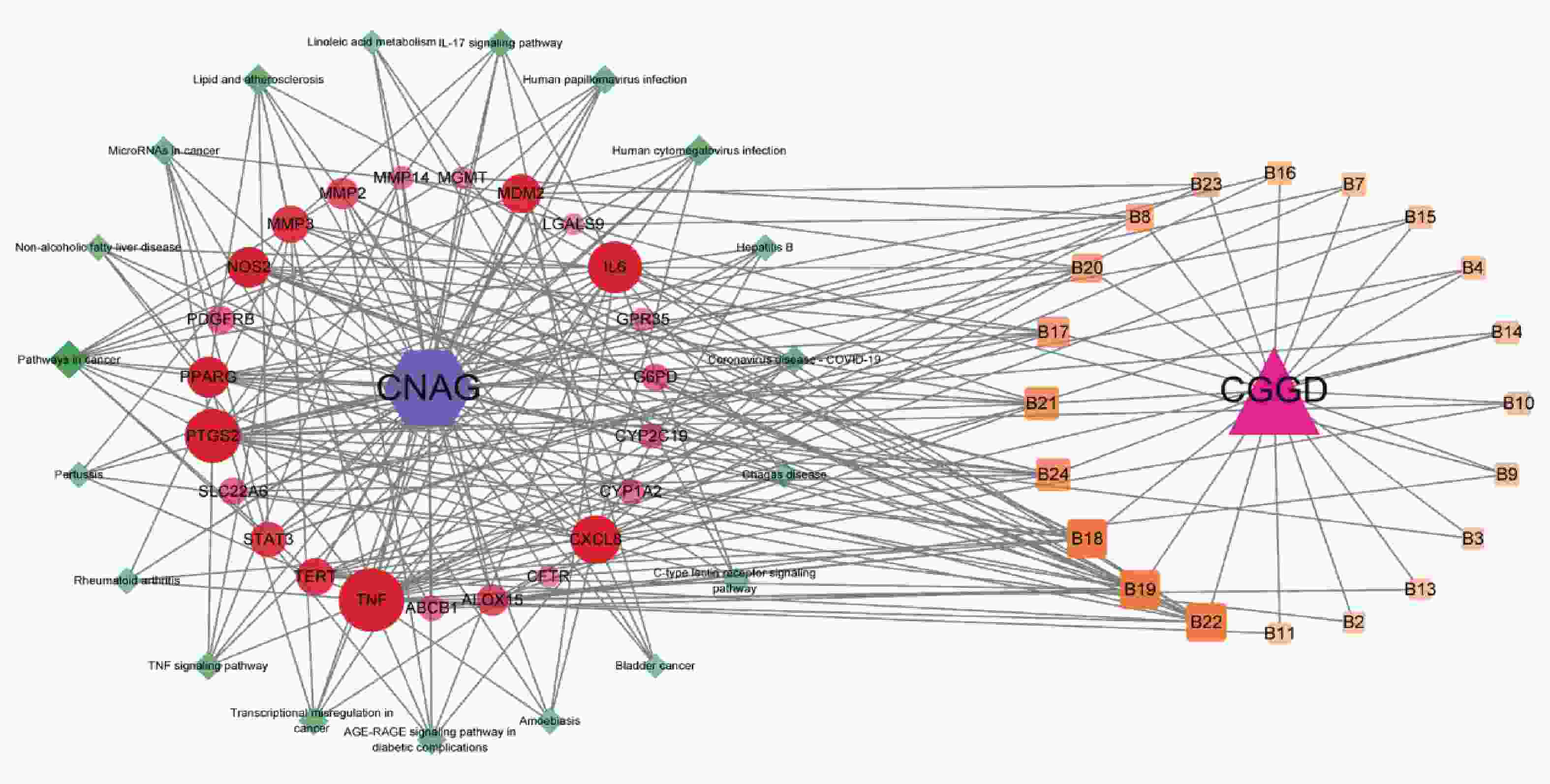
按“1.9.1”项下方法,分别获得成分靶点405个,疾病相关靶点328个。将二者取交集,得到23个交集靶点,如图2所示。
-
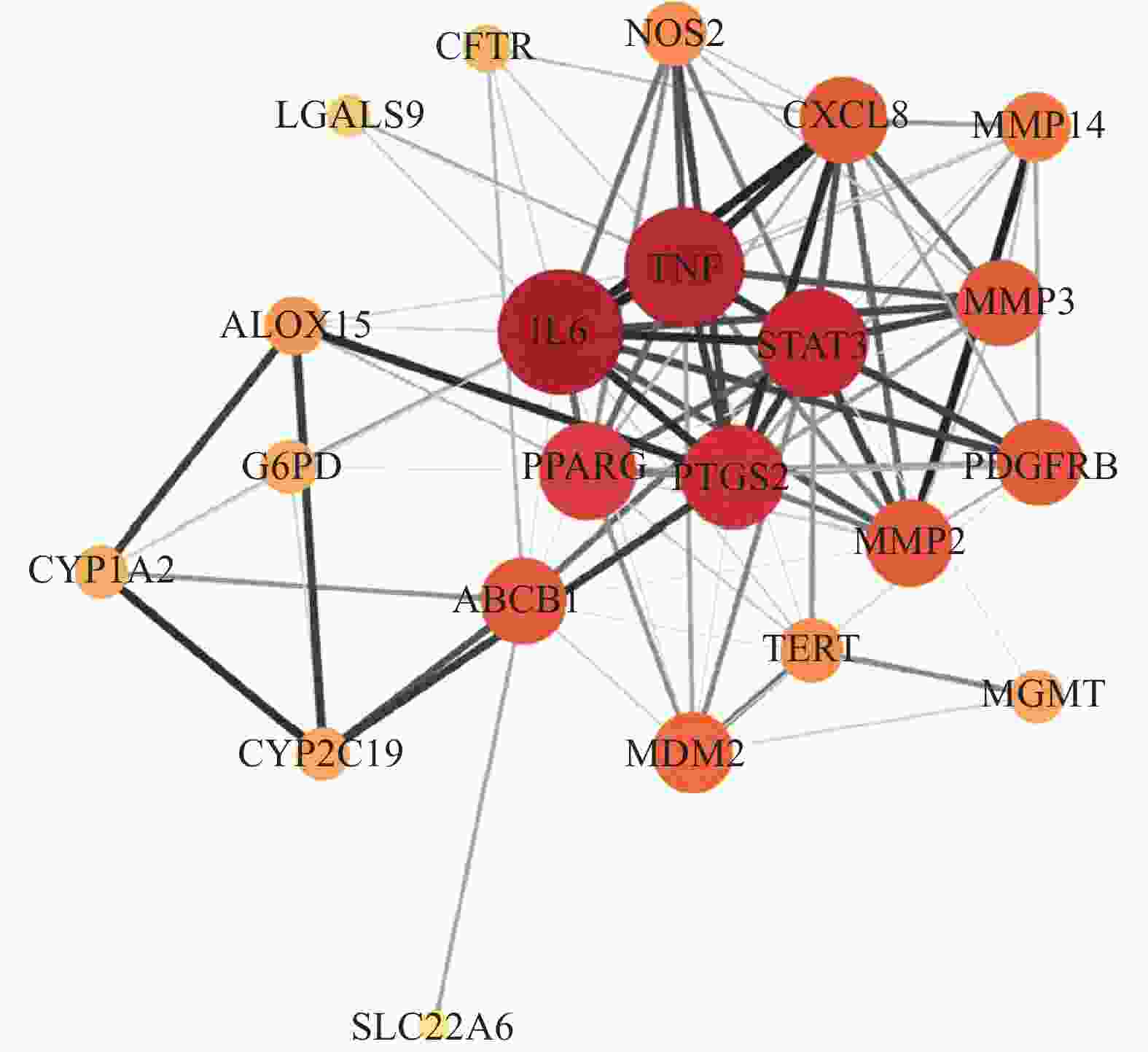
经过“1.9.2”项下方法分析23个交集靶点,去除游离节点(GPR35)后,得到22个蛋白节点和99条相互作用连线,平均度值8.61。导入Cytoscape可视化,度值大则节点大且色深,最终筛选出肿瘤坏死因子(TNF)、白介素-6(IL-6)、信号转导和转录激活剂3(STAT3)、前列腺素G/H合酶2(PTGS2)4个核心靶点,详见图3。
-
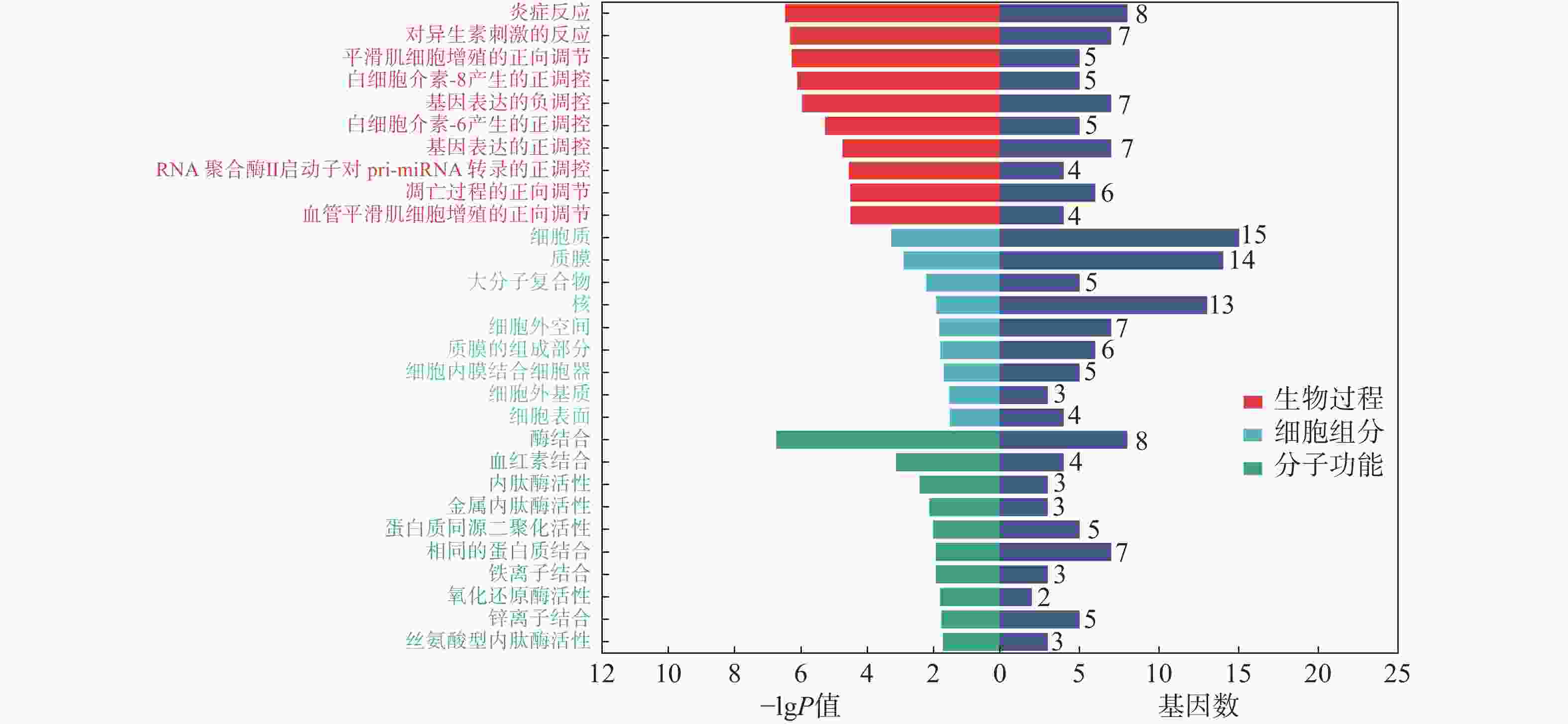
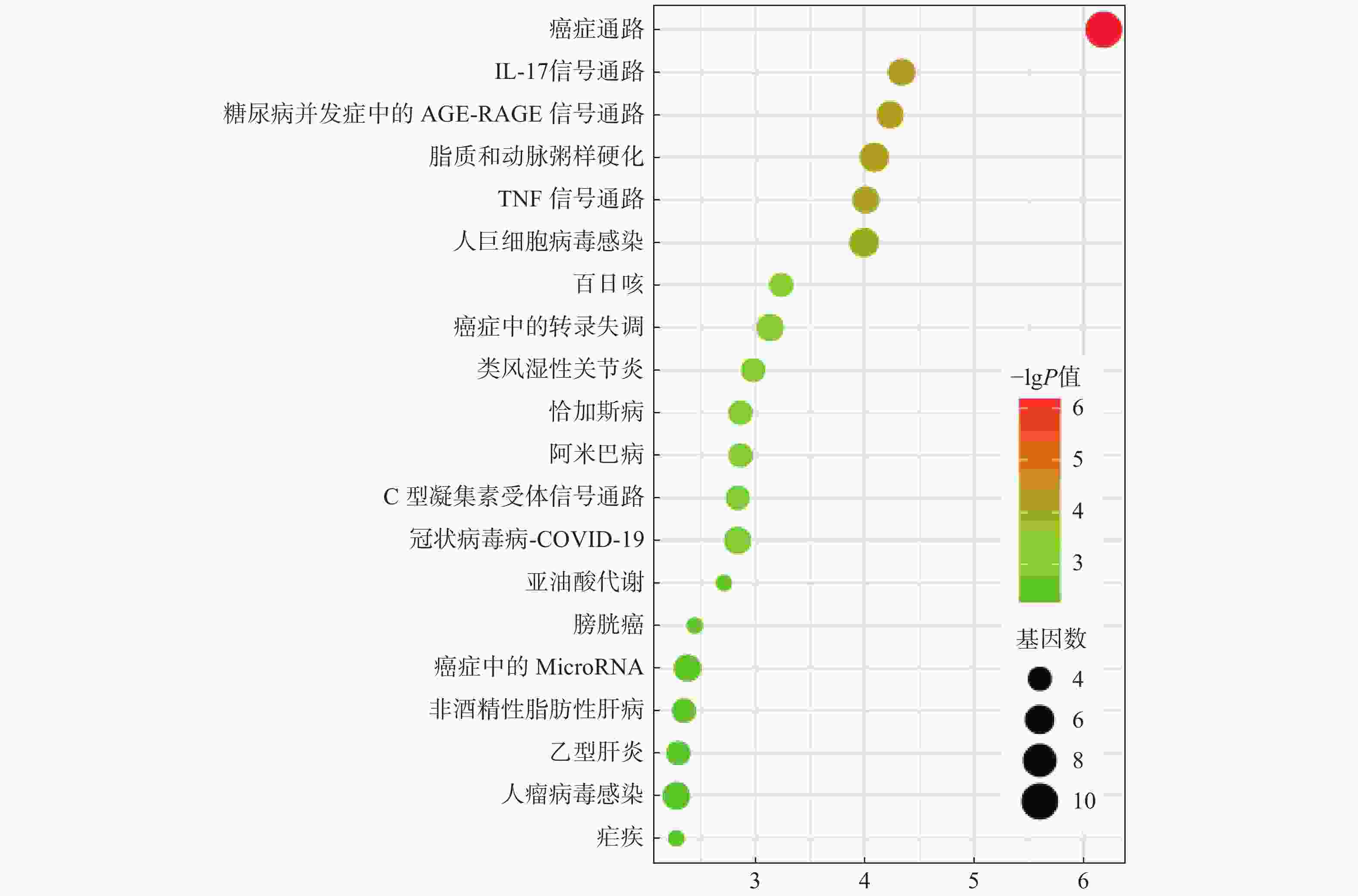
通过DAVID数据库,对23个交集靶点进行了GO功能及KEGG通路富集分析。在FDR<0.05条件下,筛选出48条GO功能结果:生物进程(BP)24条,如炎症反应、对异生素刺激的反应等;细胞组分(CC)9条,如细胞质、质膜等;分子功能(MF)15条,如酶结合、血红素结合等(图4)。同时,富集到27条KEGG通路,涉及癌症途径、IL-17信号通路等(图5)。
-
将上述24种化学成分,23个交集靶点及20条KEGG通路导入Cytoscape进行可视化处理,共得到64个节点,233条边。度值大则节点大且色深,具体结果见图6。
-
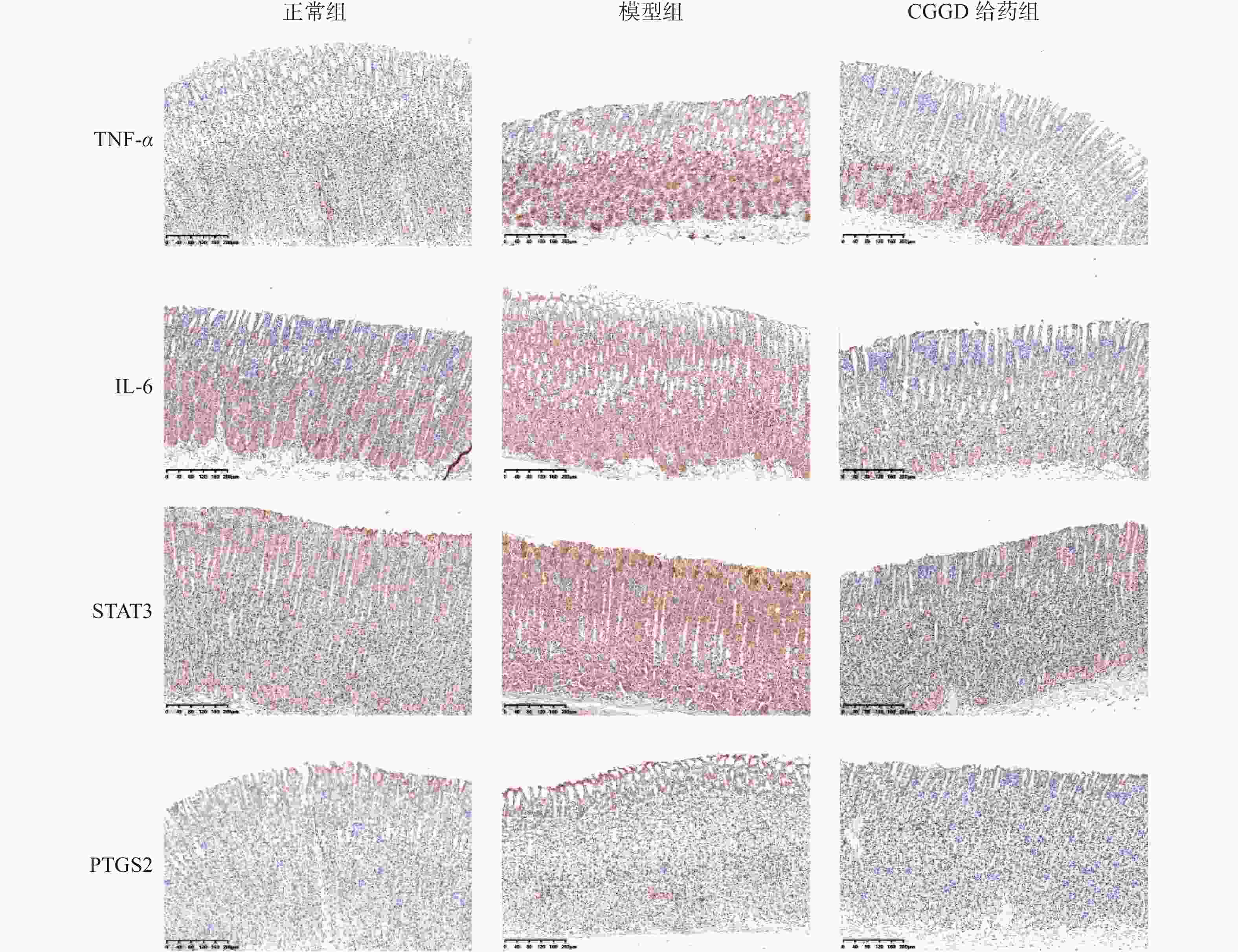
通过免疫组化对网络药理学分析的结果进行进一步的验证,如图7所示,模型组大鼠胃组织中TNF-α、IL-6、STAT3及PTGS2表达较正常组显著升高,经CGGD治疗后表达降低。
-
柴胡桂枝干姜汤源自小柴胡汤,关于其所主病机的探讨众说纷纭,譬如少阳病兼汗下津伤、少阳病兼表邪未解等[12]。自刘渡舟提出其病机核心为“胆热脾寒”后,逐渐被大多数医者所认可。在此基础上,众多医者应用柴胡桂枝干姜汤治疗消化系统疾病特别是CNAG,均取得了满意的疗效[13]。柴胡和黄芩作为方中君药,柴胡畅气散火,黄芩清热燥湿、泻火解毒,二者合力和解少阳,对抗“胆热”。干姜和桂枝作为臣药,可以温中散寒,共解“脾寒”[14]。为了深入探究该方治疗胆热脾寒型CNAG的物质基础,本研究首次采用UHPLC-Q-TOF/MS技术,鉴定出其248种体外化学成分及24种入血原型成分。在单体分子方面,槲皮苷通过多种机制发挥胃保护作用,如缓解炎症、减轻胃蛋白酶及胃酸分泌等;芫花素作为新兴化合物,能抑制活性氧(ROS)及促炎物质(如IFN-γ等)的产生,这些都有助于黄芩的清“热”作用[15, 16] 。6-姜辣素是干姜中的高药理活性成分之一,已证实具有抗肿瘤、抗增殖、抗侵袭和抗炎作用,涉及到Bax/Bcl2、p38/MAPK、Nrf2、TNF-α, ERK1/2、SAPK/JNK、ROS/NF-κB/COX-2等等;同时,它还能改善大鼠胰岛素抵抗及异位脂质沉积,进而改善能量代谢,这可能是干姜抗“寒”作用的机制之一[17, 18]。甘草虽为使药,其化学成分亦具有多种药理活性,如甘草次酸通过PI3K/AKT途径发挥抗炎作用并能够抑制磷脂酶A2[19, 20]。同时,甘草次酸还常作为局部抗炎剂使用[21]。
网络药理学结果进一步表明,柴胡桂枝干姜汤的主要作用靶点包括TNF、IL-6、STAT3和PTGS2。TNF,由巨噬细胞分泌的一种小分子蛋白,存在TNF-α和TNF-β两种亚型。TNF-α和IL-6是经典的促炎因子,其中TNF-α诱导多种信号,主要通过NF-κB调节的蛋白发挥促炎作用,激活产生IL-6的转录因子,并能自诱导其表达[22, 23]。TNF-α与IL-6的过度表达会增加慢性胃炎的风险,且胃炎治愈后其表达受抑。不仅仅是TNF-α, 在慢性胃炎大鼠中,TNF-β表达也升高[24]。STAT3磷酸化及其相关通路的持续激活促进胃黏膜肠化生[25]。PTGS2(即COX-2)的表达量与幽门螺旋杆菌感染及胃黏膜炎症程度密切相关,是非甾体抗炎药的作用靶点[26]。进一步的免疫组化结果证实,柴胡桂枝干姜汤通过调节这些靶点表达发挥治疗作用。
KEGG通路富集分析表明,柴胡桂枝干姜汤治疗CNAG的交集靶点主要集中在IL-17、AGE-RAGE、C型凝集素受体和亚油酸代谢等通路。IL-17信号通路除激活NF-κB及MAPK通路增强炎症反应外,还可维持黏膜免疫和屏障完整性促进消化道上皮的修复[27, 28]。AGE-RAGE通路被认为与慢性炎症反应与氧化应激相关,可通过PI3K/AKT、JAK/STAT通路等诱导细胞损伤[29]。C型凝集素受体(CLR)调节细胞、发育、稳态和免疫反应,能激活NLRP3、NLRC4或者caspase 8炎症小体,导致IL-1β的产生[30]。亚油酸的混合物共轭亚油酸(CLA)在胃内形成硝基共轭亚油酸(NO2-CLA),可以减弱NF-κB依赖性基因的表达,减少促炎因子IL-6和MCP-1的产生,保护组织免受活性氧的破坏[31]。
综上所述,本研究首次采用UHPLC-Q-TOF/MS技术对柴胡桂枝干姜汤的化学成分及入血成分进行了表征,揭示其疗效的物质基础。结合网络药理学,深入探讨了该方剂在治疗CNAG的疗效机制,为其进一步研究提供了科学依据和理论支撑。然而,柴胡作为该方的主要药材,可能受到体内吸收及代谢的影响,其原型入血成分即使通过对照品进行比对也未能找出,推想极有可能生成新的代谢物来发挥作用,也为后续研究开辟了新的探索空间。
Exploring effective components and therapeutic mechanism of Chaihu-Guizhi-Ganjiang decoction in treatment of chronic non-atrophic gastritis by UPLC-Q-TOF-MS/MS combined with network pharmacology
-
摘要:
目的 研究柴胡桂枝干姜汤治疗慢性非萎缩性胃炎的物质基础及疗效机制。 方法 采用UHPLC-Q-TOF/MS技术,获取柴胡桂枝干姜汤体外及入血化学成分的一级、二级离子碎片,结合对照品及文献上的信息进行比对,对柴胡桂枝干姜汤的化学成分进行全面表征。在入血成分表征的基础上,利用网络药理学方法,对柴胡桂枝干姜汤治疗慢性非萎缩性胃炎的机制进行探究,并通过免疫组化结果进行验证。 结果 柴胡桂枝干姜汤的入血成分表征出24种,包括黄酮苷类11种,脂肪酸类3种,有机酸类2种,姜辣素类2种,黄酮类2种,其他4种。其主要作用于TNF, IL-6, STAT3等靶点,通过影响IL-17信号通路,AGE-RAGE信号通路等发挥治疗作用。 结论 本研究首次利用UHPLC-Q-TOF/MS对柴胡桂枝干姜汤治疗慢性非萎缩性胃炎的物质基础及疗效机制进行探索,为柴胡桂枝干姜汤的进一步研究提供科学参考。 -
关键词:
- 柴胡桂枝干姜汤 /
- 慢性非萎缩性胃炎 /
- UHPLC-Q-TOF/MS /
- 网络药理学
Abstract: Objective: To investigate the effective components and therapeutic mechanism of Chaihu-Guizhi-Ganjiang decoction in treating chronic non-atrophic gastritis. Methods: The primary and secondary ion fragments of chemical components of Chaihu-Guizhi-Ganjiang decoction were obtained by UHPLC-Q-TOF/MS. Comparing with reference standards and literature information, a comprehensive characterization of the chemical constituents of Chaihu-Guizhi-Ganjiang decoction was conducted. Then, the network pharmacology approach was applied to explore the therapeutic mechanism of Chaihu-Guizhi-Ganjiang Decoction in treatment of chronic non-atrophic gastritis based on the components in plasma and verified by immunohistochemical results. Results: A total of 24 absorbed components of Chaihu-Guizhi-Ganjiang decoction were characterized, including 11 flavonoid glycosides, 3 fatty acids, 2 organic acids, 2 gingerols, 2 flavonoids and 4 other types of components, which mainly acted on TNF, IL-6, STAT3, and exerted therapeutic effects by influencing IL-17 signaling pathway, AGE-RAGE signaling pathway, etc. Conclusion: This study provided the first exploration of the effective components and therapeutic mechanism of Chaihu-Guizhi-Ganjiang Decoction in treatment of chronic non-atrophic gastritis by UHPLC-Q-TOF/MS, which could offer scientific references for its further research. -
表 1 柴胡桂枝干姜汤入血原型成分分析
编号 RT/min m/z 理论分子量 分子式 离子模式 MS/MS 误差(ppm) 名称 类别 B1 0.973 118.085 7 117.079 0 C5H11NO2 [M+H]+ 58.065 4, 72.080 9 −4.74 缬氨酸 氨基酸类 116.071 0 [M-H]− −5.65 B2* 1.508 215.015 8 192.027 0 C6H8O7 [M+Na]+ 85.028 2 −1.26 柠檬酸 有机酸类 191.018 9 [M-H]− 111.007 7 −3.92 B3 2.678 231.078 4 192.115 0 C12H16O2 [M+K]+ 127.039 3, 149.899 7 1.62 4-(1-甲基乙基)苯甲醇乙酸酯 有机酸类 B4 6.645 165.055 0 166.063 0 C9H10O3 [M-H]− 91.914 5, 103.920 7 −3.98 阿卓乳酸 苯丙素类 B5 11.509 568.202 8 550.168 6 C26H30O13 [M+NH4]+ 116.070 0, 175.118 3,
217.081 5, 403.228 43.64 芹糖甘草苷 黄酮苷类 B6 13.018 549.160 9 548.153 0 C26H28O13 [M+H]+ 237.993 4 0.45 白杨素 6-C-阿拉伯糖 8-C-
葡萄糖苷同分异构体黄酮苷类 547.145 8 [M-H]- 520.907 8 −0.93 B7 21.096 447.092 2 446.084 9 C21H18O11 [M+H]+ 271.060 7 −0.31 芹菜素-7-O-葡萄糖醛酸苷 黄酮苷类 445.075 6 [M-H]− 267.044 7 −4.00 B8 21.169 433.113 4 432.105 6 C21H20O10 [M+H]+ 271.062 1 1.21 木蝴蝶苷A 黄酮苷类 B9 21.464 314.232 4 296.198 8 C17H28O4 [M+NH4]+ 127.123 1 −0.63 6-姜二醇 姜辣素类 B10 21.585 461.108 1 460.100 6 C22H20O11 [M+H]+ 270.053 3, 285.075 9 0.02 千层纸素A-7-0-β-D-
葡萄糖醛酸苷黄酮苷类 459.092 4 [M-H]− 268.037 4, 283.062 7 −2.58 B11 21.799 447.092 3 446.084 9 C21H18O11 [M+H]+ 271.059 3 −0.30 黄芩素-6-O-葡萄糖醛酸苷 黄酮苷类 445.075 9 [M-H]− 269.046 5 −2.28 B12 22.976 477.103 5 476.095 5 C22H20O12 [M+H]+ 301.071 4 0.88 高黄芩-7-O-葡萄糖醛酸苷 黄酮苷类 475.087 2 [M-H]− 284.031 3, 299.055 5 −1.89 B13 23.434 447.093 0 446.084 9 C21H18O11 [M+H]+ 271.061 1 1.59 去甲汉黄芩素-7-O-β-D-
葡萄糖醛酸苷黄酮苷类 445.076 4 [M-H]− 269.044 4 −2.63 B14* 23.530 461.108 7 460.100 6 C22H20O11 [M+H]+ 285.076 6 1.69 汉黄芩苷 黄酮苷类 459.091 8 [M-H]− 268.036 4, 283.060 2 −2.29 B15 23.824 449.107 8 448.100 6 C21H20O11 [M+H]+ 271.060 7 −1.07 槲皮苷 黄酮苷类 B16 24.858 491.120 2 490.111 1 C23H22O12 [M+H]+ 315.089 3 3.30 5,7-二羟基-8,2'-二甲氧基
黄酮-7-O-葡萄糖醛酸苷黄酮苷类 B17 29.363 353.230 9 330.240 6 C18H34O5 [M+Na]+ 109.100 4 −0.11 松油酸 脂肪酸类 B18 29.920 285.076 2 284.068 5 C16H12O5 [M+H]+ 270.052 2 2.31 芫花素 黄酮类 B19 30.079 315.086 9 314.079 0 C17H14O6 [M+H]+ 285.040 5 2.01 黄芩黄酮 I 黄酮类 B20 31.364 293.174 9 294.183 1 C17H26O4 [M-H]− 68.995 7, 177.089 7 −2.97 6-姜酚 姜辣素类 B21 37.594 298.274 0 280.240 2 C18H32O2 [M+NH4]+ −1.11 亚油酸 脂肪酸类 B22 39.448 471.346 8 470.339 6 C30H46O4 [M+H]+ 121.096 5, 235.169 6 −0.51 甘草次酸 三萜类 469.330 8 [M-H]− 225.924 4 −3.47 B23 45.358 284.294 9 266.261 0 C18H34O [M+NH4]+ 83.086 0, 95.085 7 0.88 9-十八烯醛 脂类 B24 46.217 281.249 1 282.255 9 C18H34O2 [M-H]− 1.43 油酸 脂肪酸类 注:“*”表示经过对照品比对鉴定的化学成分。 -
[1] DU Y, BAI Y, XIE P, et al. Chronic gastritis in China: a national multi-center survey[J]. BMC Gastroenterol. 2014;14: 21. [2] 李云虎, 田凤艳, 王春勇, 等. 85例柴胡桂枝干姜汤病例资料回顾性分析[J]. 中国中医基础医学杂志, 2022, 28(6):944-947. doi: 10.3969/j.issn.1006-3250.2022.6.zgzyjcyx202206024 [3] 李陆军, 陶永梅. 柴胡桂枝干姜汤现代临床应用[J]. 中医药学报, 2015, 43(3):140-3. [4] 毛奕懿, 张淑文, 安世栋等. 从“肝热脾寒”运用柴胡桂枝干姜汤经验探析[J]. 天津中医药, 2023, 40(04):427-430. [5] DAINA A, MICHIELIN O, ZOETE V. SwissTargetPrediction: updated data and new features for efficient prediction of protein targets of small molecules[J]. Nucleic Acids Res, 2019, 47(W1):W357-W364. doi: 10.1093/nar/gkz382 [6] CONSORTIUM U. UniProt: the universal protein knowledgebase in 2021[J]. Nucleic Acids Res, 2021, 49(D1):D480-D489. doi: 10.1093/nar/gkaa1100 [7] AMBERGER J S, BOCCHINI C A, SCHIETTECATTE F, et al. OMIM. org: online Mendelian Inheritance in Man (OMIM®), an online catalog of human genes and genetic disorders[J]. Nucleic Acids Res, 2015, 43(Database issue): D789-D798. [8] WISHART D S, FEUNANG Y D, GUO A C, et al. DrugBank 5.0: a major update to the DrugBank database for 2018[J]. Nucleic Acids Res, 2018, 46(D1):D1074-D1082. doi: 10.1093/nar/gkx1037 [9] PIÑERO J, RAMÍREZ-ANGUITA J M, SAÜCH-PITARCH J, et al. The DisGeNET knowledge platform for disease genomics: 2019 update[J]. Nucleic Acids Res, 2020, 48(D1):D845-D855. [10] SZKLARCZYK D, KIRSCH R, KOUTROULI M, et al. The STRING database in 2023: protein-protein association networks and functional enrichment analyses for any sequenced genome of interest[J]. Nucleic Acids Res, 2023, 51(D1):D638-D646. doi: 10.1093/nar/gkac1000 [11] SHERMAN B T, HAO M, QIU J, et al. DAVID: a web server for functional enrichment analysis and functional annotation of gene lists(2021 update)[J]. Nucleic Acids Res, 2022, 50(W1):W216-W221. doi: 10.1093/nar/gkac194 [12] 曾天玉, 郭玉红, 刘清泉. 刘清泉应用柴胡桂枝干姜汤临床经验[J]. 北京中医药, 2021, 40(11):1207-1208. [13] 梁曼青, 刘万里, 苏坤涵, 等. 柴胡桂枝干姜汤治疗消化系统疾病的临床研究概况[J]. 湖南中医杂志, 2023, 39(2):189-193. [14] 张慈安, 刘煊, 岳小强. 柴胡桂枝干姜汤在消化系统疾病中应用举隅[J]. 浙江中医杂志, 2023, 58(9):695-696. doi: 10.3969/j.issn.0411-8421.2023.09.040 [15] CHEN J R, LI G M, SUN C, et al. Chemistry, pharmacokinetics, pharmacological activities, and toxicity of quercitrin[J]. Phytother Res, 2022, 36(4):1545-1575. doi: 10.1002/ptr.7397 [16] EL MENYIY N, ABOULAGHRAS S, BAKRIM S, et al. Genkwanin: an emerging natural compound with multifaceted pharmacological effects[J]. Biomed Pharmacother, 2023, 165:115159. doi: 10.1016/j.biopha.2023.115159 [17] DE LIMA R M T, DOS REIS A C, DE MENEZES A A P M, et al. Protective and therapeutic potential of ginger(Zingiber officinale)extract and[6]-gingerol in cancer: a comprehensive review[J]. Phytother Res, 2018, 32(10):1885-1907. doi: 10.1002/ptr.6134 [18] 詹权操, 刘宇哲, 席雨蒙, 等. 6-姜辣素改善老年大鼠脂肪组织胰岛素抵抗的研究[J]. 中国中药杂志, 2022, 47(6):1642-1649. [19] TU B R, LIANG J F, OU Y, et al. Novel 18β-glycyrrhetinic acid derivatives as a Two-in-One agent with potent antimicrobial and anti-inflammatory activity[J]. Bioorg Chem, 2022, 122:105714. doi: 10.1016/j.bioorg.2022.105714 [20] ASL M N, HOSSEINZADEH H. Review of pharmacological effects of Glycyrrhiza sp. and its bioactive compounds[J]. Phytother Res, 2008, 22(6):709-724. doi: 10.1002/ptr.2362 [21] KOWALSKA A, KALINOWSKA-LIS U. 18β-Glycyrrhetinic acid: its core biological properties and dermatological applications[J]. Int J Cosmet Sci, 2019, 41(4):325-331. doi: 10.1111/ics.12548 [22] AGGARWAL B B, GUPTA S C, KIM J H. Historical perspectives on tumor necrosis factor and its superfamily: 25 years later, a golden journey[J]. Blood, 2012, 119(3):651-665. doi: 10.1182/blood-2011-04-325225 [23] TANAKA T, NARAZAKI M, KISHIMOTO T. IL-6 in inflammation, immunity, and disease[J]. Cold Spring Harb Perspect Biol, 2014, 6(10):a016295. doi: 10.1101/cshperspect.a016295 [24] TONG Y L, WANG R L, LIU X, et al. Zuojin Pill ameliorates chronic atrophic gastritis induced by MNNG through TGF-β1/PI3K/Akt axis[J]. J Ethnopharmacol, 2021, 271:113893. doi: 10.1016/j.jep.2021.113893 [25] JIN D C, HUANG K T, XU M, et al. Deoxycholic acid induces gastric intestinal metaplasia by activating STAT3 signaling and disturbing gastric bile acids metabolism and microbiota[J]. Gut Microbes, 2022, 14(1):2120744. doi: 10.1080/19490976.2022.2120744 [26] PARK H S, WIJERATHNE C U B, JEONG H Y, et al. Gastroprotective effects of Hwanglyeonhaedok-Tang against Helicobacter pylori-induced gastric cell injury[J]. J Ethnopharmacol, 2018, 216:239-250. doi: 10.1016/j.jep.2018.01.025 [27] AMATYA N, GARG A V, GAFFEN S L. IL-17 signaling: the Yin and the Yang[J]. Trends Immunol, 2017, 38(5):310-322. doi: 10.1016/j.it.2017.01.006 [28] LI X X, BECHARA R, ZHAO J J, et al. IL-17 receptor-based signaling and implications for disease[J]. Nat Immunol, 2019, 20(12):1594-1602. doi: 10.1038/s41590-019-0514-y [29] SHEN C Y, LU C H, WU C H, et al. The development of Maillard reaction, and advanced glycation end product(AGE)-receptor for AGE(RAGE)signaling inhibitors as novel therapeutic strategies for patients with AGE-related diseases[J]. Molecules, 2020, 25(23):5591. doi: 10.3390/molecules25235591 [30] BROWN G D, WILLMENT J A, WHITEHEAD L. C-type lectins in immunity and homeostasis[J]. Nat Rev Immunol, 2018, 18(6):374-389. doi: 10.1038/s41577-018-0004-8 [31] VILLACORTA L, MINARRIETA L, SALVATORE S R, et al. In situ generation, metabolism and immunomodulatory signaling actions of nitro-conjugated linoleic acid in a murine model of inflammation[J]. Redox Biol, 2018, 15:522-531. doi: 10.1016/j.redox.2018.01.005 -




 下载:
下载: