-
自然界中硒包括无机硒化物和有机硒化物。在体内无机硒化物有较大的毒性,不易被吸收。而有机硒化物在体内以硒半胱氨酸形式存在,且被发现为谷胱甘肽过氧化物酶(GSH-Px)、碘甲状腺素脱碘酶(ID)和硫氧还蛋白还原酶(TrxR)等酶的活性中心。在化学合成的有机硒化物中,异硒唑酮类化合物的研究最为广泛,该化合物在体内可以模拟GSH-Px的活性。本文以该类化合物Ebselen为代表,总结和讨论异硒唑酮类化合物在疾病治疗中的作用和化学合成方法的研究进展。
-
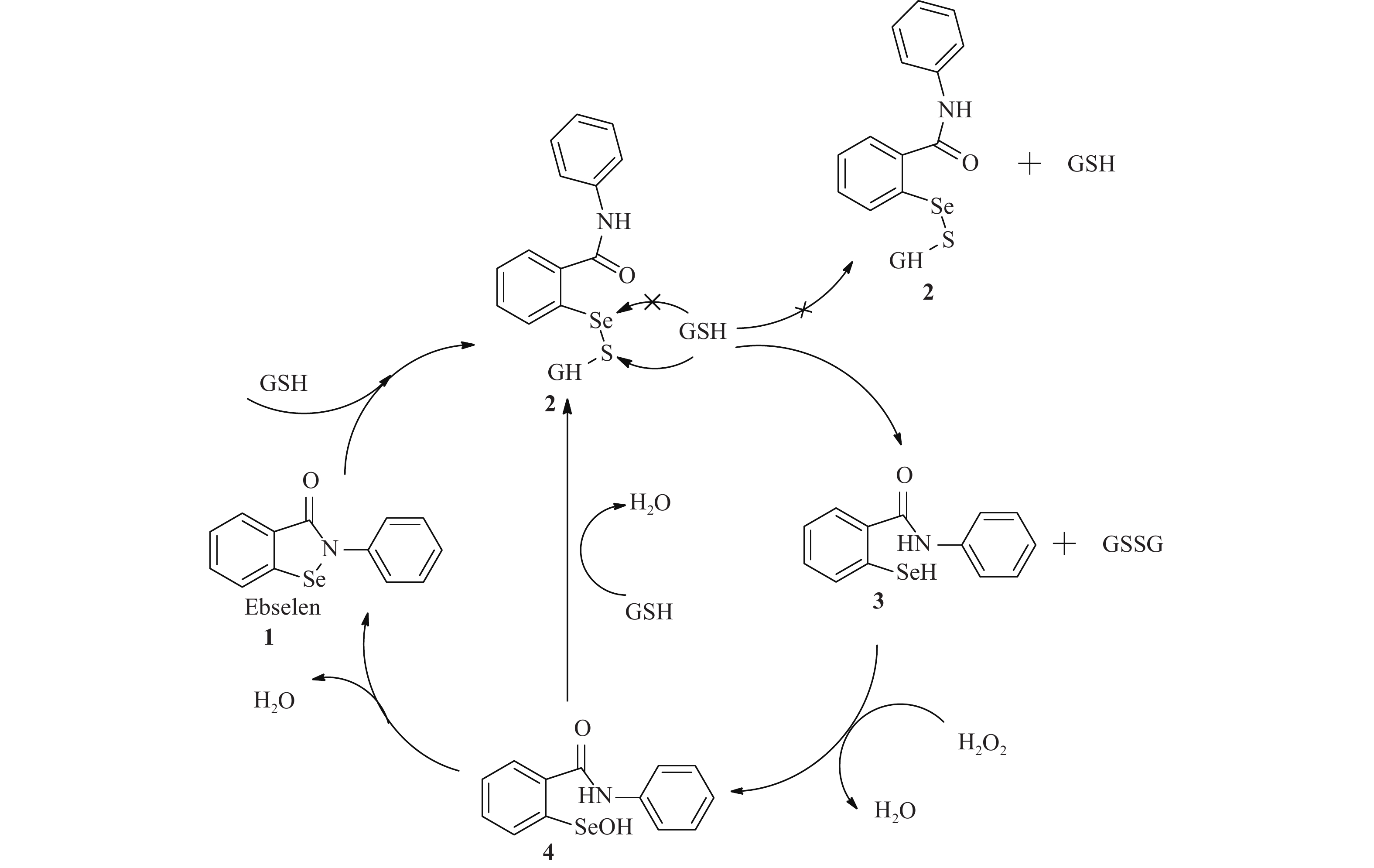
异硒唑酮类化合物在上世纪就被研究人员合成出来,但并没有成为研究的热点,直到1973年有学者报道GSH-Px 是一种硒酶[1],该类化合物具有模拟GSH-Px的作用,且在体内参与机体抗氧化这一复杂过程[2]。这一类化合物中研究最为广泛的是Ebselen【2-phenyl-1,2-benzisoselenazol-3(2H)-one】,它是一种低毒性的小分子化合物,对多种疾病表现出优秀的疗效,被证实具有GSH-Px活性、TrxR活性、氢过氧化物还原活性[3]。合理推测的异硒唑酮类化合物模拟GSH-Px活性机制如图1(Ebselen在过氧化氢环境中将谷胱甘肽作为底物)。Ebselen 1可与还原型谷胱甘肽(GSH)反应生成硒基硫化物2,后GSH可亲核进攻硒基硫化物2上的Se原子和S原子,进攻Se原子则生成硒基硫化物2和GSH不能生成活性中间体硒醇3为无效进攻,进攻S原子则硒基硫化物2和GSH反应生成硒醇3和氧化型谷胱甘肽(GSSH),硒醇3再还原过氧化氢得到亚硒酸4和水,在环境中存在GSH时亚硒酸4与GSH反应又可以生成硒基硫化物2,当环境中没有GSH时硒酸4脱水生成Ebselen 1[4]。硒醇3是此循环中的活性中间体,因此在异硒唑酮类化合物的衍生化研究中,如何产生稳定的活性中间体硒醇和增加GSH对硒基硫化物2上S原子的亲核进攻成为了研究人员的主要目标。
-
脑卒中俗称中风,发病机理是由脑部血管出血或堵塞所引起的脑部实质性损伤,涉及多种损伤机制,包括氧自由基的产生、钙超载、细胞毒性和凋亡等以及诱发多种炎症介质的产生,最终导致脑血液循环障碍产生。异硒唑酮类化合物Ebselen在体内被证明具有抗炎和抗氧化特性,这已在各种体内模型中得到了证明。在以动物(大鼠、狗)所构建的中风模型中,经实验研究表明Ebselen能够抑制中风模型中的血管痉挛和组织损伤,这与其抗氧化作用密切相关[5, 6]。日本一项针对缺血性脑卒中(包括血栓形成和栓塞)的Ⅲ期临床实验表明,患者使用Ebselen治疗1个月后取得了明显优于安慰剂的治疗结果,并且发现中风发生后24 h内开始使用Ebselen治疗的病人病情有明显的好转[7]。针对出血性脑卒中(蛛网膜下腔出血)的多中心双盲临床试验表明Ebselen治疗后的结果同样明显好于安慰剂组,CT 扫描显示脑池低密度区的发生率和范围都有相应的减少[8]。
-
临床上,听力损失的病因通常分为传导性、感音神经性和混合性3类。可预防的听力损失其常见的形式是药物毒副作用和特定噪音导致的听力损失,有研究表明噪音引起的听力损失与耳蜗中炎症细胞和炎症介质的募集有关。噪音可对耳蜗产生伤害,刺激局部或循环中的炎症细胞,同样在给予抗癌药物顺铂和氨基糖苷类药物后,在耳蜗中也观察到类似的现象,这种损伤机制涉及ROS与耳蜗炎症转录因子的激活有关[9, 10]。异硒唑酮类化合物Ebselen具有模拟GPx酶的能力起到抗氧化损伤的作用,因此会降低耳毒性药物的发生和药物毒副作用。在美国Ebselen(SPI-
1005 )正用于治疗梅尼埃病和急性噪声性听力损失的临床试验。梅尼埃病(MD)是一种听力损失的综合性疾病(听力损失、耳鸣、眩晕或头晕)。在进行的这些临床试验中均没有发现因药物本身所引起的重大毒性事件。2022年8月2日SPI-1005 又开启了Ⅲ期临床试验,这些实验数据将对听力损失防治的研究领域有巨大的影响[11]。本课题组前期探索设计合成了一些新型异硒唑酮类化合物,获得了水溶性和GPx模拟活性均得到提升的化合物,并在顺铂听力损失动物模型上展现出优于Ebselen的保护活性。 -
目前抑郁症和焦虑症(以及其他精神障碍疾病)成为全球重点关注的公共卫生问题,且在2020年被确定为世界第二大疾病,仅次于癌症。抑郁症在临床上大多具有良好的预后,小部分抑郁症患者确诊后,接受两次或两次以上的正规治疗后还未能实现预期的治疗目标,这种情况被认为是难治性抑郁症(TRD)[12]。在TRD的临床治疗中,医师根据病情在开具相关药物后会配伍使用锂剂来增强疗效[13]。但锂剂在抑郁症患者处于病情急性期时,其治疗效果不如其他抗抑郁药有效[14],并且锂剂在使用过程中患者耐受性差、治疗指数窄,需要经常监测血液,此外锂剂还有严重的副作用,包括甲状腺功能减退、甲状旁腺功能亢进、体重增加和肾功能损害等。因此在临床上急需寻找一个可以替代锂剂的药物[15]。锂剂在体内发挥抗抑郁作用依靠的是其能抑制磷酸肌醇代谢和对5-羟色胺/血清素(5-HT)神经传递产生复杂的影响,从而促进突触前血清素的释放并降低血清素 2(5-HT2 )受体的敏感性[16, 17],经研究人员筛选发现Ebselen同样具有抑制肌醇单磷酸酶(IMPase)的能力,Ebselen能与IMPase共价结合使其分子变构失活,从而导致肌醇中的肌醇循环中断。并且Ebselen对5-HT有类似锂剂的作用效果,从而达到与锂剂相类似的疗效,且Ebselen对肌醇的抑制(IC50=1.5 µmol/L)优于锂对肌醇的抑制(IC50 =0.8 mmol/L)这表明Ebselen对肌醇抑制的灵敏度高于锂剂 [18]。在对小鼠进行五选一连续反应时间任务实验(5-CSRTT)和啮齿动物赌博任务实验(RGT)中发现(5-CSRTT和RGT分别模拟运动冲动和选择冲动),Ebselen优先减少运动冲动而不是选择冲动[19]。这表明Ebselen有助于预防抑郁症患者的自杀以及减少行为冲动,例如病态赌博。综上所述,Ebselen在代替锂剂成为新的抑郁症治疗药物方面拥有巨大的潜力。
-
自2019年12月以来新型冠状病毒(SARS-CoV-2)在全球范围内快速传播,SARS-CoV-2会影响胃肠系统、肝脏、肾脏、心脏和中枢神经系统以及下呼吸系统,最终导致多器官衰竭死亡。SARS-CoV-2病毒感染原理为病毒进入宿主细胞后,利用宿主细胞内的营养开始自我复制,其RNA中的ORF1a/b首先翻译表达出两条多聚蛋白前体(pp1a和pp1ab),多聚蛋白前体在主蛋白酶(Mpro)和木瓜样蛋白酶(papain like proteases)的作用下发生分子内的切割以产生更小的非结构蛋白(nsp)后再发挥作用[20]。Mpro在病毒复制过程中起关键作用,其抑制剂具有专属性强且广谱抗冠状病毒的特点,因此Mpro是一个治疗SARS-CoV-2的理想靶点。研究人员通过计算机结构预测和高通量筛选相结合的方法筛选了超10 000 种化合物,发现了小分子Mpro抑制剂Ebselen,它与Mpro共价结合使其在细胞内失去活性,且对新冠病毒有较低的IC50值,在细胞阶段的实验中表现出了很好的抗冠状病毒活性,因此Ebselen被期望为拥有巨大前景的 Mpro 抑制剂[21]。并且Ebselen在体内还发挥着许多其他的有利SARS-CoV-2治疗的效应,包括Ebselen可减少体内氧化过程中的产物,例如脂质氢过氧化物、H2O2、次卤酸和过氧化亚硝酸盐等和减少细胞因子的过度产生以及中性粒细胞浸润等,从而抵消部分肺部和血管炎症。本课题组前期设计合成了一些新型异硒唑酮类化合物,并且通过酶活检测获得了水溶性和GPx模拟活性均有较大提升的化合物,在新型冠状病毒感染动物模型上展现出优于Ebselen的保护活性。
-
人类对抗生素的滥用导致细菌的耐药性不断增强,各种超级细菌层出不穷,例如耐甲氧西林金黄色葡萄球菌(MRSA),MRSA感染后表现为菌血症、心内膜炎、关节感染和皮肤软组织感染等。Ebselen因其独特的化学结构,通常做为抗菌共价抑制剂,发挥作用时打开苯并异硒唑酮环与各种蛋白质硫醇共价结合形成S-Se键的不可逆复合物。在致病菌中硫氧还蛋白还原酶,是Ebselen公认的分子靶标。硫氧还蛋白还原酶的抑制扰乱了致病菌自身的氧化还原控制系统,从而影响遗传物质的表达和必需蛋白的合成。用Ebselen对6种病原体(屎肠球菌、金黄色葡萄球菌、肺炎克雷伯菌、鲍曼不动杆菌、铜绿假单胞菌和泄殖腔肠杆菌—ESKAPE)进行抗菌实验结果表明,Ebselen对耐甲氧西林和糖肽抗生素万古霉素的金黄色葡萄球菌分离株表现出临床适用的杀菌活性(最低抑菌浓度,MIC=0.25 μg/ml)[22]。将Ebselen对万古霉素耐药肠球菌分离株的体外活性与利奈唑胺和雷莫拉宁(一种抑制细胞壁生物合成的糖脂蛋白酶)进行比较,运用标准定时杀灭测定法,确认了Ebselen和利奈唑胺在两种浓度(3×MIC和6×MIC)下对万古霉素耐药的屎肠杆菌的抑菌特性以及雷莫拉宁的快速杀菌作用[23]。Ebselen与银离子(硝酸银)对G−耐药菌感染具有协同抗菌作用,单独使用Ebselen对缺乏谷胱甘肽和谷胱甘肽还原酶的G+耐药菌具有很强的杀菌作用,对G−耐药菌杀菌效果一般。然而,研究发现具有双份氧化还原系统的G−耐药菌对Ebselen与银这种药物组合十分敏感。Ebselen将银对大肠杆菌的抗菌浓度降低了一个数量级,单独使用银的最小抑制浓度为42 μmol/L,而Ebselen与银的协同给药将浓度降低至2.4 μmol/L[24]。目前使用Ebselen参与抗菌更多的是联合给药,Ebselen与局部抗菌药物的协同作用有望预防和治疗容易通过公共卫生渠道感染的MRSA[25]。
另外,有研究表明,Ebselen还在很多其他疾病治疗中展现出潜在的作用。Ebselen被发现具有抗 HIV-1作用,它被确定为 LEDGF/p75-IN 相互作用的中度微摩尔抑制剂。Ebselen通过与 LEDGF/p75 结合来抑制相互作用,但也有研究表明Ebselen相互作用的能力可以被二硫苏糖醇(DTT)逆转[26];Ebselen还具有抑制 HCV 中3h解旋酶的作用,这表明Ebselen可以修饰 NS3h 中的半胱氨酸,但也有学者指出它从核酸中置换 NS3h 的能力似乎与核酸结合裂隙中半胱氨酸的修饰无关[27];在抗甲型流感病毒中,Ebselen表现出抗炎特性,是通过抑制肺 ICAM-1 表达从而抑制 TNF-α 和 IL-1β来实现,它们是有效的中性粒细胞募集介质和 ICAM-1 表达的有效诱导剂[28];同时Ebselen还可显著降低ZIKV 诱导的睾丸氧化应激、白细胞浸润和促炎反应的产生[29];且Ebselen在体外对鼠疟原虫和人类恶性疟原虫显示出抗疟疾活性[30];Ebselen可破坏锥虫硫酮系统,阻碍对锥虫氧化应激的防御[31]。
-
异硒唑酮类化合物的合成方法包含3类:邻氨基苯甲酸为原料的多步合成路线、N-苯基苯甲酰胺为原料的多步合成路线和邻卤素取代的苯基苯甲酰胺为原料的合成路线。
-
1981年Welter André Dr提出了开创性的路线,方法如下:首先将Se还原为Na2Se2,邻氨基苯甲酸与NaNO2在酸性环境下进行重氮化反应生成重氮盐,将重氮盐加入碱性环境的Na2Se2中发生亲核取代生成联硒中间体1,中间体1经氯化亚砜回流酰化,得到2-硒氯苯甲酰氯2,最后加入相应取代的胺和K2CO3缩合成环,最终获得一系列异硒唑酮类化合物4。反应的总产率为42%~55%(图2)[32],该路线是实验室制备此类化合物的常用路线之一,具有安全性高,重现性好,但是步骤比较繁琐,反应过程时间较长。2020年Vanessa Nascimento运用DFT计算优化改造了这条路线,以化合物1为原料,通过缩合反应得到双苯甲酰胺3,化合物3通过与碘分子在碱性条件下直接环合生成一系列异硒唑酮类化合物4[33]。优化后反应产率提高,但操作也相对复杂总产率为70%~99%(图2)。
-
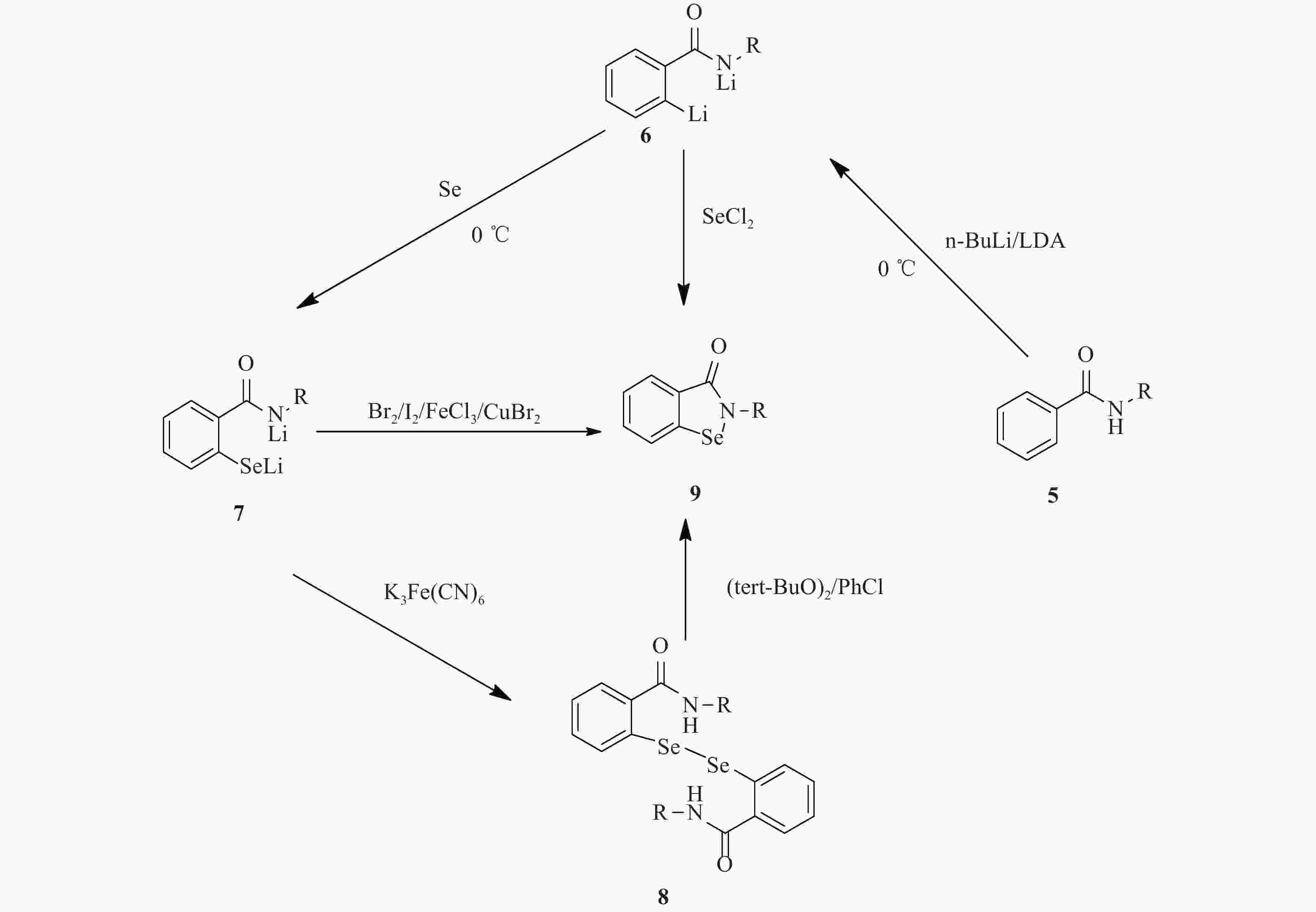
1989年Engman提出了以N-苯基苯甲酰胺5为原料,通过正丁基锂(n-BuLi)的邻位锂化反应得到苯甲酰苯胺衍生的离子中间体6,已知硫元素和硒元素都很容易插入各种有机锂的C-Li键之间,然后再在冰浴的环境下加入Se粉,将硒原子插入在C-Li之间得到中间体7,随后尝试使用了多种氧化剂来环合中间体7,并最终得到异硒唑酮类化合物9,实验发现这些氧化剂中CuBr2对中间体7的环合效果最好,路线总收率为63%[34] (图3)。1995年Fong针对这条路线进行了优化,在成功拿到中间体7后,尝试使用铁氰化钾将联硒中间体8给单独分离出来,化合物8则通过与二叔丁基过氧化物或氯苯发生均裂取代反应,最终合成异硒唑酮类化合物9[35]。此反应优化后产率有所提升,但分离步骤较为繁琐,操作难度大(图3)。1996年Oppenheimer优化了这条路线中的邻位锂化过程,思路是在邻位锂化反应中以二异丙基氨基锂(LCD)和n-BuLi一起作为锂化试剂,在 0 ℃下发生邻位锂化反应,通过改良锂化反应的试剂,使中间体6的产率有所提升[36](图3)。2004年Zade尝试优化这条路线,选择在拿到化合物6后直接使用SeCl2进行环合得到终产物9,此次优化减少了反应步骤,但最后的总收率也有明显下降只有40%左右,给该化合物的合成提供了新的思路,期待后续针对此路线的其他优化 [37](图3)。
-
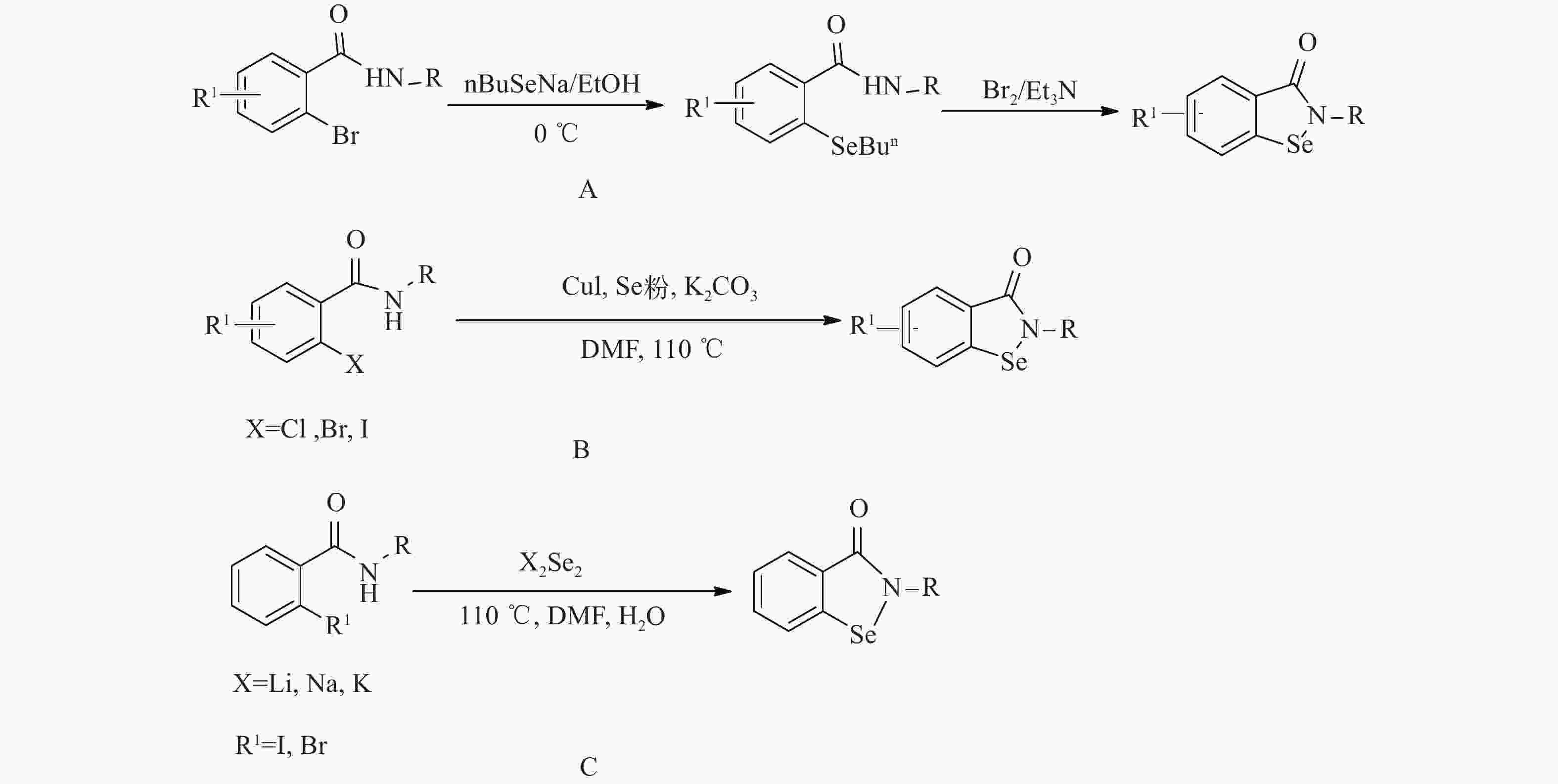
2017年Singh提出,首先建立无氧环境,并且环境温度为0 ℃,然后将酰胺类化合物原料添加到BuSeNa和EtOH混合体系下反应。通过亲核芳族取代引入硒,再通过与溴素诱导成环最终得到目标化合物,这条反应路线总的产率不高为38%~55%,且操作难度大(图4A)[38]。2010年Balkrishna发表了可用于合成相关异硒唑酮的催化方法。这是一种在碱性环境下通用、高效的催化合成Se-N杂环化合物的方法。将碘酰胺在CuI和1,10-菲咯啉的条件下经铜催化偶联生成目标化合物,经过广泛筛选后,发现在110 ℃下以DMF作为溶剂加入K2CO3,并用20 mol%的CuI和1,10-菲咯啉和硒粉去处理碘酰胺时,获得了高收率的目标化合物,且当R=苯乙基时的收率最高为96%,当碘酰胺的取代基X=I时反应的速度是最快的,这个方法操作简单一步就能得到目标化合物(图4B)[39],但是后处理比较困难,产物难以分离。一步就可以得到目标化合物的反应还有2014年Pacuta提出的,用2-碘代苯基酰胺类化合物与二硒化钠反应,以DMF为溶剂在110 ℃下反应一步即可生成苯并异硒唑酮类化合物,并且相对很理想收率达到了69%。 他们随后尝试了使用包括二硒化钾和二硒化锂这一类化合物作为反应物,结果产率相应的提高至 75%和 91%。 后续实验表明,若R1=Cl,则无法发生反应;若R1=Br ,则反应产率大大降低至 21%(图4C)[40]。
-
本文以异硒唑酮类化合物Ebselen为代表,展开讨论该类化合物在体内模拟GSH-Px活性的机制,以及其在脑卒中、感音神经性耳聋和耳鸣、COVID-19和抗菌等相关疾病上的治疗应用进展。再按照合成起始原料的差异,将该类化合物合成路线总结为3类,每一类路线都各有自己的优缺点,可根据实际需求选择合适的路线。异硒唑酮类化合物是一类十分有前景的化合物,非常值得研究者进一步深入探索。
Research progress on the treatment role and chemical synthesis methods of isoselenoazolones
-
摘要: 谷胱甘肽过氧化物酶(GSH-Px)是一种关键的硒酶,可保护机体免受氧化损伤。研究者设计和合成了一系列小分子有机硒化合物作为GPx的功能模拟物,其中,异硒唑酮类化合物研究最为广泛。本文以该类化合物依布硒啉(Ebselen)为代表,总结和讨论异硒唑酮类化合物在体内模拟GSH-Px活性的催化机制,以及在脑卒中、感音神经性耳聋和耳鸣、难治性抑郁症(TRD)和新型冠状病毒(COVID-19)等相关疾病中的治疗作用,以及化学合成方法的研究。Abstract: Glutathione peroxidase (GSH-Px) is a key selenoenzyme that protects the body from oxidative damage. A series of small molecular organic selenium compounds have been designed and synthesized as functional mimics of GPx, among which isoselenazolones are the most widely studied. Taking Ebselen as a representative, the catalytic mechanism of isoselenazolones in mimicing GSH-Px activity in vivo, the therapeutic effects of isoselenazolones in stroke, sensorineurium deafness and tinnitus, treatmentresistant depression (TRD) and coronavirus disease 2019 (COVID-19), and research on their chemical synthesis methods were summarized and discussed in this paper.
-
Key words:
- organoselenium compounds /
- isoselenoazolones /
- ebselen /
- glutathione peroxidase /
- mimics
-
[1] ROTRUCK J T, POPE A L, GANTHER H E, et al. Selenium: biochemical role as a component of glutathione peroxidase[J]. Science, 1973, 179(4073):588-590. doi: 10.1126/science.179.4073.588 [2] STEINBRENNER H, SIES H. Protection against reactive oxygen species by selenoproteins[J]. Biochim Biophys Acta BBA Gen Subj, 2009, 1790(11):1478-1485. doi: 10.1016/j.bbagen.2009.02.014 [3] MÜLLER A, CADENAS E, GRAF P, et al. A novel biologically active seleno-organic compound—1[J]. Biochem Pharmacol, 1984, 33(20):3235-3239. doi: 10.1016/0006-2952(84)90083-2 [4] BHOWMICK D, MUGESH G. Insights into the catalytic mechanism of synthetic glutathione peroxidase mimetics[J]. Org Biomol Chem, 2015, 13(41):10262-10272. doi: 10.1039/C5OB01665G [5] GUL S, BAHADIR B, HANCI V, et al. Effects of ebselen versus nimodipine on cerebral vasospasm subsequent to experimental subarachnoid hemorrhage in rats[J]. J Clin Neurosci, 2010, 17(5):608-611. doi: 10.1016/j.jocn.2009.07.115 [6] WATANABE T, NISHIYAMA M, HORI T, et al. Ebselen(DR3305)ameliorates delayed cerebral vasospasm in a canine two-hemorrhage model[J]. Neurol Res, 1997, 19(5):563-565. doi: 10.1080/01616412.1997.11740859 [7] YAMAGUCHI T, SANO K, TAKAKURA K, et al. Ebselen in acute ischemic stroke: a placebo-controlled, double-blind clinical trial. Ebselen Study Group[J]. Stroke, 1998, 29(1):12-17. doi: 10.1161/01.STR.29.1.12 [8] SAITO I, ASANO T, SANO K, et al. Neuroprotective effect of an antioxidant, ebselen, in patients with delayed neurological deficits after aneurysmal subarachnoid hemorrhage[J]. Neurosurgery, 1998, 42(2):269-277. doi: 10.1097/00006123-199802000-00038 [9] RABINOWITZ P M. Noise-induced hearing loss[J]. Am Fam Physician, 2000, 61(9):2749-2756,2759-2760. [10] DING T H, YAN A H, LIU K. What is noise-induced hearing loss?[J]. Br J Hosp Med, 2019, 80(9):525-529. doi: 10.12968/hmed.2019.80.9.525 [11] KIL J, HARRUFF E E, LONGENECKER R J. Development of ebselen for the treatment of sensorineural hearing loss and tinnitus[J]. Hear Res, 2022, 413:108209. doi: 10.1016/j.heares.2021.108209 [12] COWEN P J. Backing into the future: pharmacological approaches to the management of resistant depression[J]. Psychol Med, 2017, 47(15):2569-2577. doi: 10.1017/S003329171700068X [13] DEL MATTO L, MUSCAS M, MURRU A, et al. Lithium and suicide prevention in mood disorders and in the general population: a systematic review[J]. Neurosci Biobehav Rev, 2020, 116:142-153. doi: 10.1016/j.neubiorev.2020.06.017 [14] National Institute for Health and Clinical Excellence(NICE). Depression: Evidence Update April 2012: A summary of selected new evidence relevant to NICE clinical guideline 90 ‘The treatment and management of depression in adults’ (2009)[R]. London: National Institute for Health and Clinical Excellence (NICE); 2012. (Evidence Update, No. 13. ) Available from: https://www.ncbi.nlm.nih.gov/books/NBK552056/. [15] MCKNIGHT R F, ADIDA M, BUDGE K, et al. Lithium toxicity profile: a systematic review and meta-analysis[J]. Lancet, 2012, 379(9817):721-728. doi: 10.1016/S0140-6736(11)61516-X [16] ANTONIADOU I, KOUSKOU M, ARSIWALA T, et al. Ebselen has lithium-like effects on central 5-HT2A receptor function[J]. Br J Pharmacol, 2018, 175(13):2599-2610. doi: 10.1111/bph.14179 [17] BERRIDGE M J, DOWNES C P, HANLEY M R. Neural and developmental actions of lithium: a unifying hypothesis[J]. Cell, 1989, 59(3):411-419. doi: 10.1016/0092-8674(89)90026-3 [18] HARWOOD A J. Lithium and bipolar mood disorder: the inositol-depletion hypothesis revisited[J]. Mol Psychiatry, 2005, 10(1):117-126. doi: 10.1038/sj.mp.4001618 [19] BARKUS C, FERLAND J M N, ADAMS W K, et al. The putative lithium-mimetic ebselen reduces impulsivity in rodent models[J]. J Psychopharmacol Oxf Engl, 2018, 32(9):1018-1026. doi: 10.1177/0269881118784876 [20] TRIPATHI N, TRIPATHI N, GOSHISHT M K. COVID-19: inflammatory responses, structure-based drug design and potential therapeutics[J]. Mol Divers, 2022, 26(1):629-645. doi: 10.1007/s11030-020-10176-1 [21] JIN Z M, DU X Y, XU Y C, et al. Structure of mpro from SARS-CoV-2 and discovery of its inhibitors[J]. Nature, 2020, 582(7811):289-293. doi: 10.1038/s41586-020-2223-y [22] YOUNIS W, THANGAMANI S, SELEEM M N. Repurposing non-antimicrobial drugs and clinical molecules to treat bacterial infections[J]. Curr Pharm Des, 2015, 21(28):4106-4111. doi: 10.2174/1381612821666150506154434 [23] ABDELKHALEK A, ABUTALEB N S, MOHAMMAD H, et al. Repurposing ebselen for decolonization of vancomycin-resistant enterococci(VRE)[J]. PLoS One, 2018, 13(6):e0199710. doi: 10.1371/journal.pone.0199710 [24] ZOU L L, LU J, WANG J, et al. Synergistic antibacterial effect of silver and ebselen against multidrug-resistant Gram-negative bacterial infections[J]. EMBO Mol Med, 2017, 9(8):1165-1178. doi: 10.15252/emmm.201707661 [25] THANGAMANI S, YOUNIS W, SELEEM M N. Repurposing ebselen for treatment of multidrug-resistant staphylococcal infections[J]. Sci Rep, 2015, 5:11596. doi: 10.1038/srep11596 [26] ZHANG D W, YAN H L, XU X S, et al. The selenium-containing drug ebselen potently disrupts LEDGF/p75-HIV-1 integrase interaction by targeting LEDGF/p75[J]. J Enzyme Inhib Med Chem, 2020, 35(1):906-912. doi: 10.1080/14756366.2020.1743282 [27] MUKHERJEE S, WEINER W S, SCHROEDER C E, et al. Ebselen inhibits hepatitis C virus NS3 helicase binding to nucleic acid and prevents viral replication[J]. ACS Chem Biol, 2014, 9(10):2393-2403. doi: 10.1021/cb500512z [28] HADDAD E B, MCCLUSKIE K, BIRRELL M A, et al. Differential effects of ebselen on neutrophil recruitment, chemokine, and inflammatory mediator expression in a rat model of lipopolysaccharide-induced pulmonary inflammation[J]. J Immunol, 2002, 169(2):974-982. doi: 10.4049/jimmunol.169.2.974 [29] SIMANJUNTAK Y, LIANG J J, CHEN S Y, et al. Ebselen alleviates testicular pathology in mice with Zika virus infection and prevents its sexual transmission[J]. PLoS Pathog, 2018, 14(2):e1006854. doi: 10.1371/journal.ppat.1006854 [30] HÜTHER A M, ZHANG Y, SAUER A, et al. Antimalarial properties of ebselen[J]. Parasitol Res, 1989, 75(5):353-360. doi: 10.1007/BF00931130 [31] LU J, VODNALA S K, GUSTAVSSON A L, et al. Ebsulfur is a benzisothiazolone cytocidal inhibitor targeting the trypanothione reductase of Trypanosoma brucei[J]. J Biol Chem, 2013, 288(38):27456-27468. doi: 10.1074/jbc.M113.495101 [32] Welter André Dr. , Christiaens Léon Dr. , Wirtz-Peitz Dr. New benzisoselenazolones, process for producing the same and pharmaceutical preparations containing the same. Europe, EP0044453[p]. 1981-07-04. [33] NASCIMENTO V, CORDEIRO P S, ARCA M, et al. Fast and easy conversion of ortho amidoaryldiselenides into the corresponding ebselen-like derivatives driven by theoretical investigations[J]. New J Chem, 2020, 44(22):9444-9451. doi: 10.1039/D0NJ01605E [34] ENGMAN L, HALLBERG A. Expedient synthesis of ebselen and related compounds[J]. J Org Chem, 1989, 54(12):2964-2966. doi: 10.1021/jo00273a035 [35] FONG M C, SCHIESSER C H. Reactions of 2, 2’-diselenobis (N-alkylbenzamides) with peroxides: a free-radical synthesis of Ebselen and related analogues[J]. Tetrahedron Lett, 1995, 36(40):7329-7332. doi: 10.1016/0040-4039(95)01511-F [36] OPPENHEIMER J,. Synthesis of 2-phenyl-1, 2-benziso[77Se]selenazol-3(2H)-one: “ebselen”[J]. J Label Compd Radiopharm, 1996, 38(3):281-284. doi: 10.1002/(SICI)1099-1344(199603)38:3<281::AID-JLCR833>3.0.CO;2-1 [37] ZADE S S, PANDA S, SINGH H B, et al. Synthesis of diaryl selenides using the in situ reagent SeCl2[J]. Tetrahedron Lett, 2005, 46(4):665-669. doi: 10.1016/j.tetlet.2004.11.125 [38] SINGH V P, POON J F, YAN J J, et al. Nitro-, azo-, and amino derivatives of ebselen: synthesis, structure, and cytoprotective effects[J]. J Org Chem, 2017, 82(1):313-321. doi: 10.1021/acs.joc.6b02418 [39] BALKRISHNA S J, BHAKUNI B S, CHOPRA D, et al. Cu-catalyzed efficient synthetic methodology for ebselen and related Se–N heterocycles[J]. Org Lett, 2010, 12(23):5394-5397. doi: 10.1021/ol102027j [40] PACUŁA A J, ŚCIANOWSKI J, ALEKSANDRZAK K B. Highly efficient synthesis and antioxidant capacity of N-substituted benzisoselenazol-3(2H)-ones[J]. RSC Adv, 2014, 4(90):48959-48962. doi: 10.1039/C4RA08631G -




 下载:
下载: