-
癌症对人类是仅次于心血管疾病的第二大“杀手”,严重威胁着人类的生命健康[1]。相关统计表明,2018年,全球新增癌症病例1 810万,死亡病例960万[2-3]。预计到2030年,新增癌症病例和死亡人数将增长约1.5倍,其防治形势十分严峻[4]。目前,治疗恶性肿瘤的方法主要有手术切除、放射疗法、生物治疗以及药物治疗等[5]。其中,药物治疗仍是肿瘤治疗的重要手段。但一半以上的癌症对传统化疗药物已产生明显耐药。临床证据显示,90%以上转移性癌症患者死于不同程度的耐药[6],肿瘤耐药已成为目前临床化疗失败的首要原因。因此,开发多药耐药的新型抗肿瘤化疗药物已迫在眉睫。
微管蛋白抑制剂一直是抗肿瘤药物研发的热点之一[7]。微管是由α/β微管蛋白组成的异二聚体,是细胞骨架的主要组成部分[8]。微管具有多种生物学功能,能参与细胞增殖、分裂等一系列过程[9-13],在细胞生命周期中起重要作用,是肿瘤细胞中的重要治疗靶标。紫杉醇、长春碱等微管蛋白抑制剂已广泛用于治疗多种癌症。然而,它们显示出治疗窗窄、选择性差以及多药耐药性问题,通常是由于P糖蛋白[14]或微管相关蛋白的过表达引起的[15]。因此,选择性好的低毒小分子靶向微管蛋白抑制剂仍有很大需求。
查尔酮衍生物是类黄酮中一类重要的化合物,分子结构简单,以1,3-二苯基丙烯酮为基本骨架,具有广泛的生物学活性,如抗肿瘤、抗氧化、抗炎、降血糖、抗菌等[16-19]。吲哚查尔酮是本课题组研究发现的一类新型查尔酮衍生物,相比经典的查尔酮,其抗肿瘤活性显著提高,作用机制研究表明该类化合物作用于β微管蛋白上的秋水仙碱位点[20],规避了P糖蛋白调控的肿瘤多药耐药机制[21]以及β-Ⅲ型微管蛋白过表达的影响[22],具有良好的抗肿瘤耐药活性。化合物FC58是本课题组前期合成的查尔酮类衍生物之一,具有非常好的抗肿瘤活性(A549,GI50 = 38 nmol/L)[23]。课题组以此化合物为研究对象,考察其对多种白血病细胞株的生长抑制活性,特别是耐药白血病细胞的活性,并通过细胞周期实验分析其作用特点,现报道如下。
-
全自动酶标仪(BioTek,型号:Synergy 2);流式细胞仪(BD,型号:Accuri C6);熔点测试仪(上海精科,型号:WRR);核磁共振仪(Bruker,型号:Ascend 400);高分辨质谱仪(Waters,型号:UPLC G2-XS Q-TOF);薄层色谱硅胶板(烟台江友,型号:HSGF254)。实验所用试剂均为分析纯(伊诺凯)。紫杉醇、长春碱、多柔比星(Sigma-Aldrich),纯度>98%。HL60、HL60/DOX、K562、K562/HHT300、CCRF-CEM、CCRF-CEM/VLB100由海军军医大学药学院天然药物化学教研室传代和冻存。
-
将1-(3,4,5-三甲氧基苯基)乙-1-酮(1, 0.21 g, 1.0 mmol)与1H-吲哚-3-甲醛(2, 0.07 g, 0.5 mmol)溶于乙醇(4 ml)溶液中,加入哌啶(0.11 ml, 1.2 mmol),加热至95 ℃搅拌48 h,然后加入盐酸调节pH = 6淬灭反应,用乙酸乙酯萃取,饱和碳酸氢钠溶液、水和饱和氯化钠溶液洗涤,无水硫酸钠干燥、过滤、旋干有机相,剩余粗品经乙醇在−20 ℃重结晶,得到目标化合物FC58 0.017g,重结晶产率:10%,黄色固体,熔点:175.1~176.8 ℃,路线见图1。1H NMR (400MHz, CDCl3) δ : 8.71 (1H, br, NH), 8.13 (1H, d, J = 15.6 Hz, =CH), 8.00 (1H, m, Ar-H), 7.63 (1H, s, Ar-H), 7.55 (1H, d, J = 15.2 Hz, =CH), 7.46 (1H, m, Ar-H), 7.31 (4H, m, Ar-H), 3.96 (9H, s, 3×OCH3)。13C NMR (100MHz, CDCl3) δ : 189.86, 153.10, 138.78, 137.23, 134.44, 130.08, 123.57, 120.54, 117.82, 114.52, 111.99, 105.96, 60.97, 56.40。ESI-MS (m/z) : C20H19NO4 [M+H]+,理论值:338.1387, 实际值:338.1385。
-
样品配制:用适量DMSO(Sigma,C6295)溶解后,配成50 mmol/L的母液备用。取一定量的母液,用完全培养基将其稀释成一定浓度的溶液,作为初浓度。将初浓度溶液用完全培养基3倍稀释,共设置6个浓度梯度。
CellTiter-Blue法测试体外抗肿瘤活性。具体方法简述如下:96孔板每孔加入浓度为(2~4)×104个/ml的细胞悬液200 μl,置37 ℃,5% CO2培养箱内。24 h后,加入配制好的一定浓度梯度的待测物溶液,每孔200 μl,设置3个复孔,空白对照组加入200 μl的含1% DMSO的完全培养基,置于37 ℃,5% CO2的培养箱内48 h。每孔加入含10% CellTiter-Blue(Promega,G8081)的完全培养基,用全自动酶标仪测530/40 nm和590/35 nm处的荧光值(FV)作为背景值。置于37 ℃、5% CO2的培养箱内1~4 h,再用酶标仪在相同条件下读取荧光值。
细胞存活率(%)= 给药孔∆FV/空白对照孔∆FV。
根据各个浓度的细胞存活率值,使用GraphPad Prism 5软件对数据进行拟合可得到量效曲线和抑制细胞生长50%的药物浓度,即GI50。
根据药物对非耐药母代细胞和对耐药细胞的GI50计算药物的耐药指数(DRI)。公式: DRI =GI50(耐药细胞)/GI50(母代细胞)。
-
取对数生长的HL60和HL60/DOX细胞,用胰酶消化分散成单细胞悬液,以(5×105个/孔)接种于96孔板中,于37 ℃、5% CO2的培养箱中培养24 h。加入不同浓度的待测药物继续培养24 h。弃上清液,用0.25% Trypsin-EDTA(Gibco,25200056)消化,1000 r/min离心5 min收集细胞。用1 ml预冷的PBS(Hyclone,SH30256.FS)润洗细胞1次,离心收集细胞。细胞沉淀用9 ml预冷的70%乙醇轻轻混匀,4 ℃固定过夜。次日,离心沉淀细胞后,弃固定液,用1 ml预冷的PBS洗涤细胞2次,再次离心收集细胞。加入1 ml PI(50 μg/ml PI, 0.1 mg/ml RNase A, 0.05 % TritonX-100,碧云天)染液染色,4 ℃下避光孵育30 min,流式细胞仪检测,激发波长为488 nm,用EXPO32 ADC软件进行分析。
-
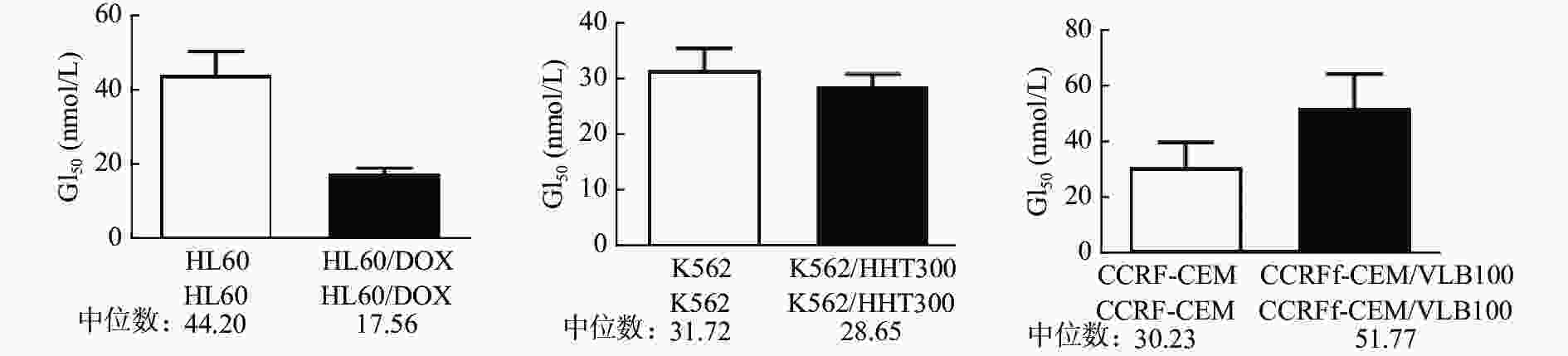
课题组选择多种白血病细胞及其耐药细胞(HL60、HL60/DOX、K562、K562/HHT300、CCRF-CEM、CCRF-CEM/VLB100)对紫杉醇、长春碱、多比柔星以及查尔酮衍生物FC58进行体外抗肿瘤活性测试。结果如表1所示,紫杉醇、长春碱和多柔比星对HL60、K562、CCRF-CEM细胞均有较强活性,GI50在0.12~135.30 nmol/L。而各耐药细胞对上述3种药物明显耐药,GI50在17.16~1398 nmol/L。耐药指数DRI在3.85~684.4。与紫杉醇、长春碱、多柔比星相比,虽然查尔酮衍生物FC58对以上白血病细胞的活性相对较弱,GI50在30.23~44.20 nmol/L,但对耐药白血病细胞具有优异活性,GI50在17.56~51.77 nmol/L,较亲代细胞更为敏感(图2)。DRI分别是0.40、0.90、1.71。其中,CCRF-CEM/VLB100细胞对FC58仅轻微耐药(DRI=1.71),远低于其他几种化疗药。
表 1 几种化合物的体外抗肿瘤活性的比较(
${\rm{GI}}_{50},\; {\rm{nmol/L}} $ )细胞系 化合物 紫杉醇 长春碱 多比柔星 FC58 HL60 6.68 2.90 40.27 44.20 HL60/DOX 292.50 89.52 1398 17.56 耐药指数 43.79 30.87 34.72 0.40 K562 12.15 0.12 135.30 31.72 K562/HHT300 98.31 17.16 521.40 28.65 耐药指数 8.09 143 3.85 0.90 CCRF-CEM <1 <1 − 30.23 CCRF-CEM/VLB100 159.3 684.4 − 51.77 耐药指数 >159.3 >684.4 − 1.71 注:“−”表示未检测。 -
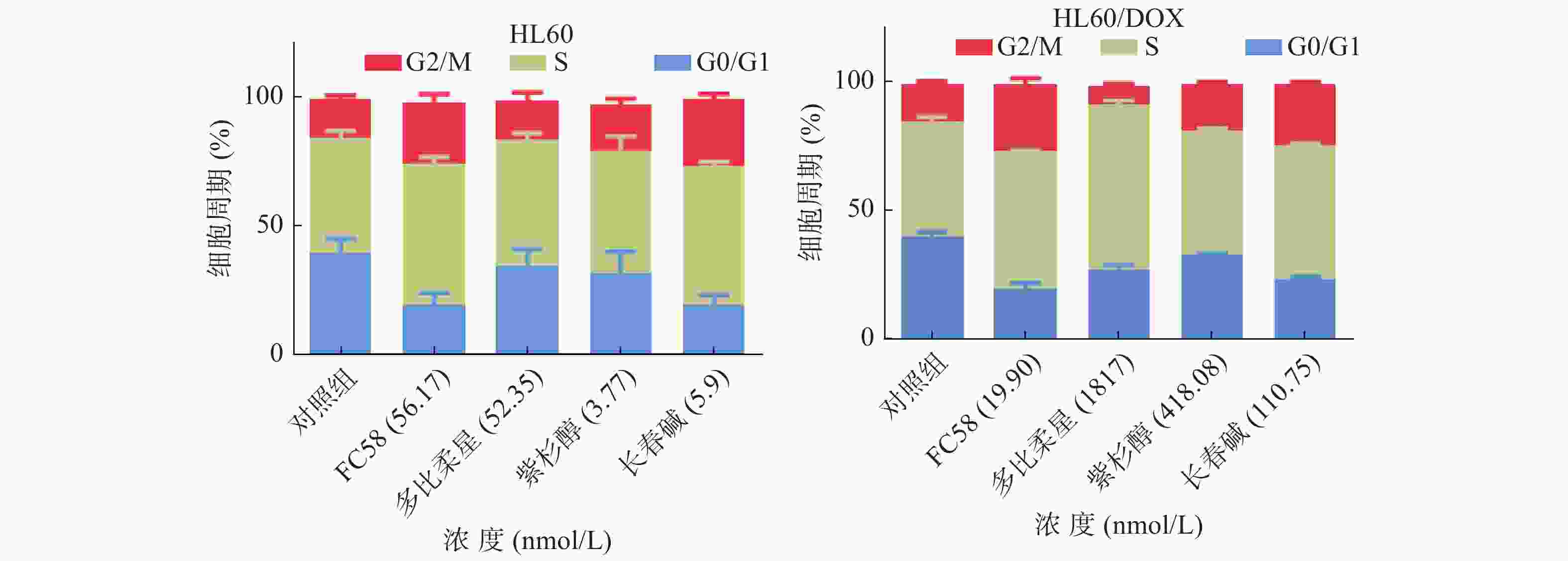
微管蛋白抑制剂可干扰微管蛋白-微管之间的平衡,阻断有丝分裂M期纺锤体的形成,导致有丝分裂停滞于G2/M期,从而诱导细胞凋亡[25]。利用流式细胞技术检测FC58、多柔比星、紫杉醇和长春碱对HL60和HL60/DOX细胞周期的影响,考察其作用机制。
如图3所示,与空白组相比,经1.3倍IC50 FC58处理的组,停滞在G2/M期的细胞明显增多。其作用强于紫杉醇,弱于长春碱。经多柔比星处理的组,停滞在S期和G2/M期的细胞较空白组有一定程度的增多。FC58、紫杉醇和长春碱的耐药细胞组的结果与非耐药细胞组结果基本相同。经FC58处理的组,停滞在G2/M期的细胞明显增多,且作用强于其余药物。多柔比星使细胞周期停滞在S期的耐药细胞明显增多。上述结果提示,FC58的作用靶点为微管蛋白。同时,FC58对细胞周期的影响结果与长春碱较相似,间接证明了FC58和长春碱作用机制相似。这可能是FC58对CCRF-CEM/VLB100细胞轻微耐药的原因。
-
吲哚查尔酮类衍生物FC58对多种白血病细胞均有较强活性,GI50达纳摩尔级。对耐药的白血病细胞同样具有较强的活性,比亲代白血病细胞更为敏感,活性抗耐药指数远强于紫杉醇、长春碱和多柔比星。FC58和其他微管蛋白抑制剂一样都能使细胞周期停滞在G2/M期,间接验证其作用靶点为微管蛋白。FC58作为一个潜在的抗耐药白血病的先导化合物,有必要进一步研究其体内的抗肿瘤活性。
Cytotoxicity study on FC58, an indole-chalcone, against multi-drug resistant leukemia cells
-
摘要:
目的 合成吲哚查尔酮衍生物FC58,考察其对白血病细胞的抑制活性。 方法 以3,4,5-三甲氧基苯乙酮和吲哚-3-甲醛为原料,经羟醛缩合得到目标化合物。采用CellTiter-Blue法测试体外抗肿瘤活性,并通过细胞周期实验分析其作用特点。 结果 FC58对多种白血病细胞均有较强活性,活性抗耐药指数远高于传统微管蛋白抑制剂紫杉醇、长春碱和多柔比星,并使细胞周期停滞在G2/M期。 结论 FC58是一个极具潜力的抗耐药白血病的先导化合物。 Abstract:Objective To synthesize and investigate cytotoxicity of an indole-chalcone derivative FC58. Methods The target compound was synthesized through the Aldol condensation with 1-(3,4,5-trimethoxyphenyl)ethan-1-one and 1H-indole-3-carbaldehyde. The Cell Titer-Blue method was used to determine in vitro cytotoxicity. The cell cycle experiment was performed to analyze the action characteristics of FC58. Results FC58 exhibited high cytotoxicity against various leukemia cells and resulted in G2/M phase arrest. It showed stronger drug resistant index than traditional tubulin inhibitors such as paclitaxel, vinblastine and doxorubicin. Conclusion FC58 represents a promising lead compound for multi-drug resistant leukemia. -
Key words:
- indole-chalcone /
- anti-leukemia /
- multi-drug resistance /
- cytotoxicity /
- tubulin
-
表 1 几种化合物的体外抗肿瘤活性的比较(
${\rm{GI}}_{50},\; {\rm{nmol/L}} $ )细胞系 化合物 紫杉醇 长春碱 多比柔星 FC58 HL60 6.68 2.90 40.27 44.20 HL60/DOX 292.50 89.52 1398 17.56 耐药指数 43.79 30.87 34.72 0.40 K562 12.15 0.12 135.30 31.72 K562/HHT300 98.31 17.16 521.40 28.65 耐药指数 8.09 143 3.85 0.90 CCRF-CEM <1 <1 − 30.23 CCRF-CEM/VLB100 159.3 684.4 − 51.77 耐药指数 >159.3 >684.4 − 1.71 注:“−”表示未检测。 -
[1] FERLAY J, SOERJOMATARAM I, DIKSHIT R, et al. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012[J]. Int J Cancer,2015,136(5):E359-E386. doi: 10.1002/ijc.29210 [2] BRAY F, FERLAY J, SOERJOMATARAM I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA: A Cancer J Clin,2018,68(6):394-424. doi: 10.3322/caac.21492 [3] FERLAY J, COLOMBET M, SOERJOMATARAM I, et al. Estimating the global cancer incidence and mortality in 2018: GLOBOCAN sources and methods[J]. Int J Cancer,2019,144(8):1941-1953. doi: 10.1002/ijc.31937 [4] SIEGEL R L, MILLER K D, JEMAL A. Cancer statistics, 2016[J]. CA: A Cancer J Clin,2016,66(1):7-30. doi: 10.3322/caac.21332 [5] ALY H A. Cancer therapy and vaccination[J]. J Immunol Methods,2012,382(1-2):1-23. doi: 10.1016/j.jim.2012.05.014 [6] LONGLEY D B, ALLEN W L, JOHNSTON P G. Drug resistance, predictive markers and pharmacogenomics in colorectal cancer[J]. Biochim Biophys Acta,2006,1766(2):184-196. [7] TEICHER B A. Newer cytotoxic agents: attacking cancer broadly[J]. Clin Cancer Res,2008,14(6):1610-1617. doi: 10.1158/1078-0432.CCR-07-2249 [8] 刁磊, 刘明一, 鲍岚. 微管蛋白亚型及其功能[J]. 中国细胞生物学学报, 2019, 41(3):322-332. [9] NOGALES E. Structural insights into microtubule function[J]. Annu Rev Biochem,2000,69:277-302. doi: 10.1146/annurev.biochem.69.1.277 [10] WITTMANN T, HYMAN A, DESAI A. The spindle: a dynamic assembly of microtubules and motors[J]. Nat Cell Biol,2001,3(1):E28-E34. doi: 10.1038/35050669 [11] NEWTON C N, WAGENBACH M, OVECHKINA Y, et al. MCAK, a Kin I kinesin, increases the catastrophe frequency of steady-state HeLa cell microtubules in an ATP-dependent manner in vitro[J]. FEBS Lett,2004,572(1-3):80-84. doi: 10.1016/j.febslet.2004.06.093 [12] SOBIERAJSKA K, GŁOS J, DĄBOROWSKA J, et al. Visualization of the interaction between Gβγ and tubulin during light-induced cell elongation of Blepharisma japonicum[J]. Photochem Photobiol Sci,2010,9(8):1101. doi: 10.1039/c0pp00031k [13] PORTRAN D, ZOCCOLER M, GAILLARD J, et al. MAP65/Ase1 promote microtubule flexibility[J]. Mol Biol Cell,2013,24(12):1964-1973. doi: 10.1091/mbc.e13-03-0141 [14] KAVALLARIS M, ANNEREAU J P, BARRET J M. Potential mechanisms of resistance to microtubule inhibitors[J]. Semin Oncol,2008,35(3 suppl 3):S22-S27. [15] KAVALLARIS M. Microtubules and resistance to tubulin-binding agents[J]. Nat Rev Cancer,2010,10(3):194-204. doi: 10.1038/nrc2803 [16] SINGH P, ANAND A, KUMAR V. Recent developments in biological activities of chalcones: a mini review[J]. Eur J Med Chem,2014,85:758-777. doi: 10.1016/j.ejmech.2014.08.033 [17] BATOVSKA D I, TODOROVA I T. Trends in utilization of the pharmacological potential of chalcones[J]. Curr Clin Pharmacol,2010,5(1):1-29. doi: 10.2174/157488410790410579 [18] SAHU N K, BALBHADRA S S, CHOUDHARY J, et al. Exploring pharmacological significance of chalcone scaffold: a review[J]. Curr Med Chem,2012,19(2):209-225. doi: 10.2174/092986712803414132 [19] ZHUANG C L, ZHANG W, SHENG C Q, et al. Chalcone: a privileged structure in medicinal chemistry[J]. Chem Rev,2017,117(12):7762-7810. doi: 10.1021/acs.chemrev.7b00020 [20] ZHOU B, YU X, ZHUANG C, et al. Unambiguous identification of β-tubulin as the direct cellular target responsible for the cytotoxicity of chalcone by photoaffinity labeling[J]. ChemMedChem,2016,11(13):1436-1445. doi: 10.1002/cmdc.201600150 [21] HU T, LI Z, GAO C Y, et al. Mechanisms of drug resistance in colon cancer and its therapeutic strategies[J]. World J Gastroenterol,2016,22(30):6876-6889. doi: 10.3748/wjg.v22.i30.6876 [22] GAN P P, MCCARROLL J A, PO'UHA S T, et al. Microtubule dynamics, mitotic arrest, and apoptosis: drug-induced differential effects of betaIII-tubulin[J]. Mol Cancer Ther,2010,9(5):1339-1348. doi: 10.1158/1535-7163.MCT-09-0679 [23] CONG H, ZHAO X, CASTLE B T, et al. An indole-chalcone inhibits multidrug-resistant cancer cell growth by targeting microtubules[J]. Mol Pharm,2018,15(9):3892-3900. doi: 10.1021/acs.molpharmaceut.8b00359 [24] LI J, WU Y, GUO Z, et al. Discovery of 1-arylpyrrolidone derivatives as potent p53-MDM2 inhibitors based on molecule fusing strategy[J]. Bioorg Med Chem Lett,2014,24(12):2648-2650. doi: 10.1016/j.bmcl.2014.04.063 [25] NEGI A S, GAUTAM Y, ALAM S, et al. Natural antitubulin agents: Importance of 3,4,5-trimethoxyphenyl fragment[J]. Bioorg Med Chem,2015,23(3):373-389. doi: 10.1016/j.bmc.2014.12.027 -





 下载:
下载: