-
放射性核素是指不稳定原子核自发地放出射线通过衰变形成稳定的核素,能够通过皮肤伤口、呼吸道及消化道吸收进入体内,增加了肿瘤、畸变、遗传性病变发生率,严重影响人体健康。放射性材料在诸如核工业、能源生产、研究和开发以及医学等各种领域中的使用越来越多,而产生的放射性废物对人类具有严重危害。自2011年福岛第一核电站事故以来,公众对长期暴露于该核电站释放辐射造成的健康一直高度关注[1]。因此,如何进行核辐射的有效防护一直是研究难点和重点。
有效清除放射性核素的常用手段包括螯合剂或吸附剂,其中多糖是近年发展起来的具有优良吸附作用的分子。多糖(polysaccharide)是由糖苷键结合的糖链,是至少超过10个单糖组成的聚合糖,也是高分子碳水化合物。其中天然多糖,如海藻酸盐、壳聚糖、纤维素等,分子链上具有多种官能团,通过物理和化学相互作用与多种分子结合,也可以通过共混、接枝或与具有额外官能团的各种纳米材料混合的形式引入额外的功能基团,从而增强其吸附能力。多糖的吸附性能不仅与吸附剂上特定官能团的类型和数量有关,还受吸附剂比表面积和吸附位点暴露程度的影响。
本综述概括了主要放射性核素类型及其对人体的危害,总结了多糖在放射性核素清除方面的最新研究进展。多糖作为核战争、核事故等突发核事件中放射性核素有效吸附分子,应用前景广阔。
-
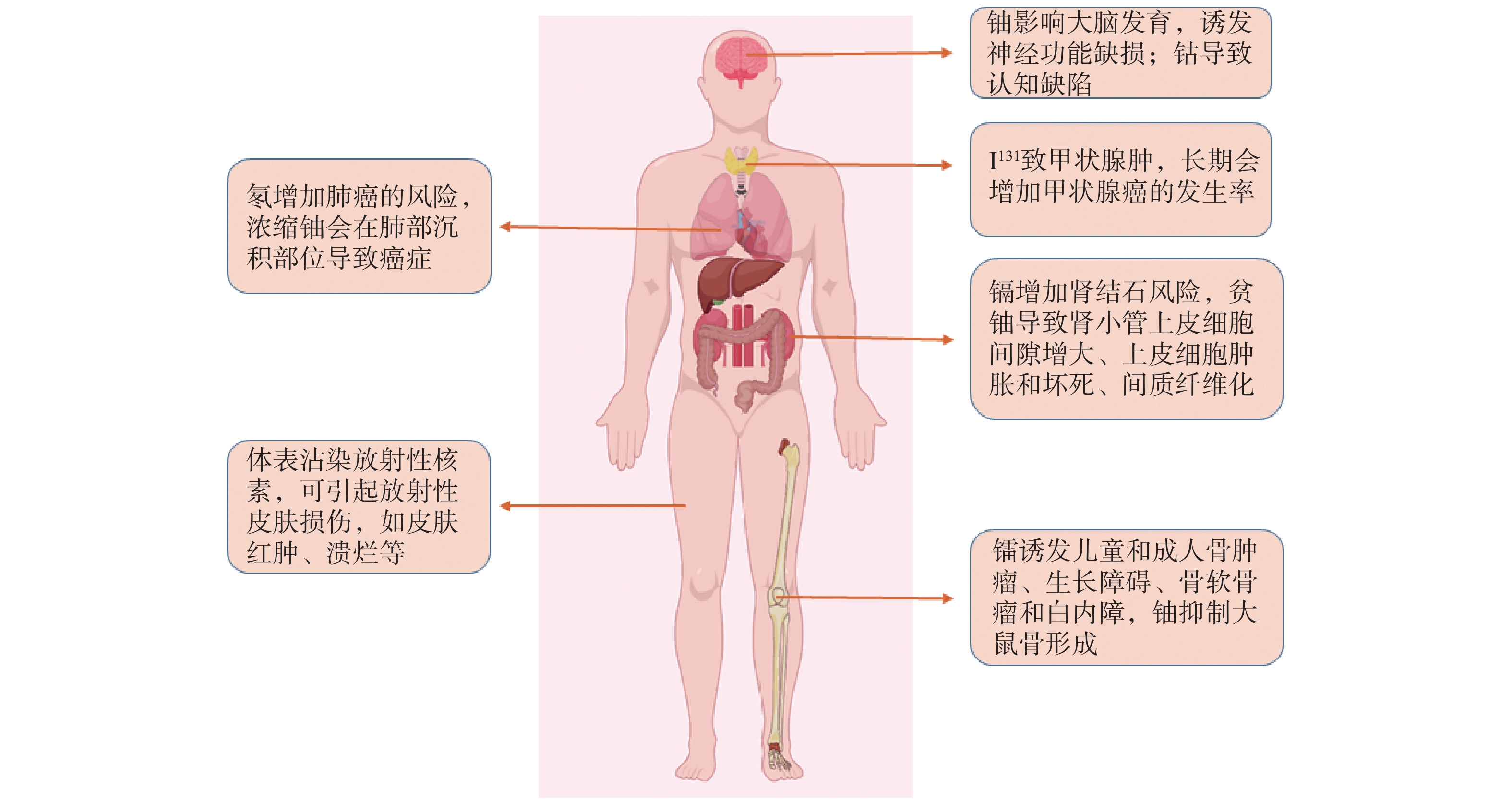
铀是一种重金属放射性核素,可作为核反应燃料。肾、肝、肺、脑、中枢神经是铀毒性累积的靶向组织[2]。铀污染会诱发行为障碍,影响神经化学和神经生理特性,还会导致肾小管上皮细胞间隙增大、上皮细胞肿胀和坏死、间质纤维化,引起尿素氮和血肌酐升高。在长期接触贫铀的情况下,易发生免疫毒性、胚胎毒性和肝毒性,罹患肿瘤风险增加[3]。
-
镉半衰期长达10~30年,不易被生物清除,从而导致其易在生物体内累积[4]。镉暴露可破坏中枢神经系统功能,对另一靶器官肾的主要损伤部位是近端小管,可导致线粒体电子传递链功能障碍和活性氧产生[5]。在单一暴露分析中,单独暴露于镉会显著增加患肾结石的风险,尿镉、钴与肾结石的风险呈正相关,此关联在老年人中尤为显著[6]。对于肥胖、高脂血症、代谢综合征等慢性病患者,镉暴露会进一步增加慢性肾病和肾衰竭风险[7]。
-
在切尔诺贝利事故患者中出现的几种心血管损伤可能与钴暴露有关。钴暴露引起的心肌小病灶损伤和血流动力学变化可能会导致心律和血管紧张度紊乱[8]。钴还可能对神经系统造成影响,钴接触工人表现出与注意力和语言记忆困难有关的明显认知缺陷,还会增加精神类疾病和视力下降风险[9, 10]。
-
氡是一种比空气重、具有放射性的气体,是镭衰变的结果。氡主要通过吸入进入人体,且氡衍生物是引发肺癌的第二危险因素,仅次于吸烟[11]。2010年室内氡暴露导致的肺癌死亡人数占韩国肺癌死亡总数的12.5%~24.7%[12];2012年,66个国家因氡导致的肺癌死亡总数为226 057例[13]。欧洲和北美地下矿井工人由于长期接触氡气,肿瘤发病率大幅增加,其中以肺癌风险最高[14]。
-
镭的所有同位素都具有强烈的放射性,易诱发儿童和成人的骨肿瘤、生长障碍、骨软骨瘤和白内障等。镭与儿童恶性骨肿瘤发病率密切相关,年龄越小,影响越严重[15]。
-
碘主要供给甲状腺激素合成。I131半衰期较长,大剂量I131会导致甲状腺肿大,甲状腺结节或萎缩,最终导致甲状腺癌发生率增加,且I131导致的甲状腺机能亢进患者中,60%会出现房颤现象[16]。
-
放射性核素清除最常使用的螯合剂是二乙基三胺五乙酸(DTPA),但由于其选择性差,易与体内 Ca2+、Zn2+等有益金属离子发生配位反应,导致肾毒性、致畸性、胚胎毒性等多种副作用,目前已很少应用[17]。多糖多为天然来源,不仅能通过吸附清除放射性核素,还具有安全性好、生物相容性、清除率高等优点,是极具潜力的放射性核素清除剂。可用于有效清除放射性核素的多糖包括以下几种。
-
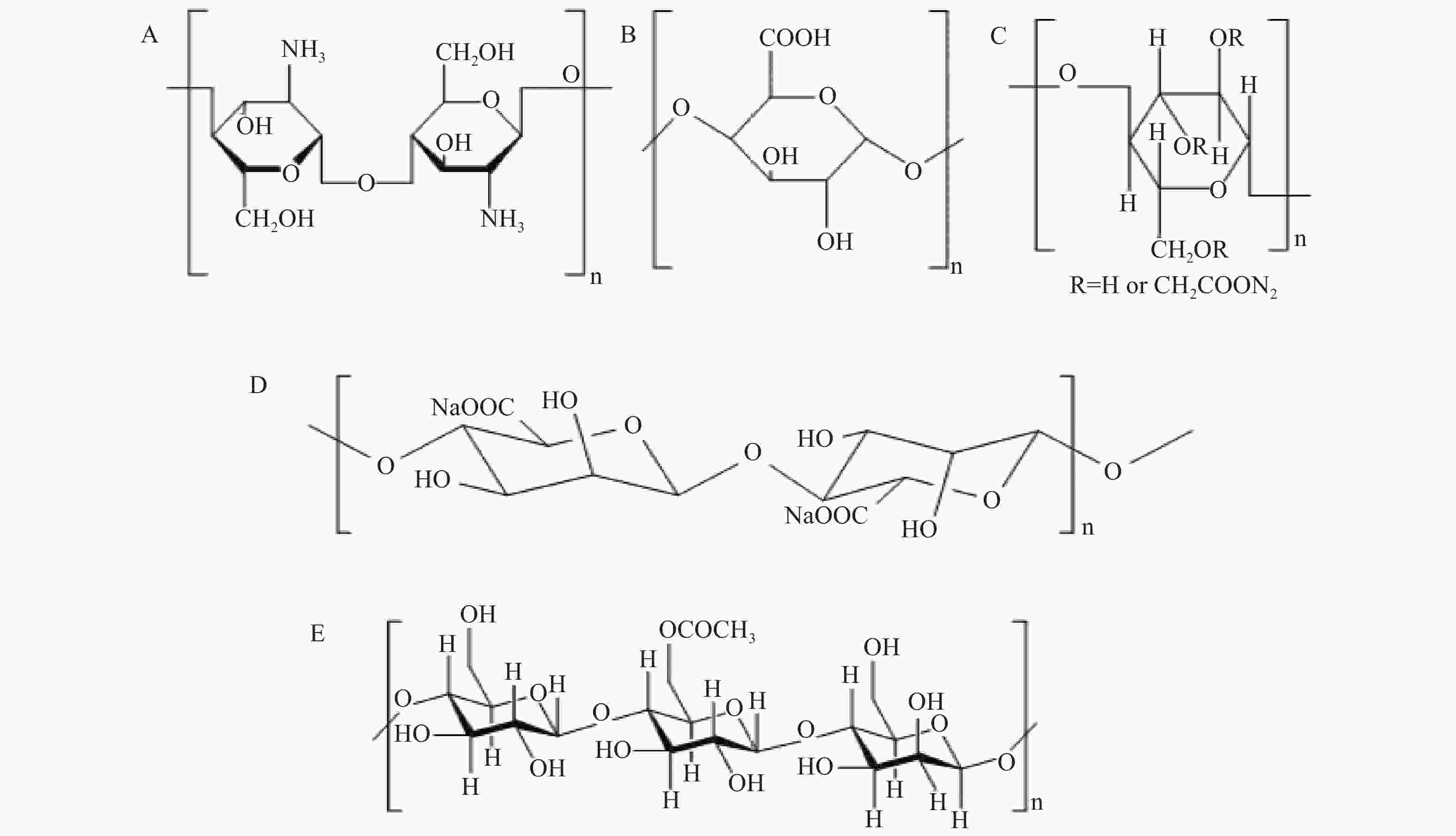
壳聚糖来源于甲壳质的脱乙酰化,由于分子内和分子间氢键的存在,使其具有规则的线性分子链和良好的结晶性能。壳聚糖还具有价廉、资源丰富、吸附能力强、可再生、抗拉强度高、生物降解性和抗菌性能好等优点,被认为是绿色吸附剂[18](图2A)。壳聚糖吸附机制可能包括配位作用、阳离子交换和静电吸附,壳聚糖的羟基团和氨基团还能与铯形成稳定配位键。影响壳聚糖吸附效果的因素主要为pH、温度和吸附时间等。当pH>2时,壳聚糖吸附效率随pH升高而提高;除铜在pH=8时吸附效率最高之外,壳聚糖对铯、铕、铜在pH=8时达到最大吸附效率。在弱酸性条件下吸附效率高可能是因为低浓度H+和H3O+降低了与阳离子壳聚糖的竞争,增加了壳聚糖的吸附位点。
壳聚糖可通过制备成凝胶、静电纺丝、微球等剂型来吸附核素。目前大多数壳聚糖吸附剂呈颗粒状,不利于官能团的暴露,减少了吸附位点,降低了吸附效率。通过制备成微球、无定形粉末、纤维等剂型,可大大增加表面积、暴露更多吸附位点以提高吸附性能。采用湿法纺丝制备的均匀纤维状壳聚糖吸附剂,比颗粒状壳聚糖具有吸附容量高、吸附速率快、比表面积大、机械强度优良等优点,纤维状壳聚糖对Co2+的吸附效率为4.3 mg/g,明显高于颗粒状壳聚糖(2.3 mg/g)[19]。
壳聚糖的实际应用受制于其酸性降解和热稳定性差、机械强度低、比表面积低等缺点,通过化学修饰可克服上述缺点,拓宽其实用价值。羧甲基壳聚糖是壳聚糖经羧甲基化后得到的一种线形水溶性高分子,因分子内含有大量的乙二胺四乙酸式结构而对金属离子具有很好的螯合吸附性能。与壳聚糖水凝胶相比,羧甲基壳聚糖超分子水凝胶在保湿能力、水溶性、生物降解性、生物相容性、抗氧化活性、抗菌性能等方面表现出更明显的优势。同时由于其具有更多的螯合基团,结合其本身吸附能力,因此对放射性核素清除效率更高[20]。壳聚糖与DTPA联用形成的纳米粒对吸入不溶性贫铀粒子具有明显吸附作用;结合肺灌洗,壳聚糖还能帮助DTPA进入细胞内,提高肺组织中贫铀的清除率[21]。
-
海藻酸盐由1,4-β-D-甘露糖醛酸和α-L-古洛糖醛酸组成(图2D),它可与二价、三价阳离子配位,是一种无毒、可生物降解的低成本天然多糖[22]。
海藻酸盐吸附核素离子有两种方式:物理吸附和化学吸附。物理吸附主要基于静电吸附;化学吸附则分为两种:一种是阳离子之间的离子交换,另一种是核素与海藻酸盐的羟基和羧基产生配位反应,形成配位物[23]。海藻酸盐的吸附效率显著受pH变化的影响。由于其含有大量的羧基和羟基官能团,在低pH溶液中,吸附位点逐渐被质子化,这会导致官能团的螯合作用减弱,并且离子之间产生的静电斥力进一步降低了吸附能力[24-25]。海藻酸盐吸附还依赖温度变化,温度通过影响海藻酸盐表面化学结构来控制吸附。由于吸附过程是吸热过程,适当提高温度可提高吸附容量;但高温也会导致孔径变大,从而使脱吸附率比吸附率高,降低吸附效率[26]。
海藻酸盐可与其他螯合剂联用发挥清除作用。聚丙烯酰胺、海藻酸钠和二乙烯三胺五乙酸混合后制备水凝胶,可有效清除小鼠皮肤创面的放射性锶,并能有效阻止放射性锶通过皮肤创面的吸收。此外,水凝胶剂型还可有效促进放射性核素污染伤口中的肉芽组织形成,促进创面愈合[27]。
不同多糖联用,可通过不同机制协同发挥核素清除作用,提高清除效率。如将海藻酸盐与浒苔多糖复合,为海藻酸钠凝胶引入了更多的活性吸附位点,提高了对重金属的吸附效率[28]。
-
纤维素经羧甲基化后可得到羧甲基纤维素(CMC)(图2C),其结构中含有丰富的羟基和羧基,被称为超吸附材料。同时CMC具有亲水性、生物黏附性、pH敏感性等优点,常用于药物递送和其他生物医学研究[29]。
载普鲁士蓝羧甲基纤维素大孔纳米纤维膜能有效吸附铯,这主要是由于羧甲基纤维素钠纳米纤维膜具有表面积大和高度多孔的结构,增加了吸附位点,提高了吸附容量[30]。通过植酸改性的CMC对137Cs具有特异吸附性,且能大大提高137Cs吸附速率[31]。在Cu(Ⅱ)离子交联法制备的羧甲基纤维素水凝胶中引入聚乙二醇6 000以增加水凝胶羟基数量。该水凝胶在吸水溶胀后,其内部孔隙和表面积显著增加,从而暴露了更多吸附位点,提高了整体吸附效果[32]。羧甲基纤维素钠温敏水凝胶可实现低温吸附、高温脱吸附,其吸附UO22+的主要机制是含氧基团和U(Ⅵ)之间能形成复合物[33]。
-
葡甘聚糖主要来源于自然界广泛存在的魔芋,因此又称为魔芋葡甘聚糖(KGM)。KGM具有良好的持水能力、稳定性、成膜性、增稠性、乳化性等。KGM主链的化学结构是由D-葡萄糖和D-甘露糖缩合形成的共聚物,具有丰富的羧基和羟基[34]。魔芋葡甘聚糖通过羧甲基化可得到羧甲基魔芋葡甘聚糖,能获得更大的吸附容量。其吸附过程主要是通过离子交换和吸附剂表面羟基的配位完成,是一个吸热和自发的过程。KGM带有负电荷,能通过静电作用和氢键提高吸附力;引入结冷胶后,能形成双网络凝胶微球,该凝胶微球具有极高的机械强度,在强酸条件下仍稳定性良好,对铀的最大吸附容量可达到98.10 mg/g[35]。一氯乙酸改性魔芋葡甘聚糖可吸附重金属离子,且羧甲基取代度越高,越有利于吸附。羧甲基魔芋葡甘聚糖可重复使用,且不会明显改变其吸附容量[36]。
-
果胶是一种天然多糖,也可作为可溶性膳食纤维。果胶聚合物链主要通过1,4-α-半乳糖醛酸单元构成。果胶吸附核素主要通过其结构中的羟基,酯化度较低的果胶具有较强的吸附能力。儿童服用果胶后放射性铯含量降低了33%,也可显著降低对铀的吸收[37]。
将果胶和普鲁士蓝制备成珠状杂化吸附剂,可有效吸附铯,其吸附容量可达(36.5±0.8)mg/g,该杂化吸附剂具有明显协同作用,吸附效率显著高于预期。可能普鲁士蓝粉末的存在改变了果胶结构,增加了吸附位点的暴露,使更多铯离子能被捕获和吸附[38]。
多糖清除核素的机制是主要通过其结构中的羟基和羧基等基团与核素发生配位、阳离子交换和静电吸附等作用。除上述多糖之外,甲壳素、木薯淀粉等通过静电作用或螯合作用也可发生吸附,但因其溶解性差、弱机械性能而限制了应用[39, 40]。
-
核技术在军事、医学等领域的广泛应用,给人们带来便捷的同时,也增加了核辐射暴露的风险。尤其是近期福岛核电站废水的排放更是给我国生态环境、人民健康带来了巨大的安全隐患和挑战。目前,放射性核素清除面临着品种少、清除效率低、副作用大等问题,对螯合剂、吸附剂、促排剂等的深入广泛研究将为清除放射性核素提供更高效、安全的方案。多糖具有安全、生物相容性好、吸附效率高等优势,将其与凝胶、纳米粒、纳米纤维、多孔微球等剂型有机结合,将进一步提高放射性核素吸附效率,为核战争、核事故等紧急条件下高效、安全清除核素提供新策略。
Progress on elimination of radioactive nuclides by polysaccharides
-
摘要: 放射性核素可通过皮肤、呼吸道及消化道等途径进入人体,危害人体健康。有效清除手段主要为螯合剂与吸附剂,但传统螯合剂具有肾毒性、致畸性、胚胎毒性等副作用。多糖作为一种新型放射性核素吸附剂,具有安全性好、生物相容性好、清除率高等优点。本文概括了主要放射性核素类型及其对人体的危害、多糖在放射性核素清除方面的最新研究进展。多糖作为核战争、核事故等突发核事件中放射性核素的有效吸附分子,应用前景广阔。Abstract: Radionuclides can be hazardous by absorbed through the skin, respiratory and digestive tracts. Chelating agents and adsorbents already could effectively remove them, however traditional chelators have side effects such as nephrotoxicity, teratogenicity, and embryotoxicity. As a new type of nuclide adsorbent, polysaccharide has the advantages of safety, biocompatibility, and high clearance rate. In this paper, the main types and perniciousness of radionuclides, and the latest research of polysaccharides in radionuclide removal were summarized. The application of polysaccharide as an effective adsorption molecule for radio nuclides in nuclear wars, nuclear accidents and other sudden nuclear events is promising.
-
Key words:
- polysaccharides /
- radioactive nuclide /
- chelating agent /
- adsorption agent
-
[1] LOH S L, AMIR S. Healing Fukushima: Radiation hazards and disaster medicine in post-3.11 Japan[J]. Soc Stud Sci, 2019, 49(3):333-354. doi: 10.1177/0306312719854540 [2] MA M H, WANG R X, XU L N, et al. Emerging health risks and underlying toxicological mechanisms of uranium contamination: Lessons from the past two decades[J]. Environ Int, 2020, 145:106107. doi: 10.1016/j.envint.2020.106107 [3] LEGRAND M, LAM S, ANSELME I, et al. Exposure to depleted uranium during development affects neuronal differentiation in the hippocampal dentate gyrus and induces depressive-like behavior in offspring[J]. Neurotoxicology, 2016, 57:153-162. doi: 10.1016/j.neuro.2016.09.006 [4] XIA F, LI Q W, LUO X, et al. Identification for heavy metals exposure on osteoarthritis among aging people and Machine learning for prediction: a study based on NHANES 2011-2020[J]. Front Public Health, 2022, 10:906774. doi: 10.3389/fpubh.2022.906774 [5] YAN L J, ALLEN D C. Cadmium-induced kidney injury: oxidative damage as a unifying mechanism[J]. Biomolecules, 2021, 11(11):1575. doi: 10.3390/biom11111575 [6] ZHAO H, FANG L L, CHEN Y T, et al. Associations of exposure to heavy metal mixtures with kidney stone among U. S. adults: a cross-sectional study[J]. Environ Sci Pollut Res Int, 2023, 30(42):96591-96603. doi: 10.1007/s11356-023-29318-7 [7] DHONDUP T, KITTANAMONGKOLCHAI W, VAUGHAN L E, et al. Risk of ESRD and mortality in kidney and bladder stone formers[J]. Am J Kidney Dis, 2018, 72(6):790-797. doi: 10.1053/j.ajkd.2018.06.012 [8] GILMORE B J, CRANLEY K. Radionuclide monitoring in Northern Ireland of the Chernobyl nuclear reactor accident[J]. Ulster Med J, 1987, 56(1):45-53. [9] JORDAN C, WHITMAN R D, HARBUT M, et al. Memory deficits in workers suffering from hard metal disease[J]. Toxicol Lett, 1990, 54(2-3):241-243. doi: 10.1016/0378-4274(90)90190-W [10] MEECHAM H M, HUMPHREY P. Industrial exposure to cobalt causing optic atrophy and nerve deafness: a case report[J]. J Neurol Neurosurg Psychiatry, 1991, 54(4):374-375. doi: 10.1136/jnnp.54.4.374 [11] KIM S H, HWANG W J, CHO J S, et al. Attributable risk of lung cancer deaths due to indoor radon exposure[J]. Ann Occup Environ Med, 2016, 28:8. doi: 10.1186/s40557-016-0093-4 [12] KIM S H, KOH S B, LEE C M, et al. Indoor radon and lung cancer: estimation of attributable risk, disease burden, and effects of mitigation[J]. Yonsei Med J, 2018, 59(9):1123-1130. doi: 10.3349/ymj.2018.59.9.1123 [13] GASKIN J, COYLE D, WHYTE J, et al. Global estimate of lung cancer mortality attributable to residential radon[J]. Environ Health Perspect, 2018, 126(5):057009. doi: 10.1289/EHP2503 [14] AGIUS R, BATISTATOU E, GITTINS M, et al. An epidemiological study of lung cancer and selected other cancers among Namibian uranium workers[J]. Radiat Res, 2023, 200(4):340-348. [15] SPIESS H. Life-span study on late effects of 224Ra in children and adults[J]. Health Phys, 2010, 99(3):286-291. doi: 10.1097/HP.0b013e3181cb857f [16] INOUE K, GUO R, LEE M L, et al. Iodine-induced hyperthyroidism and long-term risks of incident atrial fibrillation and flutter[J]. J Clin Endocrinol Metab, 2023, 108(10):e956-e962. doi: 10.1210/clinem/dgad250 [17] YUE Y C, LI M H, WANG H B, et al. The toxicological mechanisms and detoxification of depleted uranium exposure[J]. Environ Health Prev Med, 2018, 23(1):18. doi: 10.1186/s12199-018-0706-3 [18] SANLIER S H, AK G, YILMAZ H, et al. Removal of textile dye, direct red 23, with glutaraldehyde cross-linked magnetic chitosan beads[J]. Prep Biochem Biotechnol, 2013, 43(2):163-176. doi: 10.1080/10826068.2012.712937 [19] ZHUANG S T, ZHU K K, XU L J, et al. Adsorption of Co2+ and Sr2+ in aqueous solution by a novel fibrous chitosan biosorbent[J]. Sci Total Environ, 2022, 825:153998. doi: 10.1016/j.scitotenv.2022.153998 [20] Chen S C, Wu Y C, Mi F L, et al. A novel ph-sensitive hydrogel composed of n, ocarboxymethyl chitosan and alginate cross-linked by genipin for protein drug delivery[J]. Journal of Controlled Release, 2004, 96:285-300. doi: 10.1016/j.jconrel.2004.02.002 [21] XIAO Y, ZENG F, FU W L, et al. Effects of a modified chitosan compound combined with lung lavage after inhalation of depleted uranium dust[J]. Health Phys, 2022, 122(6):663-672. doi: 10.1097/HP.0000000000001557 [22] LIANG L M, LIU T, OUYANG Q Q, et al. Solid phase synthesis of oxidized sodium alginate-tobramycin conjugate and its application for infected wound healing[J]. Carbohydr Polym, 2022, 295:119843. doi: 10.1016/j.carbpol.2022.119843 [23] Wen S, Wang H, Xin Q, et al. Selective adsorption of uranium (vi) from wastewater using a uio-66/calcium alginate/hydrothermal carbon composite material [J]. Carbohydrate Polymers, 2023, 315. [24] REN H X, GAO Z M, WU D J, et al. Efficient Pb(II)removal using sodium alginate-carboxymethyl cellulose gel beads: Preparation, characterization, and adsorption mechanism[J]. Carbohydr Polym, 2016, 137:402-409. doi: 10.1016/j.carbpol.2015.11.002 [25] NAN Y, WANG J L, CHANG X, et al. Functionalized graphene oxide/sodium alginate beads with ion responsiveness for uranium trapping[J]. Carbohydr Polym, 2023, 300:120259. doi: 10.1016/j.carbpol.2022.120259 [26] WEN S Q, WANG H Q, XIN Q, et al. Selective adsorption of uranium(VI)from wastewater using a UiO-66/calcium alginate/hydrothermal carbon composite material[J]. Carbohydr Polym, 2023, 315:120970. doi: 10.1016/j.carbpol.2023.120970 [27] CUI F M, WU Z J, ZHAO R, et al. Development and characterization of a novel hydrogel for the decontaminating of radionuclide-contaminated skin wounds[J]. Macromol Biosci, 2021, 21(5):e2000399. doi: 10.1002/mabi.202000399 [28] 张欢, 海藻酸钠复合微球的制备及其对废水中重金属的去除研究[D]. 吉林: 吉林农业大学, 2023. [29] JAVANBAKHT S, SHAABANI A. Carboxymethyl cellulose-based oral delivery systems[J]. Int J Biol Macromol, 2019, 133:21-29. doi: 10.1016/j.ijbiomac.2019.04.079 [30] EUN S, HONG H J, KIM H, et al. Prussian blue-embedded carboxymethyl cellulose nanofibril membranes for removing radioactive cesium from aqueous solution[J]. Carbohydr Polym, 2020, 235:115984. doi: 10.1016/j.carbpol.2020.115984 [31] PENG Q H, JIN T X, WANG C S, et al. Phytic acid-modified carboxymethyl cellulose hydrogel for uranium adsorption from aqueous solutions[J]. Int J Biol Macromol, 2024, 256(Pt 2): 128545. [32] 韩珊珊, 陈元涛, 张炜. , Cu(Ⅱ)交联羧甲基纤维素水凝胶制备及对铀的吸附[J]. 环境科学学报, 2024, 44:83-94. [33] TAN J, XIE S B, WANG G H, et al. Fabrication and optimization of the Thermo-sensitive hydrogel carboxymethyl Cellulose/Poly (N-isopropylacrylamide-co-acrylic acid) for u (vi) removal from aqueous solution[J]. Polymers, 2020, 12(1):151. doi: 10.3390/polym12010151 [34] XIAO J X, WANG L H, XU T C, et al. Complex coacervation of carboxymethyl konjac glucomannan and chitosan and coacervate characterization[J]. Int J Biol Macromol, 2019, 123:436-445. doi: 10.1016/j.ijbiomac.2018.11.086 [35] LIANG L L, LIN X Y, LIU Y F, et al. Carboxymethyl konjac glucomannan mechanically reinforcing gellan gum microspheres for uranium removal[J]. Int J Biol Macromol, 2020, 145:535-546. doi: 10.1016/j.ijbiomac.2019.12.188 [36] NIU C M, WU W H, WANG Z, et al. Adsorption of heavy metal ions from aqueous solution by crosslinked carboxymethyl konjac glucomannan[J]. J Hazard Mater, 2007, 141(1):209-214. doi: 10.1016/j.jhazmat.2006.06.114 [37] ELIAZ I, WEIL E, SCHWARZBACH J, et al. Modified Citrus pectin/alginate dietary supplement increased fecal excretion of uranium: a family[J]. Altern Ther Health Med, 2019, 25(4):20-24. [38] BOK-BADURA J, JAKÓBIK-KOLON A, KAZEK-KĘSIK A, et al. Hybrid pectin-based sorbents for cesium ion removal[J]. Materials, 2020, 13(9):2160. doi: 10.3390/ma13092160 [39] DOU D T, WEI D L, GUAN X, et al. Adsorption of copper (II) and cadmium (II) ions by in situ doped nano-calcium carbonate high-intensity chitin hydrogels[J]. J Hazard Mater, 2022, 423(Pt B): 127137. [40] OGATA F, NAGAI N, UETA E, et al. Biomass potential of virgin and calcined tapioca (cassava starch) for the removal of Sr(II) and Cs(I) from aqueous solutions[J]. Chem Pharm Bull, 2018, 66(3):295-302. doi: 10.1248/cpb.c17-00873 -




 下载:
下载: