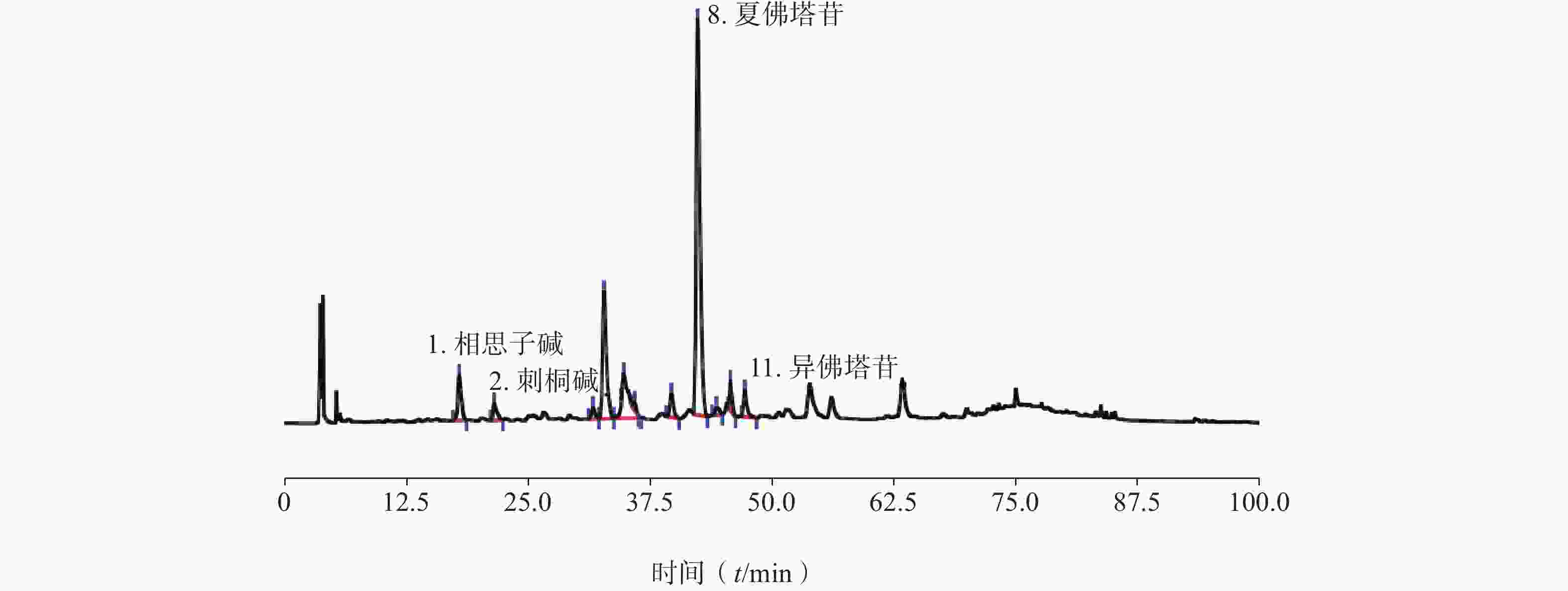
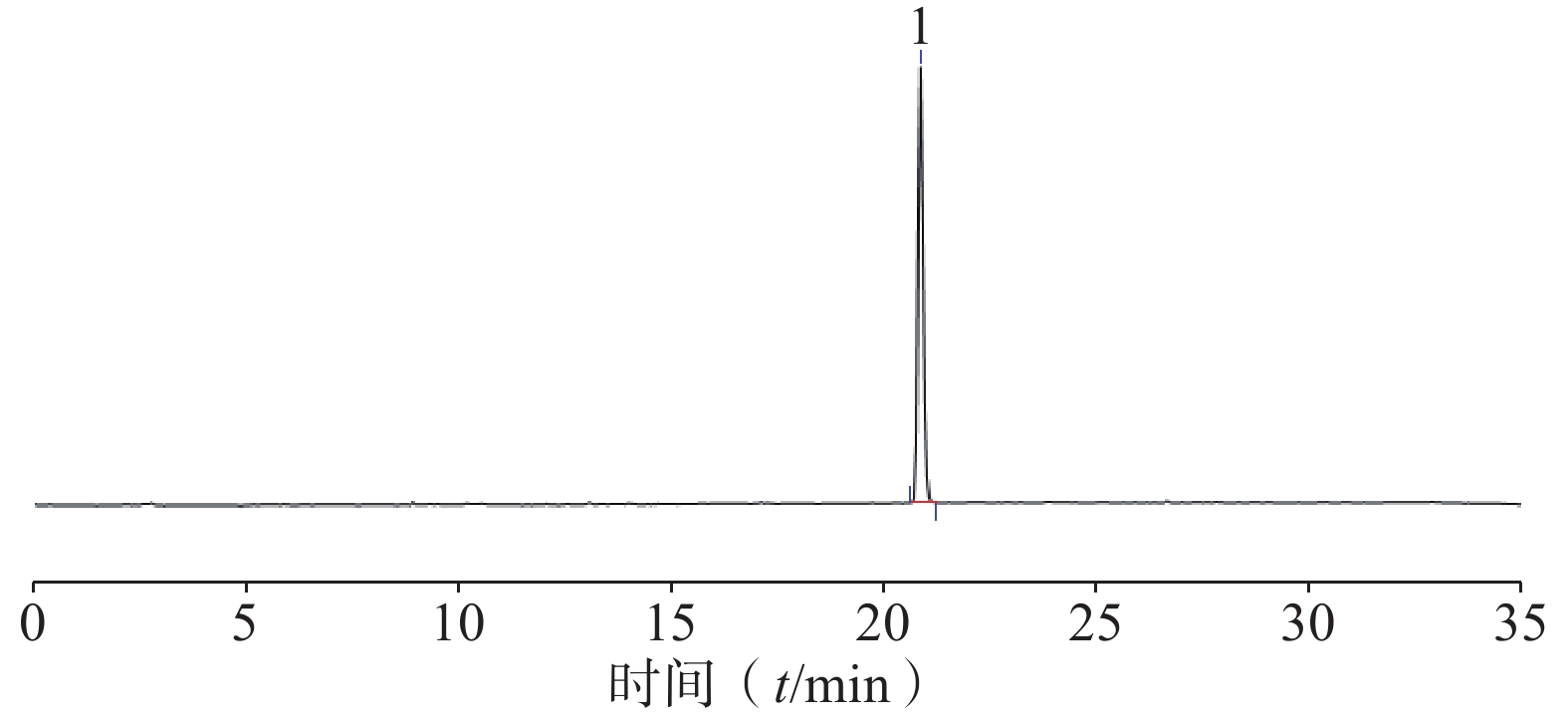
-
毛鸡骨草为豆科植物毛相思子Abrus mollis Hance的干燥全株,又名蜻蜓藤、牛甘藤等,《中药志》《广东中药志》等均有收载,主产于广东、广西等地,具有清热解毒,解暑,利湿等功效,常用于传染性肝炎、乳痈、烧伤、烫伤等的治疗[1],是我国岭南地区常用的食疗药膳原料,临床广泛使用的中药成方制剂鸡骨草胶囊等采用毛鸡骨草投料生产,毛鸡骨草主要含有生物碱、黄酮、三萜、挥发油等多种成分[2-3],具有抗炎[4-5]、抗氧化[6]、调节脂代谢[7-8]、保肝[9]等多种药理活性,食用和药用价值较高。但毛鸡骨草的质量控制尚无较完备的国家标准,仅在广东中药材标准、广西中药饮片炮制规范等地方标准中有收载,标准内容主要包括来源、性状等鉴别项。本研究通过对毛鸡骨草现有质量标准的研究分析,建立毛鸡骨草显微特征、主要成分的含量测定等质量评价方法,为毛鸡骨草的质量标准优化提供研究基础。
-
E100H型超声波提取仪(德国Elm公司);XS204、XP205型分析天平(METTLER TOLEDO公司);BGZ-70电热鼓风干燥箱(上海博讯实业有限公司医疗设备厂);Panthera U电子显微镜(麦克奥迪实业有限公司);SB-5200DTD型超声波清洗仪(上海般诺生物科技有限公司);Vanquish Core型高效液相色谱仪(赛默飞世尔科技有限公司);Alltech3300 ELSD 型蒸发光散射检测器(美国奥泰公司)。
-
本实验通过产地采集、市场采购等共收集32批毛鸡骨草药材,批号JGC-001-005、JGC-001-006、JGC-001-008、JGC-001-009、JGC-001-0011、JGC-002-001、JGC-002-002、JGC-002-003、JGC-002-004、JGC-002-005、JGC-003-001、JGC-003-002、JGC-003-003、JGC-003-005、JGC-003-006、JGC-003-007、JGC-003-008、JGC-003-009、JGC-003-010、JGC-003-011、JGC-003-013、JGC-003-014、JGC-003-015、JGC-003-016、JGC-003-017、JGC-003-018、JGC-003-022、JGC-004-001、JGC-004-002、JGC-004-005、JGC-004-006、JGC-005-010,产地主要集中在广西和广东,包括南宁、桂林、玉林、粤西、肇庆、化州、东莞等,经海军军医大学药学系生药学教研室黄宝康教授鉴定为豆科植物毛相思子Abrus mollis Hance的干燥全株。相思子碱(中国食品药品检定研究院,批号:
111808 -202003 纯度:供鉴别用)、大豆皂苷Bb(四川维克奇生物科技有限公司,批号:wkq22102507 ,纯度:HPLC≥98%);色谱级甲醇,无水乙醇、乙酸乙酯、甲苯、甲酸等分析级试剂(国药集团);蒸馏水(屈臣氏集团)。 -
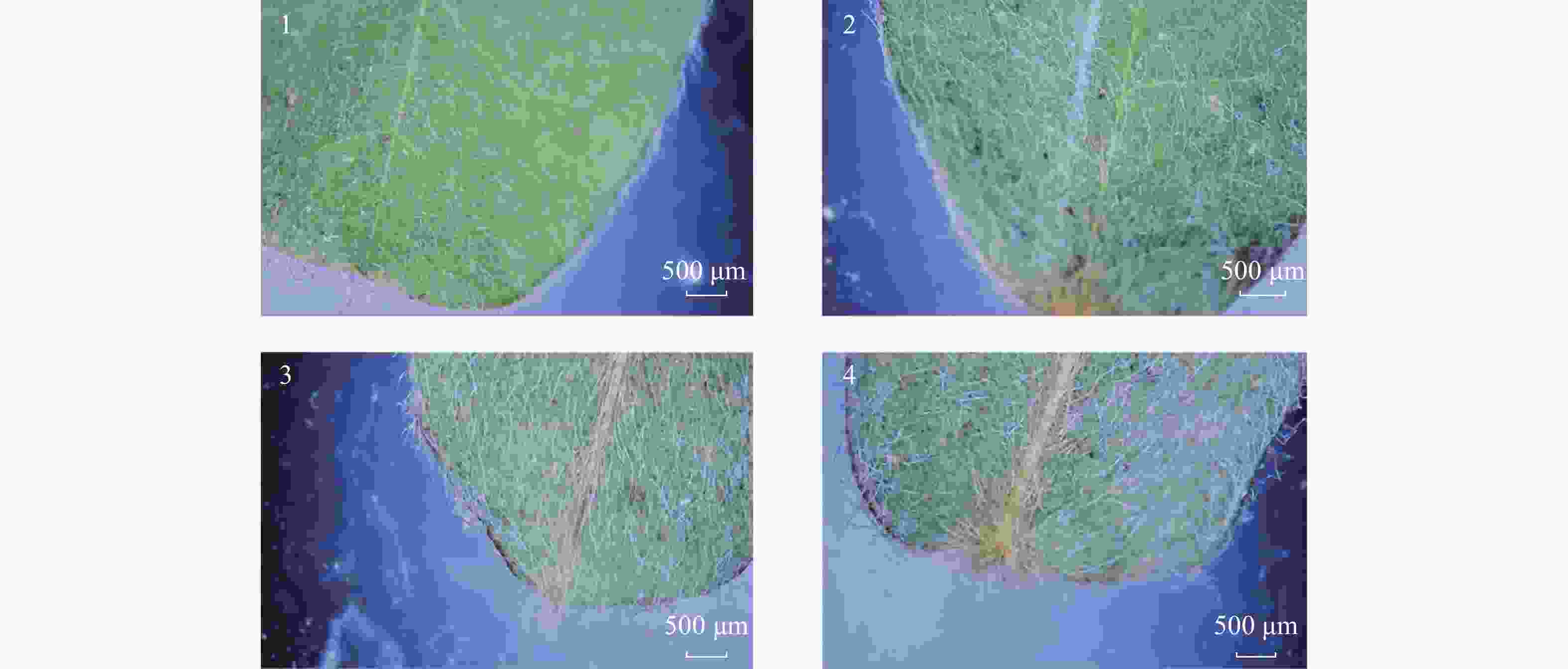
按照《中国药典》(2020年版四部通则0212药材及饮片检定通则)观察毛鸡骨草样品根、茎、叶的形状,大小,表面特征,质地等,其中,皱缩的叶片采用水浸展开后观察,根、茎等附着的泥沙灰尘清洗后观察。根呈长圆柱形,直径0.5~1.5 cm,灰黄色至灰棕色,须根较多。根状茎膨大,地上茎丛生,茎较细,小枝纤细,黄绿色,密被长柔毛。羽状复叶互生,小叶10~16对,淡绿色至黄绿色,长矩圆形,先端圆形,具细尖,全缘,上表面疏被长柔毛,下表面密被长柔毛,叶脉不明显,脉岛不清晰,膜质。根断面黄白色,皮层薄,木部宽广,具放射状纹理;茎断面皮部较薄,韧皮部窄,木部宽,髓部宽,常中空。气微,味微苦(图1、图2)。
-
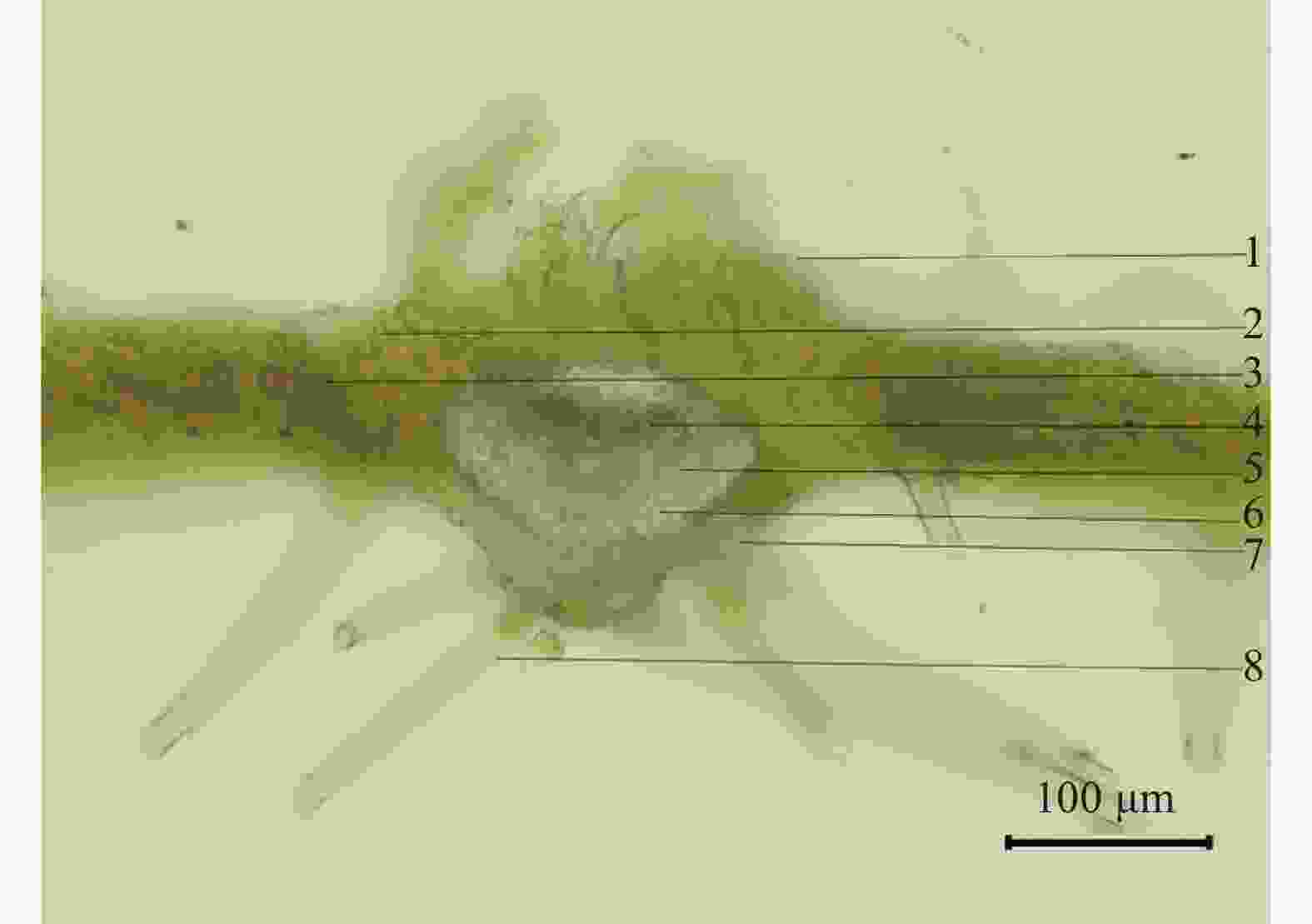
取毛鸡骨草药材粉碎后过筛,解剖针挑取少量置载玻片上滴加水合氯醛试液,盖上盖玻片,酒精灯上加热透化,冷却后置显微镜下观察。本品粉末灰绿色至黄褐色。非腺毛顶端尖或长尖、单细胞。叶表皮细胞波状弯曲,气孔平轴式。纤维成束,周围细胞含草酸钙方晶时,形成晶纤维。草酸钙方晶可见。石细胞类圆形、类方形或长圆形。具缘纹孔导管或螺纹导管。木栓细胞黄棕色(图3)。
-
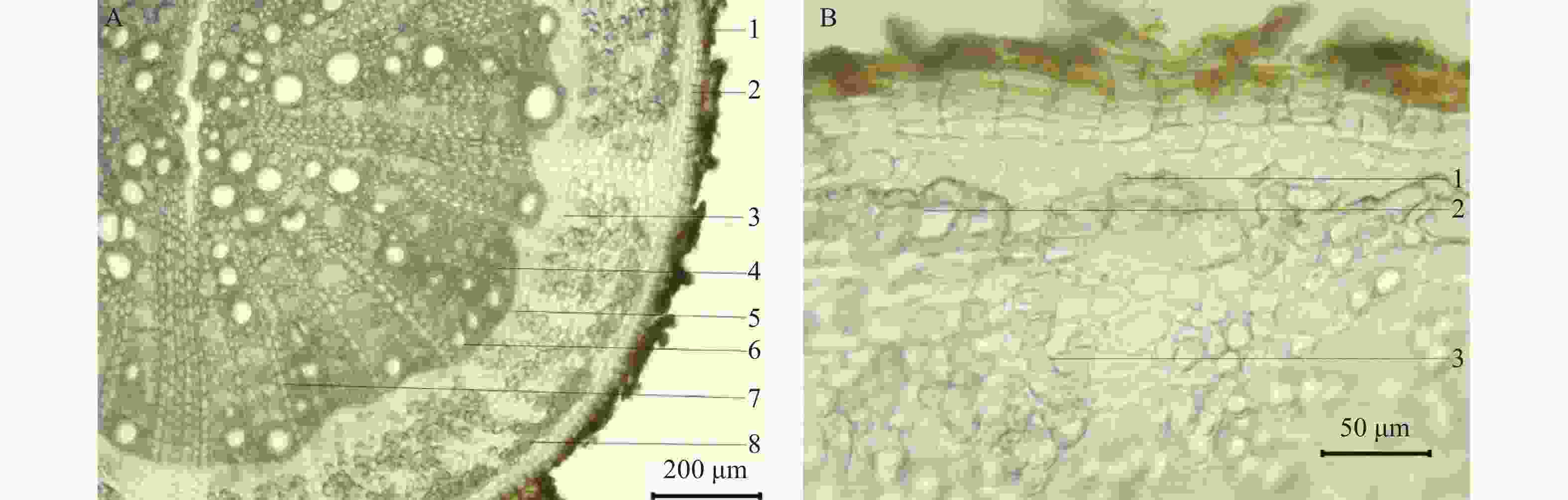
(1) 根的横切面显微特征
通过徒手切片制作毛鸡骨草根、茎、叶的组织片,最外层为木栓组织,由木栓细胞数列构成,类长方形,呈红棕色。皮层较窄,石细胞聚集成群或单个散在断续排列成环,薄壁细胞内可见草酸钙方晶。韧皮部较窄,韧皮纤维束可见。形成层成环。木射线明显,放射状排列,2至数列细胞。木质部导管散在,略呈放射状排列(图4)。
(2) 茎的横切面显微特征
最外层木栓细胞数列,类长方形,呈红棕色。皮层极狭窄。韧皮部窄,偶可见草酸钙方晶散在,石细胞散在或偶有聚集,韧皮纤维成束。形成层成环。木质部导管呈放射状,木射线明显。髓部宽广,薄壁细胞类圆形,多破碎,中心呈空洞状(图5)。
(3) 叶的横切面显微特征
上表皮细胞1列,类方形,表皮下偶可见草酸钙方晶。栅栏组织排列较紧密,不经过主脉。海绵组织疏松排列,细胞类圆形。外韧型维管束,上、下侧均可见纤维存在。下表皮细胞1列。上、下表面可见大量的长非腺毛(图6)。
-
以十八烷基硅烷键合硅胶为填充剂;流动相采用梯度洗脱,A相为0.2 %甲酸溶液,B相为乙腈,梯度洗脱程序见表1。柱温设置为30 ℃ 。流速:0.8 ml/min。检测波长278 nm。进样量:10 μl。
表 1 液相色谱梯度洗脱程序
时间(t/min) A(%) B(%) 0~10 95→90 5→10 10~20 90→88 10→12 20~30 88→87 12→13 30~35 87→86 13→14 35~40 86→84 14→16 40~42 84→25 16→75 42~45 25 75 -
取毛鸡骨草药材,粉碎(过2号筛),精密称取粉末1.0 g,置锥形瓶中,加甲醇50 ml,称定重量,超声提取1h(300 W,40 kHz),取出,称定,补足损失的量,滤过,回收溶剂,残渣加甲醇5 ml使溶解,0.22 μm的微孔滤膜过滤,制得样品溶液。
-
精密称取相思子碱对照品(批号:111808-202003,供鉴别/检查用)10.74 mg,置10 ml容量瓶中,加甲醇溶解,定容至刻度,摇匀,作为相思子碱对照品液。
-
精密量取一定量的相思子碱对照品液置容量瓶中,稀释成不同浓度的对照品溶液为0.268 5、0.214 8、0.171 8、0.137 5、0.109 9、0.055 0、0.027 5 mg/ml;注入液相色谱仪,测定含量,以浓度为横坐标、峰面积为纵坐标,制备标准曲线(图7)。线性方程为:Y=304.38X+0.288 7(r =0.999 9)。
-
精密量取对照品溶液10 μl注入液相色谱仪,测定对照品保留时间及峰面积,平行测定5次,计算相思子碱峰面积的RSD为0.3%,符合要求。
-
取毛鸡骨草样品MJGC-003-010照本节“2.3.2”项下方法制备样品溶液,分别在0、2、4、8、12、24 h测定样品中的相思子碱的含量,记录峰面积,计算RSD为0.5%,符合要求。
-
取同一批毛鸡骨草样品称取6份各1.0 g,照本节“2.3.2”项下方法制备样品溶液,照HPLC法测定各样品中的相思子碱的含量,记录峰面积,计算RSD为2.0%,符合规定。
-
精密称取同一批毛鸡骨草样品6份,置锥形瓶中,加甲醇50 ml,照样品溶液制备法制备加样回收实验样品溶液,取样品溶液10 μl注入HPLC仪,测定,记录其峰面积并计算平均回收率为99.8%,RSD为2.6%,符合要求(表2)。
表 2 加样回收率实验(n = 6)
供试品取样量(m/g) 相思子碱加入量(m/mg) 回收率(%) RSD(%) 0.525 6 0.104 7 103.6 2.6 0.528 1 0.104 7 98.5 0.518 2 0.104 7 95.2 0.528 2 0.104 7 99.3 0.523 4 0.104 7 100.8 0.515 4 0.104 7 101.5 平均值 99.8 -
分别精密吸取对照品溶液、样品溶液一定量,注入液相色谱仪,测定,记录峰面积计算含量。共测定32批样品,根据液相色谱数据计算含量,含量最高的0.177%,最低为0.001%,平均值为0.064 2%,限度计算公式如下:
$$\begin{split} \mu &=\bar{x}-\frac{\text{ts}}{\sqrt{n}}=\bar{x}-\frac{{t}_{0.01}32\times s}{\sqrt{32}}\\&=0.064\;2-\frac{2.449\times 0.041\;8}{5.656\;8}=0.046 \end{split}$$ 式中
$ \bar{x} $ 是样本的平均数;t是置信水平为99%的t检测值(单尾)t0.01,32=2.449;s是样本的标准偏差;n是样本的批数[10]。以限度公式计算结果0.046%为限度,取相对整齐的数值,设定按干燥品计算,毛鸡骨草含相思子碱(C12H14N2O2)应不少于0.045% 。32批样品中有12个批次的毛鸡骨草低于限度。
-
取样品粉末1.0 g,精密称定,置具塞锥形瓶中,照“2.3.2”项下方法制备样品溶液,分别采用Thermo(Thermo AcclaimTM 120 C18 5 μm 120Å 4.6 mm×250 mm)、Agilent(ZORBAX SB-C18 5 μm 4.6 mm×250 mm PN.:
880975 -902 SN.:USCL090710)、Diamonsil(5 μm 4.6 mm×250 mm Cat.no.:99603 Ser.no.:6008112 )色谱柱考察色谱柱的影响;柱温在25、30、35 ℃考察柱温的影响;流速为0.8、1.0、1.2 ml/min考察流速的影响。根据测定数据分析,色谱柱、柱温、流速等对特征峰相对保留时间具有一定影响,RSD分别为4.4%、4.4%、5.0%,RSD%均不大于5.0%,属于可接受的范围,符合规定。 -
以十八烷基硅烷键合硅胶为填充剂;流动相采用梯度洗脱,A相为乙腈,B相为0.2 %甲酸溶液,梯度洗脱程序见表3。柱温设置为35 ℃。流速: 1.0 ml/min。进样量:10 μl。蒸发光散射检测器条件:漂移管温度105 ℃、气体流速3.0 ml/min、增益值2、不分流。
表 3 液相色谱梯度洗脱程序
时间(t/min) A(%) B(%) 0~20 20→45 80→55 20~30 45→55 55→45 30~32 55→20 45→80 32~35 20 80 -
取毛鸡骨草样品粉碎(过2号筛),精密称取粉末1.0 g,置具塞锥形瓶中,加入50 ml 70%甲醇,称定重量,超声处理1h(300 W,40 kHz),取出,称定,补足损失的量,滤过,回收溶剂,残渣加水30 ml使溶解,再加水饱和的正丁醇溶液萃取3次(40、30、30 ml),合并正丁醇液,回收溶剂,残渣加甲醇使溶解,定容至5 ml,用0.22 μm的微孔滤膜过滤,制得样品溶液。
-
精密称取大豆皂苷Bb对照品(批号:wkq 22102507,纯度HPLC≥98%)10.74 mg,置10 ml容量瓶中,加甲醇使溶解,定容至刻度,摇匀,作为大豆皂苷Bb对照品溶液。
-
分别精密量取对照品溶液0.1、0.2、0.4、0.5、0.6、0.8、1.0 ml置进样小瓶,精密加入甲醇补足至1.00 ml,制成标准曲线对照品溶液。采用HPLC-ELSD法,吸取大豆皂苷Bb对照品溶液5 μl,注入高效液相色谱仪测定鸡骨草中大豆皂苷Bb的含量,记录峰面积,以浓度导数值为横坐标、峰面积导数值为纵坐标(图9),大豆皂苷Bb标准曲线为:Y=1.719 3X+2.163 6(r=0.999 6),线性关系良好。
-
精密量取大豆皂苷Bb溶液5 μl注入液相色谱仪,测定大豆皂苷Bb峰面积,平行测定5次,计算峰面积RSD为2.4%,符合规定。
-
精密称取毛鸡骨草粉末1.0 g,置具塞锥形瓶中,加入70%甲醇溶液50 ml,照样品溶液的制备项下方法制备供试品溶液,分别在0、4、6、10、16、24 h测定大豆皂苷Bb,记录峰面积,计算RSD%为1.0%,符合要求。
-
精密称取同一批毛鸡骨草样品6份各1.0 g,照样品溶液的制备项下制备方法制备6 份平行样品溶液,照高效液相色谱法测定样品中的大豆皂苷Bb,记录峰面积,计算含量RSD为5.2%,符合要求。
-
取毛鸡骨草样品约0.25 g,精密称定,依据该样品的浓度,精密加入大豆皂苷Bb对照品一定量,按样品溶液制备方法处理,平行制备加样回收样品溶液6份,各精密量5 μl注入高效液相色谱仪,测定,记录其峰面积计算平均回收率为100.6%,RSD为3.8%,符合《中国药典》(2020年版 四部 通则
9101 )含量为0.1%数量级时,回收率限度应在90%~108%的要求(表4)。表 4 加样回收率实验(n = 6)
供试品取样量(m/g) 大豆皂苷Bb
加入量(m/mg)回收率(%) RSD(%) 0.250 8 0.192 0 95.6 3.8 0.257 1 0.192 0 99.9 0.256 0 0.192 0 96.3 0.256 5 0.192 0 104.5 0.260 6 0.192 0 106.1 0.253 6 0.192 0 101.1 平均值 100.6 -
照HPLC-ELSD法测定32批次毛鸡骨草药材,峰面积取导数,计算供试品中大豆皂苷Bb的含量。含量最高为0.215 3%,最低为0.012 2%,平均值为0.074 3%。含量限度计算使用公式:
$$\begin{split} \mu &=\bar{x}-\frac{\text{ts}}{\sqrt{n}}=\bar{x}-\frac{{t}_{0.01}32\times s}{\sqrt{32}}\\&=0.074\;3-\frac{2.449\times 0.059\;1}{5.656\;8}=0.048\;2 \end{split}$$ 以限度公式计算结果0.048 2%为限度,设定按干燥品计算,毛鸡骨草含大豆皂苷Bb(C48H78O18)应不少于0.048%。
-
取样品MJGC-001-011粉末1.0 g,精密称定,置具塞锥形瓶中,照样品溶液制备项下方法制备样品溶液,分别采用Thermo、Agilent、Diamonsil等品牌C18色谱柱,考察色谱柱对大豆皂苷Bb含量的影响;在25、30、35 ℃考察柱温的影响;设置流速0.8、1.0、1.2 ml/min考察流速的影响。色谱柱、柱温、流速的影响符合规定,RSD%分别为1.3%、0.3%、1.3%。
-
毛鸡骨草主产于我国岭南地区,当地常作为鸡骨草用于急慢性肝炎、黄疸等的治疗以及凉茶和煲汤的食材,但毛鸡骨草与鸡骨草是不同的植物,两药形态、功效及应用范围相似,《中国药典》仅收载了鸡骨草,按《中华人民共和国药品管理法》规定毛鸡骨草不得作为鸡骨草使用,但毛鸡骨草是市场主流品种,供应量大、适用范围广,制定符合自身特色的质量评价方法具有实际意义。
目前毛鸡骨草质量控制研究主要集中在相思子碱、刺桐碱含量测定[11],总黄酮的含量测定[12]以及特征图谱的研究[13]等方面。本研究从性状鉴定、显微鉴定角度建立毛鸡骨草的鉴定特征,对比现行版《中国药典》对鸡骨草的描述,毛鸡骨草的小叶相对于鸡骨草来说叶片偏大,叶的上下表面被有更密集的长柔毛,以至于观察叶脉和脉岛时不明显。组织横切面木质部束、射线清晰,石细胞聚集或单个散在,方晶可见。相思子碱是鸡骨草、毛鸡骨草等相思子属植物中重要的成分,药典中鸡骨草的薄层鉴定即以相思子碱为对照,香港特区及台湾省鸡骨草药材标准则以相思子碱限度控制鸡骨草的质量,本研究参考上述标准以相思子碱为指标建立了毛鸡骨草的HPLC含量测定方法。
文献研究发现,相思子碱可以显著降低CCl4诱导的肝损伤小鼠血清中转氨酶活性及胆红素含量,从而发挥降酶保肝的作用;且能够明显抑制小鼠耳廓肿胀,减少小鼠炎症后耳郭重量发挥抗炎作用[14]。相思子碱还能够通过KAT5/PD-L1轴调控肝癌细胞的生长和凋亡,调控T细胞的增殖和活化,发挥抗肝癌的作用。相思子碱的药理活性反映了毛鸡骨草清热解毒、利湿退黄用于急、慢性肝炎的功效特点。因此,选择相思子碱作为毛鸡骨草质量控制的主要成分具有合理性。大豆皂苷Bb是毛鸡骨草中另一主要成分,大豆皂苷Bb可显著降低血清、肝脏和白色脂肪组织(WATs)中的促炎细胞因子水平,降低肝脏胆固醇、甘油三酯的含量,促进胆固醇、甘油三酯和胆汁酸的排泄,其作用机制可能与抑制IKKα/β磷酸化,降低WATs中NF-κB p65磷酸化水平及CD68 mRNA蛋白的表达有关[15]。大豆皂苷Bb可以显著恢复大鼠肝细胞(BRL 3A)的抗氧化活性,上调血红素氧合酶-1(HO-1)的表达,改善乙醇暴露引起的肝损伤和形态学改变[16]。大豆皂苷Bb可以通过抑制ROS的产生,调控TLR4向脂筏的募集及其与受体分子的相互作用,抑制促炎分子的产生和NF-κB的激活,进而发挥阻断炎症反应的作用[17]。因此,本研究另外选择了大豆皂苷Bb作为毛鸡骨草质量控制的另一个主要指标成分,建立了HPLC-ELSD含量测定方法。
-
毛鸡骨草性状及显微特征与鸡骨草相似,但又具有自身特征,差异主要集中于小叶的大小、被毛的疏密、叶脉,以及显微中方晶、石细胞可见但较少等方面。以相思子碱为指标,采用高效液相色谱法测定含量,按干燥品计算,毛鸡骨草中相思子碱(C12H14N2O2)含量应不少于0.045%;以大豆皂苷Bb为指标,采用高效液相色谱法串联蒸发光散射检测法测定含量,按干燥品计算,毛鸡骨草中大豆皂苷Bb(C48H78O18)的含量应不少于0.048%。这些鉴别方法可为科学评价毛鸡骨草质量提供科学依据。
Quality evaluation of Abri Mollis Herba
-
摘要:
目的 基于性状、显微特征及主成分含量测定建立毛鸡骨草质量评价方法。 方法 采用性状鉴定的方法明确毛鸡骨草的性状特征,采用显微技术鉴定毛鸡骨草粉末和组织横切面的显微特征,通过采用高效液相色谱法建立毛鸡骨草主要成分相思子碱、大豆皂苷Bb的含量测定方法。 结果 毛鸡骨草性状特征主要为小叶上下表面均密被长柔毛,叶脉及脉岛不清晰;显微特征主要是粉末含有非腺毛、方晶、晶鞘纤维等,根横切面可见木质部束、射线、导管、石细胞等,茎横切面可见射线、导管、髓部中空等,叶横切面可见外韧型维管束、导管、方晶等。HPLC测定相思子碱、大豆皂苷Bb含量分别为不得少于0.045%和0.048%。 结论 性状鉴定、显微鉴定结合主成分相思子碱、大豆皂苷Bb的含量测定能够较好的评价毛鸡骨草的质量。 Abstract:Objective To establish a quality evaluation method for Abri Mollis Herba based on its morphological characteristics, microscopic features, and the determination of principal component contents. Methods The morphological characteristics of Abri Mollis Herba were identified by morphological authentication methods. Microscopic techniques were employed to observe the microscopic features of both the powdered form and cross-sectional tissue of Abri Mollis Herba. Additionally, a high-performance liquid chromatography (HPLC) method was developed to establish the quantify the main components, abrine and soyasaponin Bb, in Abri Mollis Herba. Results The morphological characteristics of Abri Mollis Herba were defined by numerous long pubescence on both the upper and lower surfaces of the leaflets, with indistinct veins and vein islands. The microscopic features mainly included non-glandular hairs, prismatic crystals, and crystal-sheathed fibers in the powdered form. In the root cross-section, xylem bundles, rays, vessels, and stone cells were visible. The stem cross-section displayed rays, vessels, and a hollow pith, while the leaf cross-section revealed collateral vascular bundles, vessels, and prismatic crystals. Conclusion The quality of Abri Mollis Herba could be effectively evaluated by the combination of morphological identification, microscopic authentication, and the quantification of main components abrine and soyasaponin Bb . -
Key words:
- Abri Mollis Herba /
- quality evaluation /
- content determination
-
表 1 液相色谱梯度洗脱程序
时间(t/min) A(%) B(%) 0~10 95→90 5→10 10~20 90→88 10→12 20~30 88→87 12→13 30~35 87→86 13→14 35~40 86→84 14→16 40~42 84→25 16→75 42~45 25 75 表 2 加样回收率实验(n = 6)
供试品取样量(m/g) 相思子碱加入量(m/mg) 回收率(%) RSD(%) 0.525 6 0.104 7 103.6 2.6 0.528 1 0.104 7 98.5 0.518 2 0.104 7 95.2 0.528 2 0.104 7 99.3 0.523 4 0.104 7 100.8 0.515 4 0.104 7 101.5 平均值 99.8 表 3 液相色谱梯度洗脱程序
时间(t/min) A(%) B(%) 0~20 20→45 80→55 20~30 45→55 55→45 30~32 55→20 45→80 32~35 20 80 表 4 加样回收率实验(n = 6)
供试品取样量(m/g) 大豆皂苷Bb
加入量(m/mg)回收率(%) RSD(%) 0.250 8 0.192 0 95.6 3.8 0.257 1 0.192 0 99.9 0.256 0 0.192 0 96.3 0.256 5 0.192 0 104.5 0.260 6 0.192 0 106.1 0.253 6 0.192 0 101.1 平均值 100.6 -
[1] 中华本草编委会. 中华本草(第十一卷)[M]. 上海: 上海科学技术出版社, 1995. [2] 肖晓, 许重远, 杨德俊, 等. 鸡骨草与毛鸡骨草挥发油及脂肪酸成分的比较分析[J]. 药学实践杂志, 2017, 35(1):39-42. [3] TAN Z E, CHEN S M, ZHANG M L, et al. An ultra-high performance liquid chromatography with quadrupole time-of-flight mass spectrometry identification and characterization of the active constituents from Abrus mollis Hance[J]. J Sep Sci, 2023, 46(2):e2200311. doi: 10.1002/jssc.202200311 [4] 黄志琼, 陈道峰, 杨世林, 等. 毛鸡骨草化学成分及抗炎活性研究[J]. 中药材, 2024, 7:1706-1711. [5] LIANG Z K, CHEN Z X, XUE X M, et al. A comparative study between Abrus cantoniensis and Abrus mollis: flavonoids profiles by UPLC-Q-TOF-MS and Anti-inflammatory mechanism by transcriptomics[J]. Chem Biodivers, 2023, 20(6):e202300204. doi: 10.1002/cbdv.202300204 [6] YANG M, SHEN Q, LI L Q, et al. Phytochemical profiles, antioxidant activities of functional herb Abrus cantoniensis and Abrus mollis[J]. Food Chem, 2015, 177:304-312. doi: 10.1016/j.foodchem.2015.01.054 [7] WANG Y, JIANG Z Z, CHEN M, et al. Protective effect of total flavonoid C-glycosides from Abrus mollis extract on lipopolysaccharide-induced lipotoxicity in mice[J]. Chin J Nat Med, 2014, 12(6):461-468. [8] 陈晓白, 莫志贤, 曹雪玲. 毛鸡骨草对高脂血症大鼠血脂及血液流变性的影响[J]. 中药药理与临床, 2009, 25(1):40-42. [9] ZHANG Z Q, WANG H C, KUANG Z, et al. From tea to health: exploring Abrus mollis for liver protection and unraveling its potential mechanisms[J]. J Agric Food Chem, 2023, 71(41):15145-15155. doi: 10.1021/acs.jafc.3c04816 [10] 林源, 魏雨辰, 李晓东, 等. 醋蒸延胡索质量标准研究[J]. 药学实践杂志, 2022, 40(01):57-61. [11] 黄平, 麦秋良, 蒙晓芳. 毛鸡骨草中相思子碱和下箴刺桐碱含量测定[J]. 现代中药研究与实践, 2010, 24(6):62-64. [12] 袁旭江, 张平, 吴燕红, 等. 毛鸡骨草中总黄酮含量测定方法[J]. 中国实验方剂学杂志, 2015, 21(11):80-84. [13] 黄平, 李文静, 何碧婷. 毛鸡骨草药材的HPLC指纹图谱[J]. 中国实验方剂学杂志, 2014, 20(1):66-69. [14] 钟正贤, 李燕婧, 陈学芬, 等. 相思子碱的药理作用研究[J]. 中医药导报, 2009, 15(1):8-10. [15] XIE Q Y, GU X F, CHEN J B, et al. Soyasaponins reduce inflammation and improve serum lipid profiles and glucose homeostasis in high fat diet-induced obese mice[J]. Mol Nutr Food Res, 2018, 62(19):e1800205. doi: 10.1002/mnfr.201800205 [16] ZHU L J, FU R R, LIU X Y, et al. Soyasaponin bb protects rat hepatocytes from alcohol-induced oxidative stress by inducing heme oxygenase-1[J]. Pharmacogn Mag, 2016, 12(48):302-306. doi: 10.4103/0973-1296.192203 [17] ZHANG Y J, CHEN F P, CHEN J D, et al. Soyasaponin Bb inhibits the recruitment of toll-like receptor 4(TLR4)into lipid rafts and its signaling pathway by suppressing the nicotinamide adenine dinucleotide phosphate(NADPH)oxidase-dependent generation of reactive oxygen species[J]. Mol Nutr Food Res, 2016, 60(7):1532-1543. doi: 10.1002/mnfr.201600015 -





 下载:
下载: