-
传统中药黄芪可补益肝气、活血利水,对各种慢性肝病均具有治疗作用[1],其有效成分包括黄芪皂苷类、黄芪多糖类、黄芪黄酮类等。其中,黄芪甲苷(AS-Ⅳ)作为《中国药典》规定的中药黄芪的质控标准,是中药黄芪的主要活性成分,具有抗炎、降糖调脂、抗纤维化等作用[2],已被证实能改善实验性非酒精性脂肪肝[3]。但黄芪甲苷水溶性差、生物利用度低等特点限制了其临床应用前景。本课题组研究人员前期通过对黄芪甲苷进行结构优化改造,提高化合物溶解性,改善药物动力学性质,筛选到水溶性好、成药性佳的小分子化合物HHQ16[4],具有良好的新药研发前景。
ORM (Orosomucoid)是一种主要由肝脏合成分泌的急性期蛋白,在血清、肝脏及其他外周组织以ORM1亚型表达为主。ORM具有运载药物、免疫调节等多种生物学功能,近年来,其在代谢性疾病中的作用受到越来越多的关注[5]。本课题组研究人员前期研究发现,ORM是一个新的内源性能量调控蛋白,ORM1缺失可导致小鼠肝脏脂质沉积[6]。Zhou等也发现,ORM2可以抑制脂质从头合成,改善肝脏的脂代谢[7]。这些研究都提示ORM可成为治疗肝脏脂代谢相关疾病的潜在靶标。
本研究中采用游离脂肪酸(FFA)诱导肝细胞脂质损伤模型,探讨全新小分子化合物HHQ 16对肝细胞脂质沉积的改善作用及对ORM信号的调控作用。
-
油红O(0684,Amresco)、棕榈酸钠(Macklin)、油酸(Sigma)、牛血清白蛋白(Sigma)、异丙醇(80109218,国药集团)、α1 酸性糖蛋白抗体(Genway Biotech Inc.)、GAPDH 抗体(Affinity)、Tubulin 抗体(Affinity)、抗兔 IgG 抗体(Rockland)、油红O染色试剂盒(Solarbio)、细胞及组织总蛋白抽提试剂盒(数谱生物)、NC 膜(GE Amersham)、NC 膜平衡液(VisualProtein)、封闭液(VisualProtein)、蛋白酶抑制剂三联装(上海碧云天生物有限公司)、蛋白质预染色标记(上海碧云天生物有限公司)。
-
酶标检测仪(Epoch BioTeK)、涡旋混合器(MX-F Servicebio)、台式高速冷冻离心机(D3024R,大龙)、蛋白电泳仪(Bio-Rad Laboratories,Inc)、蛋白快速湿转仪(GenScript,Inc.)、荧光扫描仪(Li-COR Biosciences)、制冰机(Scotsman Industries Inc.)、电热恒温水浴锅 SVT3100(杭州瑞城仪器有限公司)、PCR 扩增仪(Thermo Fisher Scientific)、QuantStudio 3 实时荧光定量PCR仪(ABI)。
-
小鼠肝细系 AML12,购自中国科学院细胞库。培养液配方:DMEM/F-12 (1∶1)、FBS(Fetal bovine serum)、1‰ ITS 液体补充剂、1‰双抗生素。培养条件:5%CO2、37 ℃恒温孵育箱。
-
1%BSA配制:100 mg 牛血清白蛋白(BSA)加入10 ml双蒸水,振荡混匀,4 ℃保存备用;12 mmol/L油酸(OA)储备液(12.976 mg)加入5 ml 1% BSA 溶液中,振荡混匀,0.22 μm微孔滤膜进行滤菌处理,4 ℃保存;6 mmol/L 棕榈酸钠(PA)储备液(8.352 mg)加入5 ml 1% BSA溶液,60 ℃水浴加热混匀至无沉淀析出,0.22 μm微孔滤膜进行滤菌处理,4 ℃保存,冷却之后出现沉淀为正常形象,不高于 60 ℃水浴加热后可继续使用。接种细胞:将 AML12小鼠肝细胞接种于6孔板,密度约为106 个/孔,每组复孔为3,在 37 ℃、5%CO2 恒温培养箱培养。细胞造模:弃去完全培养基,按照OA∶PA=800 μmol/L∶400 μmol/L 的比例,用无血清培养基稀释药物储备液(即配即用),刺激细胞 24 h,构建 FFA 脂质沉积模型;同样按照OA∶PA=1 000 μmol/L∶500 μmol/L 的比例刺激细胞 24 h,构建 FFA 脂质损伤模型。在药物处理前,更换含PA、OA的无血清培养基,用于后续实验。
-
用PBS漂洗AML12细胞2次后,提取细胞总蛋白,参照碧云天BCA(Bicinchoninic Acid Assay)蛋白浓度测定试剂盒说明书测量蛋白浓度,加入1/4体积的5X蛋白上样缓冲液,沸水煮10 min,按20 ng蛋白/孔上样电泳,转膜,封闭1 h,一抗ORM(1∶1 000),GAPDH(1∶5 000),Tubulin(1∶5 000)4 ℃孵育过夜,二抗(1∶10 000)37 ℃孵育1 h。ECL法显色曝光,使用ImageJ图像分析软件测定蛋白灰度值。
-
接种细胞:将AML12 接种于 96 孔板,密度约 104个/孔,每组复孔为 6。药物刺激:弃去培养基,用无血清的培养基加不同浓度 FFA(OA∶PA=2∶1)刺激细胞 24 h 后,在原培养基里加入浓度为 1 μmol/L 黄芪甲苷衍生物 HHQ16 刺激 12 h。CCK8 检测:弃去培养基,每孔加 100 μl 无血清培养基,快速加入 10 μl CCK8 (Cell Counting Kit-8)溶液,勿产生气泡,放入培养箱孵育 15、30、60、120 min。吸光度测定:在上述时间点测定 450 nm 处A值,根据不同组之间的A值计算组间差异。
-
采用AG RNAex Pro RNA 提取试剂(艾科瑞生物,中国),按照说明书提取小鼠肝脏和小鼠肝细胞(AML12)的RNA,随后采用Evo M-MLV 反转录试剂盒(艾科瑞生物,中国)将RNA逆转录为cDNA,逆转录反应条件如下:37 ℃ 15 分钟、85 ℃ 5 秒、4 ℃ ∞。以GAPDH为内参,采用实时荧光定量 PCR 方法对目的基因进行定量分析,通过 2−△△Ct 计算目的基因在不同组别之间的表达差异。反应条件如下,保持阶段 ,95 ℃ 10 分钟 ;循环阶段 ,95 ℃ 15 秒 (40 个循环) ,60 ℃ 1 分钟 ;熔化曲线阶段, 95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s。引物序列见表1。
表 1 相关引物序列
基因 上游序列(5'—3') 下游序列(5'—3') ORM1 ACACAATAGAGCTTCGGGAGT ATATCTGGCCTTTTGGCATAGA GAPDH CCAATGCACCACTGCTTAG GGATGCAGGGATGATGTTCT -
样品前处理:直接在培养板中裂解细胞,按100 μl/106 加入裂解液,混匀后静置 10 min,取适量上清液,70 ℃加热 10 min,室温 2 000 r/min离心5 min,上清液直接用于酶学测定,余下裂解液参照 BCA 蛋白定量试剂盒进行蛋白定量或−20 ℃保存备用。
样品测定:选取96孔板,分为样品孔、标准孔和空白孔,每孔分别加入10 μl待测样品、标准品及蒸馏水,再加入190 μl工作液,37 ℃或 25 ℃反应 15 min,反应平衡后在60 min内稳定,根据吸光度值计算待测样本甘油三酯浓度。
-
移除细胞培养基后,用PBS洗涤两次后,加油红O固定液固定20~30 min。弃去固定液,用蒸馏水洗涤2次,加入60%异丙醇浸洗20~30 s。弃去60%异丙醇后加入新配置好的油红O染色液,浸染10~20 min。弃去染色液,60%异丙醇漂洗20~30 s至间质清晰,水洗2~5次,直至无多余染液。加入Mayer苏木素染色液,复染核1~2 min,弃去染液后水洗2~5次,加入油红O缓冲液孵育1 min,弃去。加入蒸馏水覆盖细胞并在显微镜下观察。采用 ImageJ软件对免疫组化阳性细胞占区域面积比进行统计并分析数据。
-
ORM1基因的siRNA由广州锐博生物技术有限公司构建,序列见表2。
表 2 基因转染序列
siRNA 序列 siORM1-1 GCAGGCAATTCAAACAATG siORM1-2 CAACTTCACCATAGGCGAA siORM1-3 CCACCAACTTGATAAACGA 接种细胞:AML12细胞接种于12孔板,密度约 106个/孔,每组复孔为3。
siRNA 孵育液配置:采用Polyplus Transfection公司INTERFERin转染试剂,以12孔板为例,取1 μl siRNA溶液,加入200 μl DMEM/F12培养基,混匀离心,再加入5 μl INTERFERin 转染试剂,再次混匀离心,室温孵育10 min。
转染:更换原培养基为含1% FBS的完全培养基,每孔加入siRNA 孵育液200 μl,48 h后收集细胞总蛋白、总RNA。
验证:根据蛋白和基因水平确定最佳干扰序列。
-
本实验采用GraphPad Prism 9.0软件进行数据统计与分析。单因素两组之间相互比较,采用student t检验分析;单因素多组之间相互比较,采用单向方差分析 one way ANOVA 检验;组间均值两两比较采用 Dunnett’s multiple comparisons test 检验。实验结果均采用(均数±标准误)表示。 若P<0.05 ,则认为差异具有统计学意义。
-
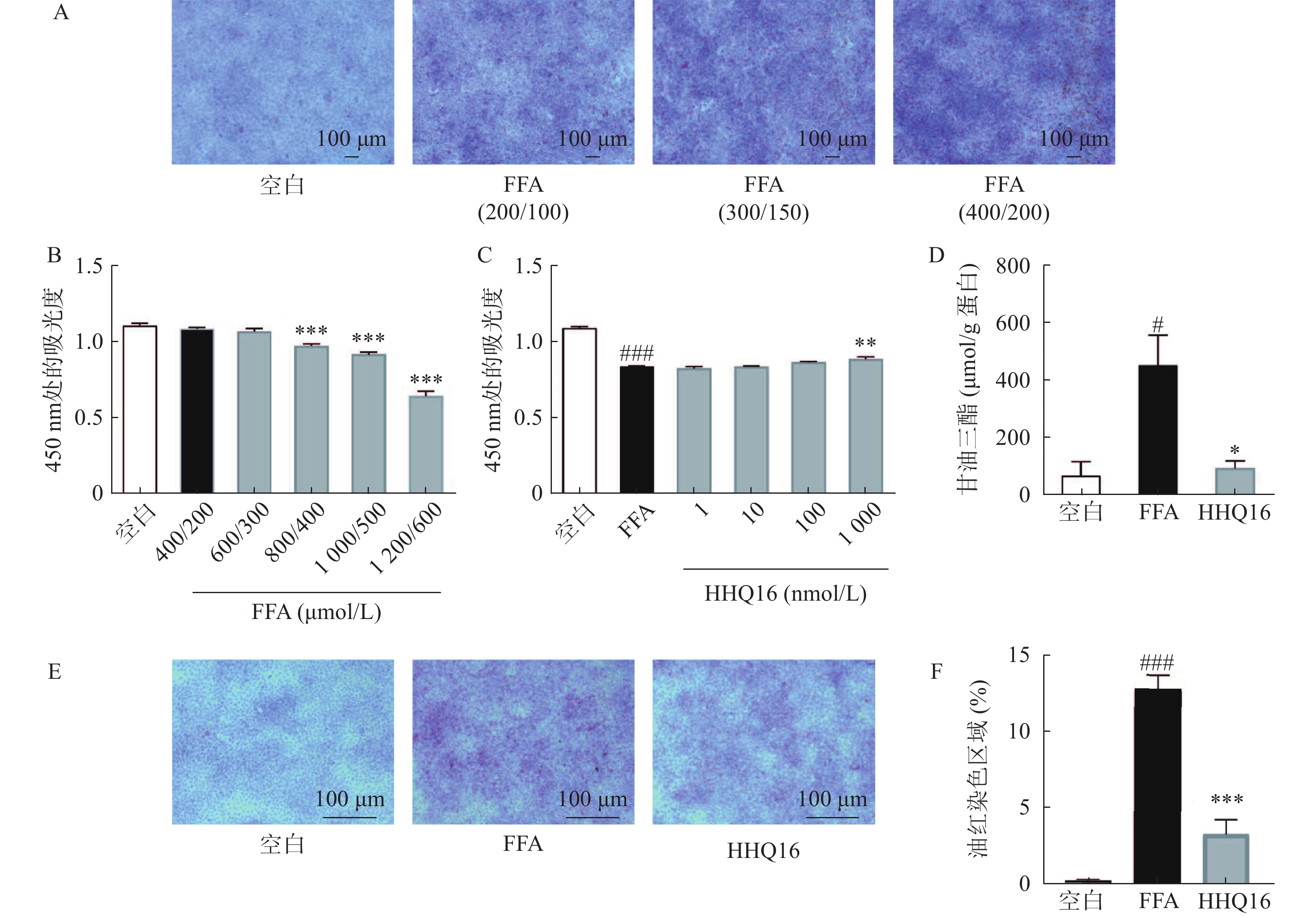
用经典FFA(OA:PA=2:1)进行脂质沉积造模,在小鼠AML12细胞上,当OA∶PA=200 μmol/L∶100 μmol/L时,开始出现脂质沉积,当OA:PA=400 μmol/L∶200 μmol/L时,可见明显脂质沉积(图1A),但当OA∶PA=800 μmol/L∶400 μmol/L时才发生肝细胞活力下降(图1B)。在给予药物HHQ16 后,可缓解FFA导致的脂质沉积,降低甘油三酯水平,恢复肝细胞活力(图1C~F)。
-
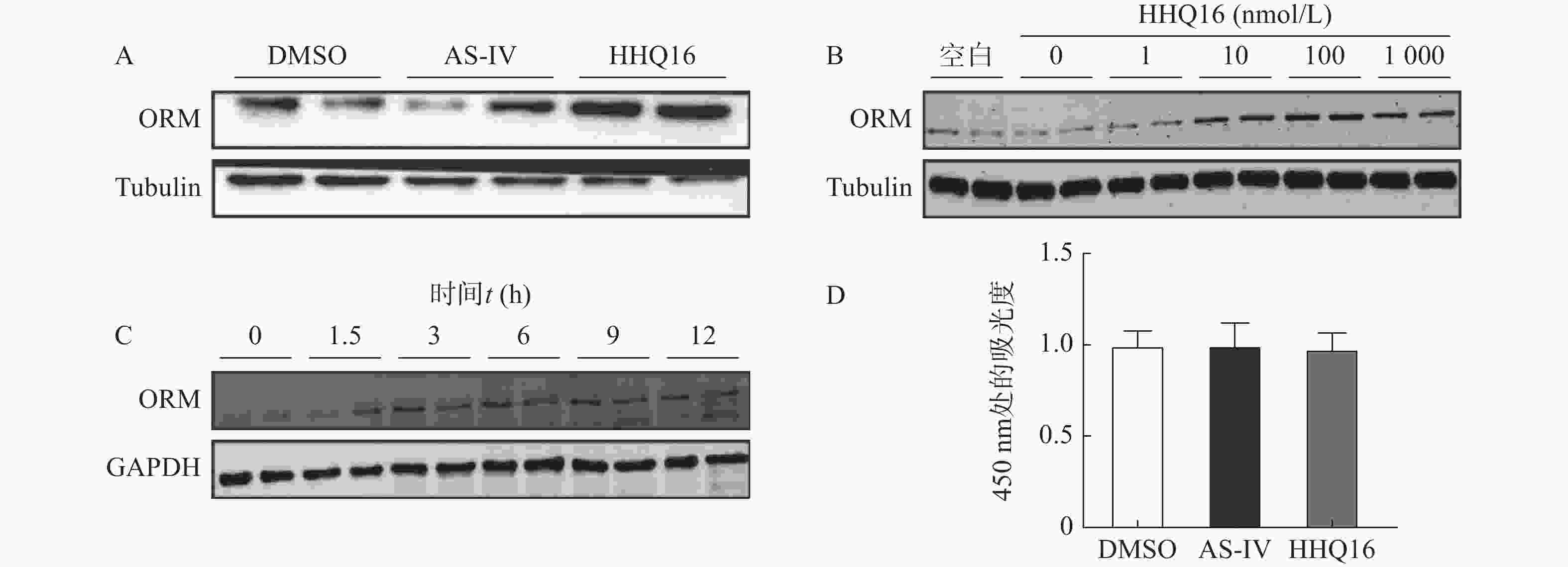
分别用相同剂量的黄芪甲苷和HHQ16处理AML12肝细胞,发现相较于黄芪甲苷,改造后的HHQ16能更显著地提高细胞内ORM水平(图2A)。进一步时效和量效实验显示,HHQ16可以时间依赖性与剂量依赖性地升高ORM的表达水平(图2B、2C)。此外,CCK8实验结果显示,黄芪甲苷与HHQ16在最高实验剂量(1 000 nmol/L)下均未对AML12细胞活力产生影响(图2D),说明该实验浓度下药物无细胞毒性。
-
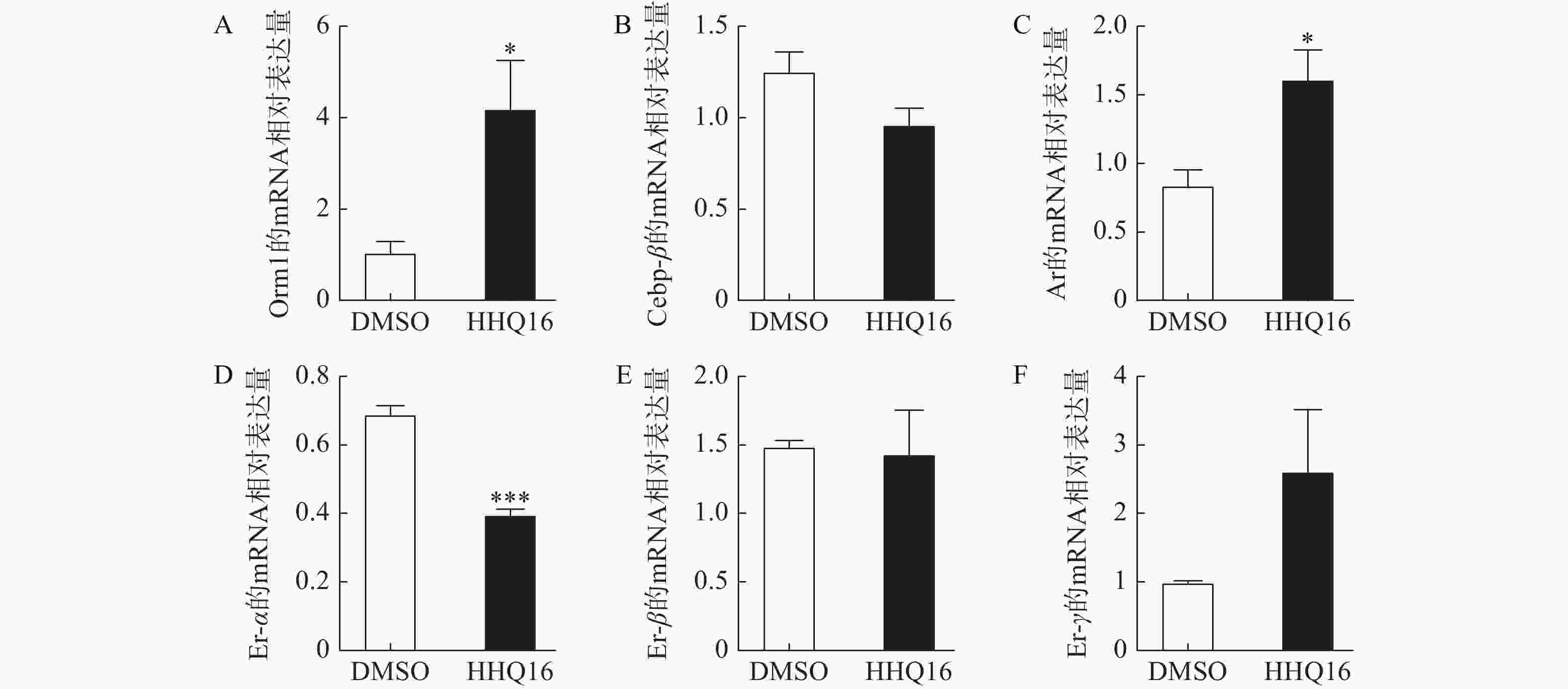
研究人员初步探索了HHQ16调控ORM表达的机制,HHQ16能显著升高肝脏ORM主要亚型ORM1的mRNA水平(图3A),提示HHQ可能在转录水平调控ORM1表达。据文献报道,ORM的表达受C/ebp-β、雄性激素受体(Ar)和雌性激素受体(Er)等转录因子调控[8–10]。检测这3个转录因子的表达水平,发现HHQ16给药不影响C/ebpβ的mRNA表达水平(图3B),但Ar的mRNA表达水平上升至原来的2倍左右(图3C),同时Er-α的mRNA表达水平下降到原来的1/2左右(图3D)。提示HHQ可能通过影响上游转录因子Ar和Er的表达,进而升高肝细胞内ORM水平。
-
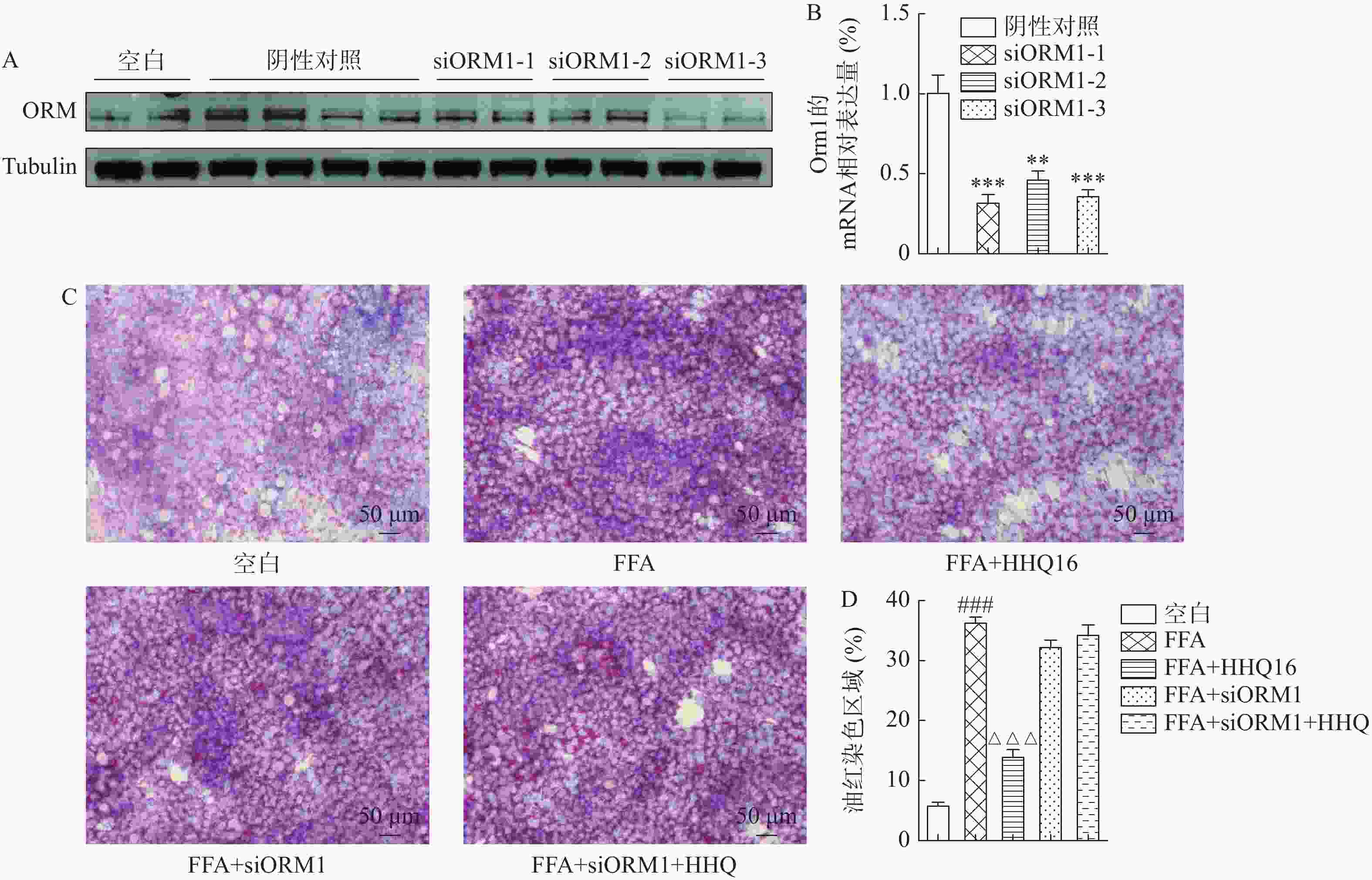
小鼠ORM共有3个亚型,其中,ORM1为肝脏中表达的主要亚型[5]。为验证HHQ16是否通过ORM1发挥药效,设计了ORM1的siRNA,利用实时定量PCR、Western blot验证不同siRNA序列的干扰效率,综合二者结果得出siORM1-3序列的干扰效果最佳,后续实验均采用siORM1-3序列(图4A、B),发现HHQ16改善FFA诱导的AML12细胞脂质沉积的作用被逆转(图4C、D),说明HHQ可能是通过调控ORM1来改善肝细胞脂质沉积的。
-
肝脏作为脂质与脂蛋白摄取、合成与分泌的主要器官,在全身脂质循环中发挥着至关重要的作用。其中,肝脏因子作为肝脏组织分泌的蛋白质,除影响肝脏局部脂质代谢外,还可通过自分泌、旁分泌、内分泌等途径调节全身的脂质代谢。本课题组研究人员前期研究发现,肝脏因子ORM在能量代谢调控中发挥重要作用,ORM1敲除小鼠会出现严重脂肪肝[5]。Zhou等也报道了ORM2缺陷会导致肝内甘油三酯沉积、肝脂肪变性,而补充ORM2能通过影响固醇调节元件来改善肝脏脂质代谢[7]。这些研究都提示,ORM有望成为治疗肝脏脂质代谢异常的新靶标。
传统中药在脂肪性肝病的治疗预防方面已经有数千年的治疗史,多种有效成分被发现具有降脂、抗氧化、缓解脂肪肝等作用,如水飞蓟素(水飞蓟主要有效成分)可提高肝脏抗氧化能力,促进肝细胞修复与再生[11];淫羊藿苷(中药淫羊藿的主要成分)可通过提高大鼠葡萄糖利用率与胰岛素敏感性,达到一定的降脂作用[12,13];黄芪甲苷可通过增加胆固醇的排出[14],降低肝脏与血液中的总胆固醇与甘油三酯水平[15]。然而,许多天然的活性成分不稳定,提取物的质量受光照、环境温度、湿度、时间等因素影响,这在一定程度上限制了中药提取物的临床应用。本课题组前期通过对黄芪的主要有效成分黄芪甲苷进行化学改造,得到化学稳定性更高,生物利用度更好的全新小分子药物HHQ16。本文研究发现,黄芪甲苷衍生物HHQ16可以显著升高肝细胞ORM水平,并且对ORM的调控优于其前体黄芪甲苷。初步机制探索发现,HHQ16可以升高转录因子Ar的水平,并降低Er表达。据文献报道,Ar可通过结合ORM1增强子区域增强ORM的表达[8],而Er激活后则通过MAPK通路抑制ORM表达[9],提示HHQ可能通过多条途径提高ORM水平。同时,本研究发现,HHQ16改善肝细胞脂质沉积的作用是由ORM介导的,初步阐明了HHQ16改善肝细胞脂质沉积的机制,为HHQ16进一步开发成为干预与治疗肝脏脂质代谢紊乱相关疾病的潜在药物提供了理论支撑。
Upregulation of α1-acidglycoprotein to ameliorate hepatocyte lipid accumulation by Astragaloside derivative HHQ16
-
摘要:
目的 研究黄芪甲苷衍生物HHQ 16对肝细胞脂质沉积的作用及机制。 方法 在AML12肝细胞上用游离脂肪酸构建脂质沉积模型,检测细胞的甘油三酯和油红染色等反映肝细胞脂质沉积情况。通过实时定量PCR和蛋白免疫印迹法检测α1酸性糖蛋白(ORM)及其上游相关调控因子表达。通过siRNA技术对ORM1的表达进行干扰,确定ORM1是否介导HHQ16的作用。 结果 HHQ16显著改善FFA导致的肝脂质沉积,同时HHQ16升高ORM表达,干扰主要亚型ORM1表达后HHQ16改善肝细胞脂质沉积作用被逆转。 结论 HHQ16通过升高ORM改善肝细胞脂质沉积。 Abstract:Objective To investigate the effect and mechanism of HHQ 16, a derivative of astragaloside Ⅳ, on hepatocyte lipid accumulation. Methods Free fatty acids were used to stimulate lipid hepatocyte accumulation. Triglyceride and Oil Red O staining were detected to reflect hepatocyte lipid accumulation. The expression of α1-acidglycoprotein (ORM) and its regulators were detected by real-time quantitative PCR and immunoblotting. The expression of ORM1 was interfered with siRNA to determine whether it mediated the action of HHQ16.The expression of ORM1 was interfered by siRNA to determine whether it mediated the action of HHQ16. Results HHQ16 significantly ameliorated FFA-induced hepatocyte lipid deposition. HHQ16 elevated ORM expression, and the protective effect of HHQ16 on hepatocyte lipid accumulation was reversed by ORM interference. Conclusion HHQ16 could ameliorate hepatocyte lipid accumulation by elevating ORM. -
Key words:
- HHQ16 /
- ORM /
- hepatocyte /
- lipid accumulation
-
图 1 HHQ16改善肝细胞脂质损伤
A. 不同浓度FFA造模后脂质沉积情况(n=3); B.不同浓度FFA造模后肝细胞活力 (n=6); C. HHQ16恢复FFA损伤的肝细胞活力; D. HHQ16(1 000 nmol/L)降低甘油三酯水平(n=3), FFA(OA∶PA=800 μmol/L∶400 μmol/L); E、F. HHQ16 (1 000 nmol/L) 缓解FFA导致的脂质沉积 (n=3), FFA(OA∶PA=400 μmol/L∶200 μmol/L)*P<0.05, **P<0.01, ***P<0.001,与FFA组比较;#P<0.05, ###P<0.001,与空白组比较。
表 1 相关引物序列
基因 上游序列(5'—3') 下游序列(5'—3') ORM1 ACACAATAGAGCTTCGGGAGT ATATCTGGCCTTTTGGCATAGA GAPDH CCAATGCACCACTGCTTAG GGATGCAGGGATGATGTTCT 表 2 基因转染序列
siRNA 序列 siORM1-1 GCAGGCAATTCAAACAATG siORM1-2 CAACTTCACCATAGGCGAA siORM1-3 CCACCAACTTGATAAACGA -
[1] 胡伶姿, 刘明坤, 吕文良, 等. 吕文良教授运用黄芪论治慢性肝病的经验[J]. 吉林中医药, 2019, 39(2):154-157. [2] 刘应莉, 刘璇, 王艳荣, 等. 基于网络药理学探讨黄芪甲苷治疗非酒精性脂肪性肝病的作用机制[J]. 现代医药卫生, 2023, 9(14):2372-2378. [3] 代鲜敏, 黄思, 孙旸, 等. 黄芪对非酒精性脂肪肝的影响及潜在机制[J]. 中华中医药学刊, 2021, 39(3):222-225. [4] WAN J J, ZHANG Z, WU C N, et al. Astragaloside Ⅳ derivative HHQ16 ameliorates infarction-induced hypertrophy and heart failure through degradation of lncRNA4012/9456[J]. Signal Transduct Target Ther, 2023, 8(1):414. doi: 10.1038/s41392-023-01660-9 [5] LUO Z M, LEI H, SUN Y, et al. Orosomucoid, an acute response protein with multiple modulating activities[J]. J Physiol Biochem, 2015, 71(2):329-340. doi: 10.1007/s13105-015-0389-9 [6] SUN Y, YANG Y L, QIN Z, et al. The acute-phase protein orosomucoid regulates food intake and energy homeostasis via leptin receptor signaling pathway[J]. Diabetes, 2016, 65(6):1630-1641. doi: 10.2337/db15-1193 [7] ZHOU B, LUO Y C, JI N N, et al. Orosomucoid 2 maintains hepatic lipid homeostasis through suppression of de novolipogenesis[J]. Nat Metab, 2022, 4:1185-1201. doi: 10.1038/s42255-022-00627-4 [8] NORRIS J D, CHANG C Y, WITTMANN B M, et al. The homeodomain protein HOXB13 regulates the cellular response to androgens[J]. Mol Cell, 2009, 36(3):405-416. doi: 10.1016/j.molcel.2009.10.020 [9] SUN Y, QIN Z, WAN J J, et al. Estrogen weakens muscle endurance via estrogen receptor-p38 MAPK-mediated orosomucoid (ORM) suppression[J]. Exp Mol Med, 2018, 50(3):e463. doi: 10.1038/emm.2017.307 [10] FOURNIER T, MEDJOUBI-N N, PORQUET D. Alpha-1-acid glycoprotein[J]. Biochim Biophys Acta, 2000, 1482(1-2):157-171. doi: 10.1016/S0167-4838(00)00153-9 [11] 张娟, 白庆云, 田丽莉. 水飞蓟素防治实验性肝病的作用及相关临床应用的研究进展[J]. 中国现代应用药学, 2023, 9(19):2745-2753. [12] 刘蕊, 赵健蕾, 孙晓东, 等. 中药淫羊藿调控肝脏脂代谢功能初探[J]. 中药药理与临床, 2018, 34(1):92-96. [13] 张悦, 王佳艺, 刘慧敏, 等. 淫羊藿及其制剂主要化学成分与肝损伤作用研究进展[J]. 中草药, 2023, 54(21):7213-7221. [14] LIU H M, ZHU L, CHEN L X, et al. Therapeutic potential of traditional Chinese medicine in atherosclerosis: a review[J]. Phytother Res, 2022, 36(11):4080-4100. doi: 10.1002/ptr.7590 [15] 祁雅煊, 黄文雅. 中药治疗单纯性肥胖研究进展[J]. 中西医结合研究, 2023, 15(3):191-194. -





 下载:
下载: