-
HMS-01是由我们实验室以红霉素为前体改造而来的抗疲劳新药,笔者在前期工作中发现,红霉素能明显延长小鼠游泳和跑台的疲劳时间,肌肉疲劳指数提高,增加糖原含量,增强线粒体功能和ATP水平,有望成为治疗肌肉疲劳的潜在药物[1]。但是红霉素作为大环内酯类抗生素无法应用为抗疲劳药物,因此,笔者在红霉素的基础上进行改造,得到了新化合物HMS-01,在抗疲劳实验研究中效果显著,得到国家重大新药研发的资金支持,目前已进入临床前研究阶段。红霉素具有潜在的心脏毒性,导致QT延长综合征[2]。因此对新化合物HMS-01进行心脏毒性评价十分必要。
人类Ether-a-go-go-Related基因(hERG)编码的快速激活钾通道是参与心肌动作电位3期复极形成的重要离子通道[3-4]。药物阻断hERG通道会导致心脏复极延长,心电图表现为QT间期延长,称为长QT间期综合征。药物引起的心室延迟复极在某些情况下可能引发致命性心律失常-尖端扭转型室性心动过速[5-6]。
据统计,25%~40%的先导化合物都显示出不同程度的hERG相关毒性,而且很多药物由于可能导致QT间期延长风险而被撤出市场。在临床上,若某药物诱导发生扭转型室性心动过速后果极其严重,有必要采用合适的技术方法,检测是否可能诱发这种严重的心律失常,因此2005年国际协调会 (ICH) 颁布的指导原则“评价人用药品潜在致心室复极化延迟作用(QT间期延长)的安全药理学研究(S7B)”建议所有的药物均需要评估其在原代心肌细胞或重组细胞中对心肌延迟复极的作用[7-9],美国FDA等药物监管部门也要求新药申报必须有hERG心脏安全性的评估数据。心脏毒性问题也越来越引起我国重视,2014年,我国食品药品监督管理总局推出《药物QT间期延长潜在作用非临床研究技术指导原则》,明确指出体外实验中可使用“离体动物或人心肌细胞、培养心肌细胞系或克隆的人离子通道异种表达体系测定离子流”[10],目前,中国食品药品监督总局(NMPA)也要求研究中的新药(IND)申报临床试验前需要有hERG/IKr安全性评价的数据。
因此,在新药临床前试验引入hERG安全性检测,是非常必要的,可以有效控制新药研发的风险和成本。在体外实验中,常常会选择稳定表达钾离子通道蛋白的转染有hERG基因的哺乳动物细胞系细胞[9],哺乳动物细胞的实验结果更接近于人体生理条件[10],本次实验中我们选用的是人胚肾细胞(HEK293细胞)[11]。实验中使用的阳性对照药西沙必利有促心律失常的作用,hERG是西沙必利作用的分子靶点,基本机制是阻断hERG电流,低浓度时可有效阻断HEK293中异源表达的hERG通道[12]。
全细胞膜片钳技术是hERG安全性评价的金标准,“膜片”即表示细胞膜,“钳”则是指控制,可分为电压钳和电流钳,膜片钳技术简单说是一种通过玻璃微吸管电极控制细胞后监测并记录膜电流,通过分析膜电流的变化了解离子通道的本质。膜片钳技术在药物体外安全性评价中已经广泛普及,在发现药物毒性后及时止损大大缩短药物开发周期。
笔者采用膜片钳技术检测被测化合物(HMS-01)对hERG通道阻断作用的浓度效应关系,从而评价样品对心脏hERG钾通道抑制作用的风险,评价其引发心室复极毒性的风险。本试验是遵循GLP指导原则进行的非GLP实验,研究根据相关文献以及标准操作程序进行。
-
将hERG钾通道稳定表达的HEK293细胞系在含有10% 胎牛血清及0.8 mg/ml G418的DMEM培养基中,置于5%CO2,37oC孵箱培养。除去旧培养基PBS洗一次,加入1 ml TrypLE™ Express溶液,37℃孵育0.5 min。当细胞从皿底脱离,加入5 ml、37℃预热的完全培养基,将细胞悬液用吸管轻轻吹打使聚集的细胞分离,转移至无菌的离心管中,1000 r/min离心5 min收集细胞。扩增或维持培养,将细胞接种于6 cm细胞培养皿,每个细胞培养皿,接种细胞量为2.5×105细胞(最终体积:5 ml)。为维持细胞的电生理活性,细胞密度不能超过80%。实验之前细胞用TrypLE™ Express分离,将3×103 细胞铺到盖玻片上,在24孔板中培养(最终体积:500 µl)18 h后,进行实验检测。
-
称量10mg HMS-01(本实验室自制)溶于二甲基亚砜(DMSO)配制成母液,用10 ml的细胞外液将母液依次稀释成0.3、1、3、10、30 µmol/L浓度的样品,所有浓度超声20 min,至所有样品全部溶解,没有肉眼可见沉淀。
-
将10 mg西沙必利[12-13](购自Sigma公司)阳性对照药用DMSO配制成10 mmol/L的母液,再用DMSO将西沙必利母液依次稀释为1、10、100 µmol/L以及1 mmol/L 4个浓度,西沙必利最终的工作浓度为1、10、100 nmol/L以及1 µmol/L,西沙必利全部溶解,没有肉眼可见的沉淀。
-
细胞外液的配方为:140 mmol/L NaCl, 3.5 mmol/L KCl, 1 mmol/L MgCl2, 2 mmol/L CaCl2, 10 mmol/L葡萄糖, 10 mmol/L HEPES, 1.25 mmol/L NaH2PO4,用NaOH将pH调节为7.4。细胞内液的配方为:20 mmol/L KCl, 115 mmol/L K-Aspartic, 1 mmol/L MgCl2, 5 mmol/L EGTA, 10 mmol/L HEPES, 2 mmol/L Na2-ATP, 用KOH将pH调节为7.2。
-
P97电极拉制仪、BF150-86-10毛细玻璃管、MP285R微操纵器(美国Sutter Instruments);IX71显微镜(Olympus);BT100L蠕动泵(Lead Fluid);EPC10放大器(德国HEKA);Patchmaster v2x73.2、IGOR 6.0.1.0数据采集和分析软件(德国HEKA)。
-
将每一个药物浓度作用后的电流和空白对照电流标准化(化合物峰尾电流/空白组峰尾电流),然后计算每一个药物浓度对应的抑制率(1−化合物峰尾电流/空白组峰尾电流)。对每一个浓度计算平均数和标准误,并用以下的方程计算每种化合物的半抑制浓度:
$$ \text{抑制率}=\frac{1}{1+{\left(\frac{\mathrm{I}\mathrm{C}_{50}}{C}\right)}^{h}} $$ 用以上方程对剂量依赖效应进行非线性拟合,其中,c代表药物浓度,IC50为半抑制浓度,h代表希尔系数。曲线拟合以及IC50的计算利用IGOR软件完成。
-
用微电极拉制仪将毛细玻璃管拉制成记录电极。在倒置显微镜下操纵微电极操纵仪将记录电极接触到细胞上,给予负压抽吸,形成GΩ封接,封接电阻 ≥ 1 GΩ。形成GΩ封接后进行快速电容补偿,然后继续给予负压,吸破细胞膜,形成全细胞记录模式。然后进行慢速电容的补偿并记录膜电容及串联电阻。不给予漏电补偿。
-
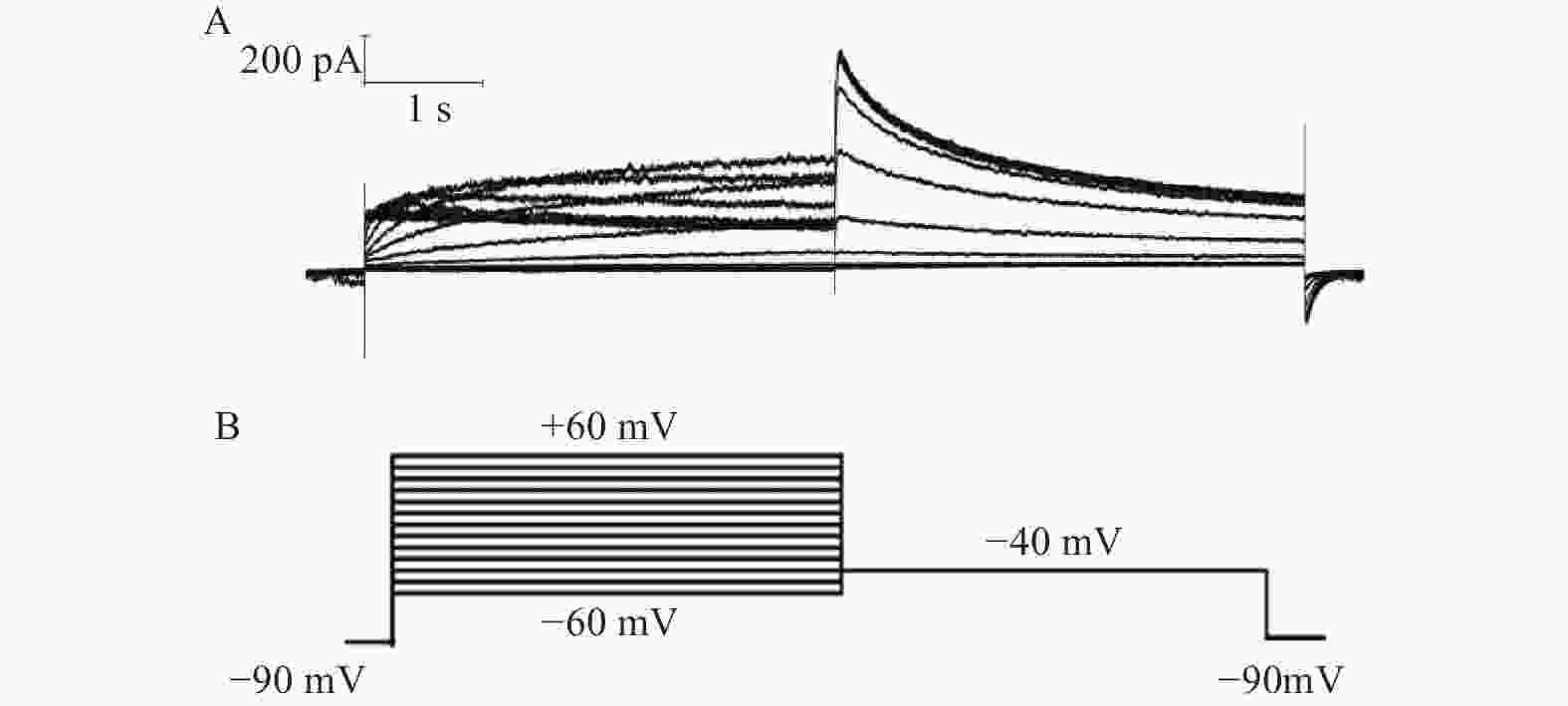
当形成全细胞封接后,细胞膜电压钳置于−80 mV,在膜电位为−80 mV下无明显的漏电流 (漏电流 ≤ 100 pA)。钳制电压由−80 mV除极至+30 mV维持2.5 s,然后迅速保持在−50 mV维持4 s,可以激发出hERG通道的尾电流,起始尾电流峰值≥400 pA,起始尾电流峰值大于激活电流峰值,尾电流没有明显的自发性衰减(5 min内自发性衰减<5%)。每隔10s重复采集数据,观察药物对hERG尾电流的作用。以−50 mV为漏电流检测值。实验数据由 EPC-10 放大器进行采集并储存于PatchMaster软件中。
-
当全细胞记录的hERG电流稳定后开始给药,每个药物浓度作用至5 min(或者电流至稳定)后检测下一个浓度,每一个测试化合物检测多个浓度。将铺有细胞的盖玻片置于倒置显微镜中的记录浴槽中,测试化合物以及不含化合物的外液利用重力灌流的方法从低浓度到高浓度依次流经记录小室从而作用于细胞,在记录中利用真空泵进行液体交换。每一个细胞在不含化合物的外液中检测到的电流作为自己的对照组。独立重复检测多个细胞。所有电生理实验均在室温下进行。
-
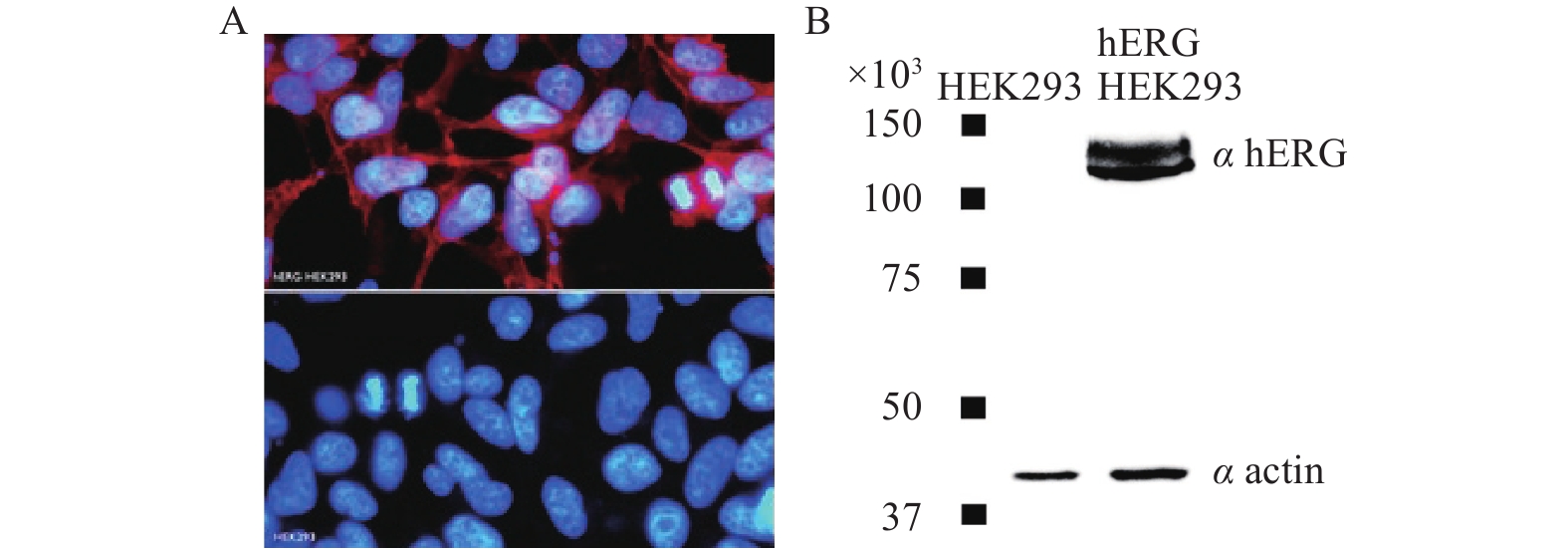
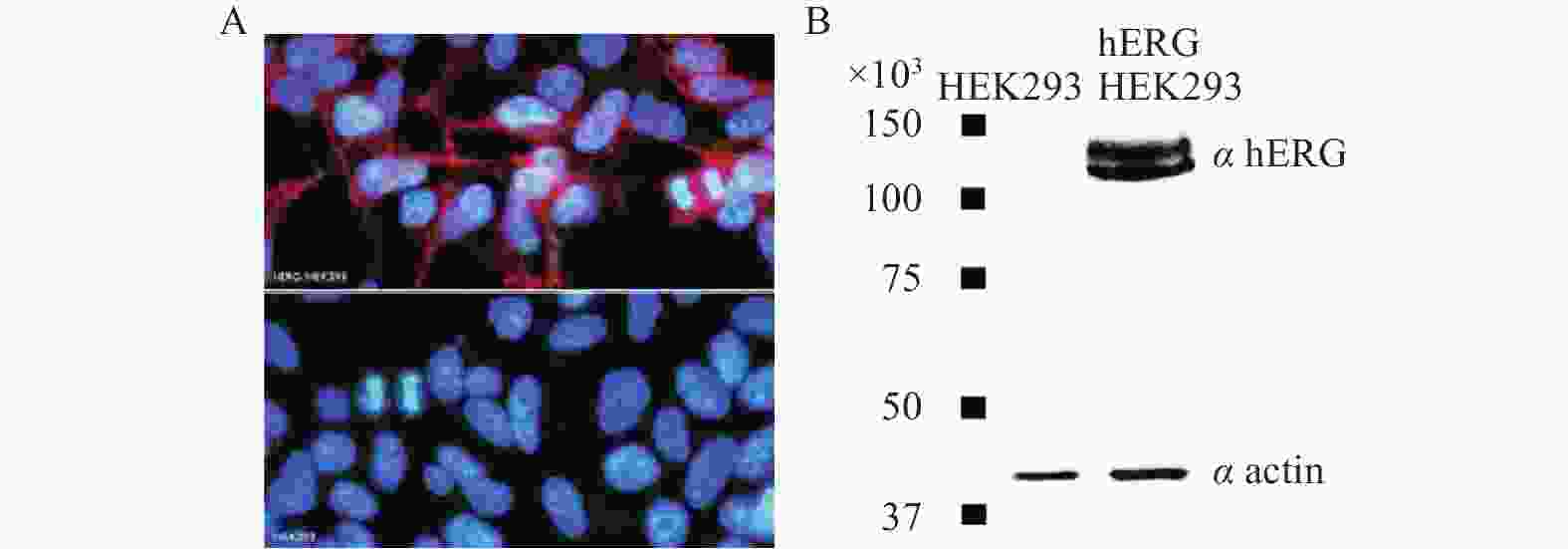
使用带有hERG基因的重组质粒对HEK-293细胞进行转染,细胞表达的重组蛋白有:Homo sapiens potassium voltage-gated channel, subfamily H (eag-related), member 2 (KCNH2), transcript variant1。表达系统为constitutive (pSG5-Kana)。最终用 G418(0.8 mg/ml)作为标记进行细胞筛选。筛选出的细胞中,hERG通道的表达经过免疫标记,被hERG转染的 HEK293细胞表面被标记上荧光(图1A)以及通过蛋白质印记表达实验(图1B),均表明hERG基因转染进入HEK293细胞并表达了hERG通道蛋白。
-
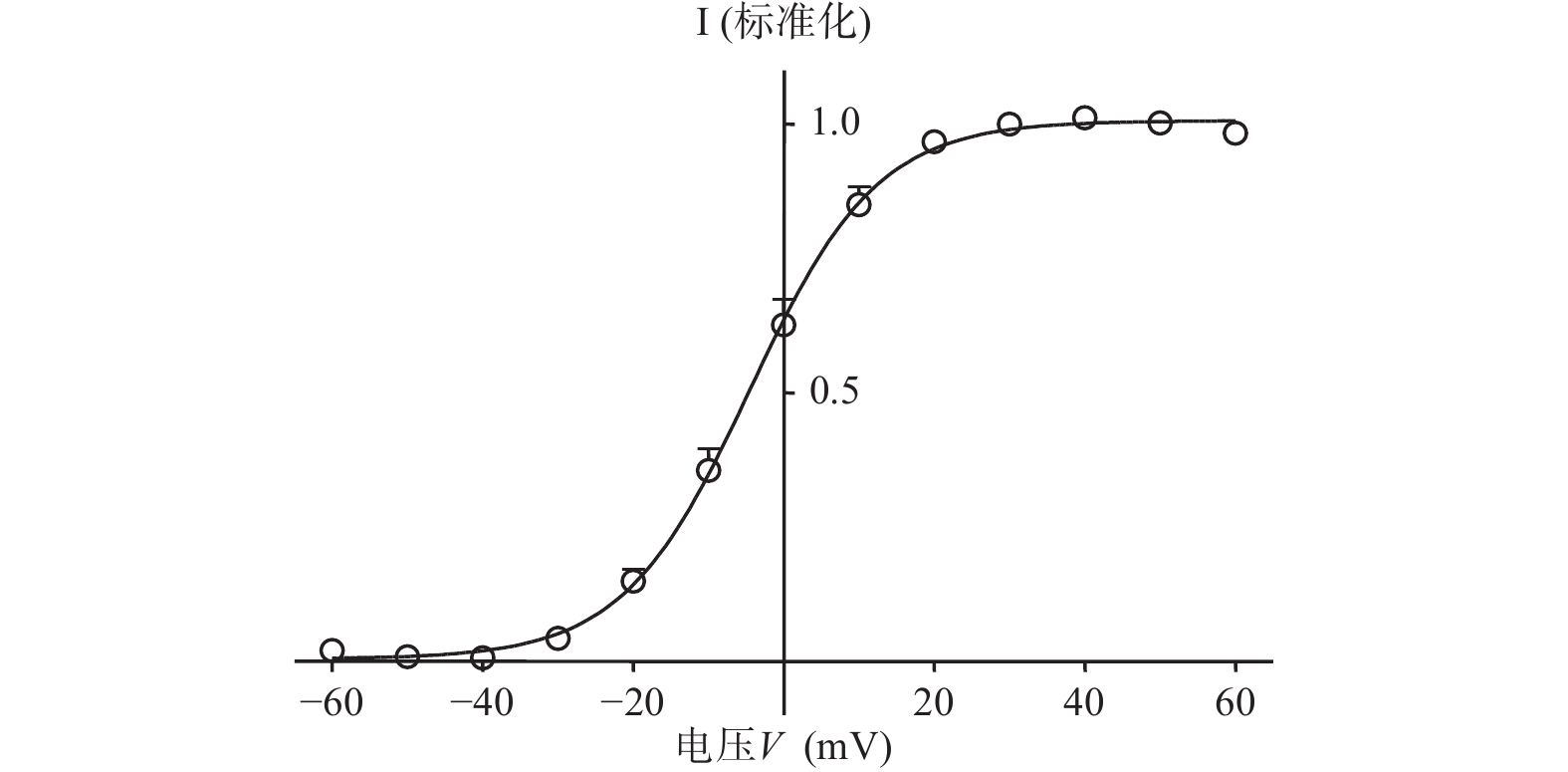
在形成全细胞状态后,将细胞钳制在−90 mV,给予指令电位从−60~+60mV,然后电压保持在−40 mV,记录I结果(图2)。所记录到的尾电流在 +10 mV时接近高峰,当膜电位再升高时尾电流饱和(图3)。
-
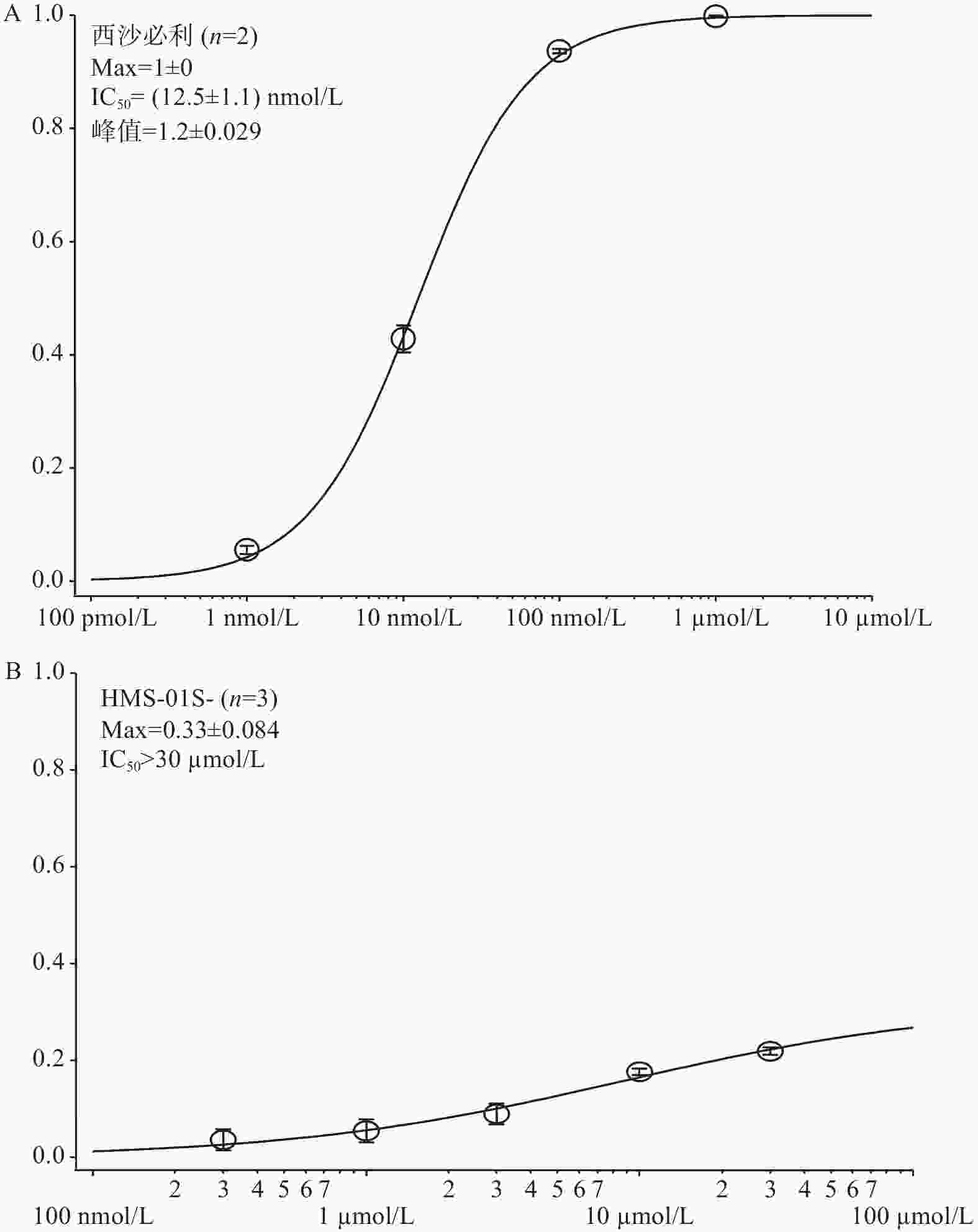
在几次独立重复实验中检测HMS-01与西沙必利对hERG通道抑制作用,并通过拟合计算出样品对hERG电流的半抑制浓度(IC50),笔者采用了通用标准判断被试化合物对hERG的抑制效应[14],极强抑制:IC50<0.1 µmol/L;强抑制:0.1 µmol/L ≤ IC50 ≤ 1 µmol/L;中度抑制:1 µmol/L ≤ IC50 ≤ 10 µmol/L;弱抑制或无抑制:IC50> 10 µmol/L。根据以上标准,实验结果表明,与阳性对照药西沙必利相比,化合物HMS-01对hERG通道具有弱抑制或无抑制作用(图4)。
-
有证据表明,药物会以浓度依赖的方式减缓复极化,当药物hERG半抑制浓度超过其在血液中的浓度峰值的30倍左右时,是一个相对安全的范围[15-17]。本实验研究结果证明,与阳性对照药西沙必利相比,HMS-01作为新药对hERG通道无明显抑制作用。尽管大环内酯类抗生素红霉素作为该化合物前体具有心脏毒性[18-19],红霉素第一次改造后变成无抗菌活性的螺缩酮,二次结构改造后才成为我们的新药HMS-01,改造后心脏毒性作用消失,本研究结果对于推动该新药进入临床试验,是一个十分积极的信号。
目前膜片钳技术的水平大为提升,已经广泛活跃在各种离子通道相关研究中。尽管膜片钳研究在预测化合物引起QT延长的风险中是灵敏的指标,但仅凭hERG电生理的结果来评价化合物潜在的延长QT间隔的风险是远远不够的。还要通过安全药理学和毒理学等综合研究。
The effect of HMS-01 on stably expressed hERG channel currents in HEK293 cells detected with the manualpatch clamp method
-
摘要:
目的 检测新化合物HMS-01有无心脏毒性,对其进行临床前安全评价研究,为进入临床试验做准备。 方法 用手动膜片钳检测转染后hERG钾通道稳定表达的HEK293细胞的电流,西沙必利做阳性药,将HMS-01依次稀释成0.3、1、3、10、30 µmol/L,依次作用于细胞,记录电流变化,计算抑制率。 结果 HMS-01在实验设计的最高浓度30 µmol/L时,对细胞hERG钾通道的抑制率低于30%,与阳性对照药西沙必利相比,无明显抑制作用。 结论 新化合物HMS-01对hERG通道无明显抑制作用,不具有心脏毒性。 Abstract:Objective To test the cardiac toxicity of new compound HMS-01 and evaluate the safety profile for clinical trials. Methods Manualpatch clamp method was used to measure human Ether-a-go-go-Related Gene (hERG) potassium channel currents with different concentrations of HMS-01. Cisapride was selected as the positive control drug. HMS-01 was diluted to the concentration of 0.3, 1, 3, 10 and 30 µmol/L and applied to the cells. The changes in electrical currents were recorded and the inhibition rate was calculated. Results At the highest concentration of 30µmol/L, the inhibitory rate of HMS-01 on hERG channel was less than 30%. There was no obvious inhibitory effect compared with cisapride. Conclusion Compared with the cisapride, HMS-01 has no obvious inhibitory effect on hERG channel and has no cardiotoxicity. -
Key words:
- manualpatch clamp method /
- HEK293 cells /
- hERG channel
-
[1] WAN J, QIN Z, LEI H, et al. Erythromycin has therapeutic efficacy on muscle fatigue acting specifically on orosomucoid to increase muscle bioenergetics and physiological parameters of endurance[J]. Pharmacol Res,2020,161:105118. doi: 10.1016/j.phrs.2020.105118 [2] 王佩. 大环内酯类抗生素的心脏毒性[J]. 药物不良反应杂志, 2000, 2(2):80-83. doi: 10.3760/j.issn.1008-5734.2000.02.003 [3] ABBOTT G W, SESTI F, SPLAWSKI I, et al. MiRP1 forms IKr potassium channels with HERG and is associated with cardiac arrhythmia[J]. Cell,1999,97(2):175-187. doi: 10.1016/S0092-8674(00)80728-X [4] SMITH P L, BAUKROWITZT, YELLEN G. The inward rectification mechanism of the HERG cardiac potassium channel[J]. Nature,1996,379(6568):833-836. doi: 10.1038/379833a0 [5] JO S H, HONG H K, JUNG S J, et al. Maprotiline block of the human ether-a-go-go-related gene (HERG) K^+ channel[J]. Arch Pharmacal Res,2007,30(4):453-460. doi: 10.1007/BF02980219 [6] EAP C B, CRETTOL S, ROUGIER J S, et al. Stereoselective block of hERG channel by (S)-methadone and QT interval prolongation in CYP2B6 slow metabolizers[J]. Clin Pharmacol Ther,2007,81(5):719-728. doi: 10.1038/sj.clpt.6100120 [7] 王玉珠. 新药临床试验前安全药理学研究的发展过程[J]. 中国临床药理学杂志, 2011, 27(7):557-560. doi: 10.3969/j.issn.1001-6821.2011.07.012 [8] 李波. 安全药理学的快速发展对创新药物研发作用巨大[J]. 中国药理学与毒理学杂志, 2015, 29(5):720-721. doi: 10.3867/j.issn.1000-3002.2015.05.034 [9] 李波. 安全药理学的国内外发展概况[J]. 中国新药杂志, 2004, 13(11):694-698. [10] 夏静. 应用膜片钳技术检测药物对HERG通道抑制作用的实验过程及要点[J]. 军事医学, 2015, 11:884-886. [11] 李春. 人胚肾(HEK293)细胞自身的钾通道[J]. 中国血液净化, 2007, 6(11):604-607. doi: 10.3969/j.issn.1671-4091.2007.11.008 [12] MOHAMMAD S, ZHOU Z, GONG Q, et al. Blockage of the HERG human cardiac K+ channel by the gastrointestinal prokinetic agent cisapride[J]. Am J Physiol,1997,273(5):H2534-H2538. [13] 元沙沙. 胃肠动力药西沙比利对表达于HEK293细胞的人ether-a-go-go相关基因2通道的影响[J]. 首都医科大学学报, 2014, 35(6):670-674. [14] ROCHE O, TRUBE G, ZUEGGE J, et al. A virtual screening method for prediction of the HERG potassium channel liability of compound libraries[J]. Chembiochem,2002,3(5):455-459. doi: 10.1002/1439-7633(20020503)3:5<455::AID-CBIC455>3.0.CO;2-L [15] REDFERN W S, CARLSSON L, DAVIS A S, et al. Relationships between preclinical cardiac electrophysiology, clinical QT interval prolongation and torsade de pointes for a broad range of drugs: evidence for a provisional safety margin in drug development[J]. Cardiovasc Res,2003,58(1):32-45. doi: 10.1016/S0008-6363(02)00846-5 [16] CAVERO I, MESTRE M, GUILLON J M, et al. Drugs that prolong QT interval as an unwanted effect: assessing their likelihood of inducing hazardous cardiac dysrhythmias[J]. Expert Opin Pharmacother,2000,1(5):947-973. doi: 10.1517/14656566.1.5.947 [17] WEBSTER R, LEISHMAN D, WALKER D. Towards a drug concentration effect relationship for QT prolongation and torsades de pointes[J]. Curr Opin Drug Discov Devel,2002,5(1):116-126. [18] 梁永志. 大环内酯类抗生素心脏毒性防治[J]. 中国实用医药, 2008, 3(5):49-50. doi: 10.3969/j.issn.1673-7555.2008.05.029 [19] 伦新强. 大环内酯类抗生素心脏毒性防治[J]. 中国药物应用与监测, 2005, 2(3):28-29. doi: 10.3969/j.issn.1672-8157.2005.03.010 -




 下载:
下载: