-
胶原蛋白主要存在于动物皮肤、骨骼和结缔组织中,是主要的结构蛋白质。胶原蛋白具有较低的免疫原性、较好的生物相容性、良好的生物降解性等生物学优点,广泛应用于生物制药、医疗保健、组织工程、食品加工、美容化妆品等领域。目前胶原蛋白主要来源于陆生牲畜(牛、羊和猪等),但某些疾病(口蹄疫、疯牛病)以及宗教相关问题,使得这些牲畜来源的胶原蛋白应用受到一定约束[1]。海洋来源的胶原蛋白资源丰富,且不存在传染性病菌和伦理等问题,因而,对海洋生物来源的胶原蛋白进行开发利用具有良好的应用前景[2]。
目前,从海洋生物提取胶原蛋白的研究主要集中在鳕鱼、罗非鱼、海参以及水母等,这些海洋生物的皮肤、肌肉、软骨组织及中胶层等部位中含有丰富的胶原蛋白[3]。水母是一类胶质状的浮游生物,属刺胞动物门,种类多,分布广,我国近海海域水母资源丰富。大型水母伞部直径可达2 m,中胶层非常厚实,其中胶原蛋白(122.64~693.92 mg/g,干重)约占总蛋白含量的50%[4]。本研究选用青岛海域采集的越前水母(Nemopilema nomurai),对其伞部胶原蛋白进行分离纯化和表征,为水母胶原蛋白的开发应用提供理论基础。
-
SCIENTZ-12N冷冻干燥机(宁波新芝生物科技股份有限公司);LA8080氨基酸自动分析仪(日本株式会社日立高新技术科学);Nicolet iS50傅里叶变换红外光谱仪(美国Thermo Scientific公司);X′Pert3 Powder X射线衍射仪(荷兰帕纳科公司);VARIOSKAN LUX多功能酶标仪(美国Thermo Scientific公司);Mini-PROTEAN Tetra System垂直电泳系统(美国BIO-RAD公司)。
-
越前水母样品采集于青岛海域,腌制后于−20 ℃保存;牛I型胶原蛋白标准品(河北考力森公司);胃蛋白酶(上海生工生物工程公司);标准蛋白Marker(日本TaKaRa公司);其余试剂均为国产分析纯。
-
提取:经腌制的水母样品用自来水清洗,去除表面盐分,4 ℃下用去离子水浸泡、洗净后,再用异丙醇去除脂肪、NaOH去除杂蛋白、过氧化氢去除色素。称取去杂水母伞盖样品,组织匀浆后加入相应体积不同浓度(0.3~0.6 mol/L)的乙酸溶液,胃蛋白酶的添加量为水母伞盖质量的0.1%~0.5%,酶消化时间为24~96 h,反应后的液体使用200目网过滤,离心(4 ℃,10000 r/min)30 min取上清即得粗提液。
纯化:①超滤:分别取粗提液5 ml至分子量10万和5万的超滤管中,4 ℃离心(4000 r/min,30 min),收集滤液进行SDS-PAGE分析。②透析:分别取粗提液5 ml到分子量5万和10万的透析袋中,4 ℃透析3 d,每8 h换一次透析液,取样进行电泳分析。③盐析:取粗提液5 ml,添加NaCl至浓度为0.9 mol/L,4 ℃下10000 r/min离心10 min,收集沉淀,复溶于0.5 mol/L乙酸溶液,重复上述过程2次,取溶液进行电泳分析。仅改变NaCl浓度(0.9 mol/L→0.9 mol/L→2.0 mol/L或2.0 mol/L→0.9 mol/L→0.9 mol/L),重复实验。
粗提液纯化后,在−80 ℃冷冻干燥得水母酶溶性胶原蛋白(PSC)。
-
以水母胶原蛋白得率(冻干胶原蛋白质量/水母干重)为指标,确定基本反应条件(乙酸浓度、料液比、胃蛋白酶用量、提取时间),每次改变其中一个条件进行水母胶原蛋白提取的单因素实验。
获得单因素数据后,设计正交实验(表1)来获取最佳的实验方案。
表 1 水母胶原蛋白提取正交实验因素水平表
水平 因素 A加酶量(%) B乙酸浓度(mol/L) C料液比 D反应时间(h) 1 0.1 0.3 1∶1 24 2 0.2 0.4 1∶2 48 3 0.3 0.5 1∶3 72 -
参照Coentro等[5]的方法检测胶原蛋白浓度,将100 μl胶原蛋白溶液添加至1 ml天狼星红色染料中静置30 min,然后以12000 r/min离心30 min。去除上清,沉淀用碱性试剂溶解30 min,取200 μl胶原蛋白液于540 nm处读数。
-
用X射线衍射仪分析胶原蛋白样品的晶体结构,X射线源为Cu靶Ka辐射(λ=0.154 nm),电流为40 mA,电压为40 kV。扫描角度2θ为5°~40°,扫描速率为3.6°/min,并根据公式λ=2d sinθ,计算d值。
-
胶原蛋白溶解于0.5 mol/L乙酸中,用多功能酶标仪检测其紫外光谱。扫描波段为200~400 nm,波长间隔为1 nm。以0.5 mol/L乙酸溶液作为空白对照。
-
取胶原蛋白5 mg和适量KBr置于研钵中,研磨均匀。取适量的混合样品于压片磨具中,用压片机制成试样薄片。将压片放入傅里叶变换红外光谱仪内进行扫描(500~4000 cm−1,分辨率2 cm−1)。
-
胶原蛋白溶液和上样缓冲液混匀后水浴(100 ℃)加热5 min,取15 μl上样,使用8%的分离胶和5%的浓缩胶,80 V电泳100 min。
-
胶原蛋白样品在110 ℃下盐酸水解24 h,水解产物12000 r/min离心20 min,上清液用氨基酸自动分析仪进行氨基酸含量测定。
-
将胶原蛋白样品溶于0.5 mol/L乙酸溶液中,配成1 mg/ml的胶原蛋白溶液,分别取10 ml溶液调配成不同pH值(3~9共7个梯度)和NaCl浓度(0.5、0.6、0.7、0.8、0.9、1.0、1.1 mol/L),10000 r/min离心,取上清液进行胶原蛋白浓度测定,并绘制变化曲线。
-
数据采用(
$\bar x $ ±s)表示,用 GraphPad Prism 8.0.2作图并对各组进行方差分析,两组间比较采用t检验。检验水准α=0.05,P<0.05有统计学意义。 -
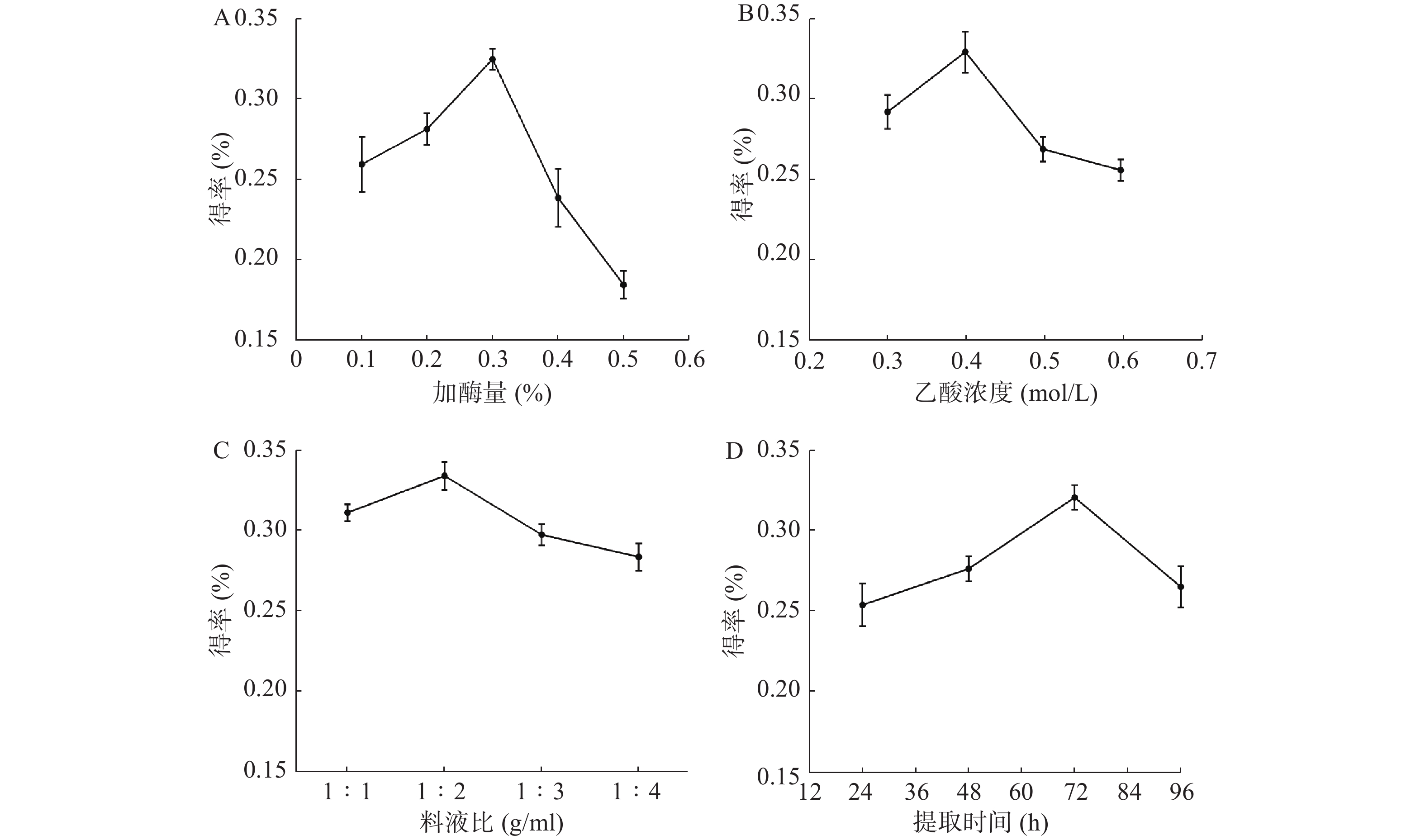
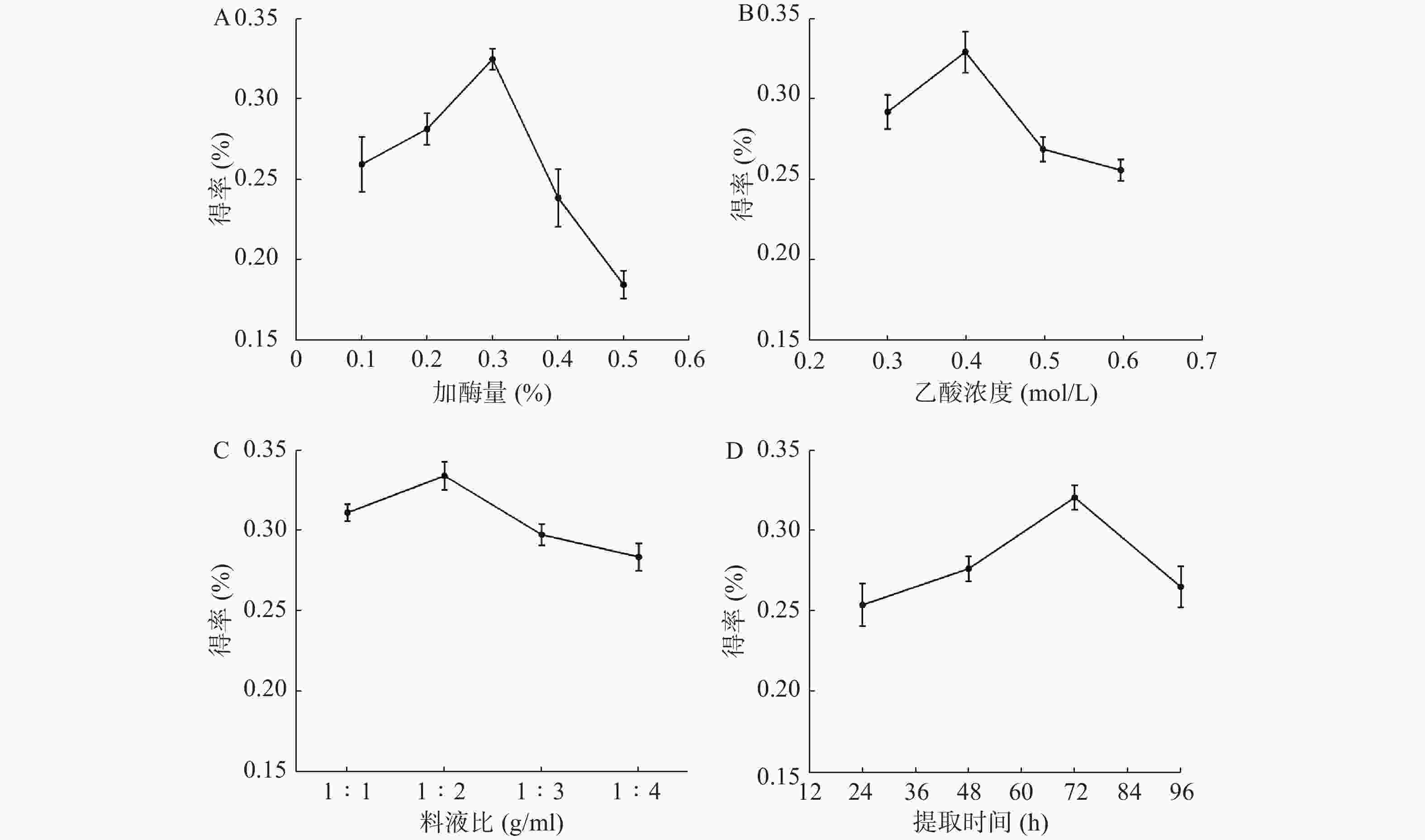
从图1A可见,当酶的用量从0.1%升到0.3%时,胶原蛋白得率逐渐增高并达到最大值。继续增加酶使用量,胶原蛋白得率反而减少,可能是过量酶对胶原蛋白具有一定破坏作用。从图1B可见,当乙酸浓度为0.4 mol/L时,胶原蛋白的得率最高。而乙酸过量,会破坏已生成胶原蛋白。从图1C可见,料液比在1∶2 g/ml时,水母胶原蛋白的得率最大。可能是料液比低于1∶2 g/ml时,胶原溶胀不充分,而料液比继续增加并没有多余胶原以供溶胀。从图1D可见,随着时间推移,胶原蛋白的得率先升高再下降:48 h和24 h相比,增加了8.8%;72 h和48 h相比,增加了15.9%;96 h和72 h相比,得率反而下降,说明72 h是胶原蛋白提取的最佳时间点。
-
表2正交实验极差R分析中,RA>RD>RC>RB,即在胶原蛋白提取中,酶的使用量起着最关键的作用,提取时间排第二,料液比和乙酸浓度的影响比较小。综合这9组数据,确定最优理论水平为A3B2C2D3,即乙酸(0.4 mol/L)、料液比(1∶2 g/ml)、胃蛋白酶(0.3%),提取72 h,此时的得率为(33±0.63)%。
表 2 水母胶原蛋白提取正交实验结果
水平 因素 A 加酶量(%) B 乙酸浓度(mol/L) C料液比(g/ml) D时间(h) 胶原蛋白得率(%) 实验1 0.1 0.3 1∶1 24 17.8±0.66 实验2 0.1 0.4 1∶2 48 23.2±0.94 实验3 0.1 0.5 1∶3 72 21.7±0.85 实验4 0.2 0.3 1∶2 72 26.7±0.58 实验5 0.2 0.4 1∶3 24 19.0±0.86 实验6 0.2 0.5 1∶1 48 24.2±0.76 实验7 0.3 0.3 1∶3 48 26.9±0.61 实验8 0.3 0.4 1∶1 72 31.1±0.50 实验9 0.3 0.5 1∶2 24 24.3±0.75 K1 20.9 23.8 24.3 20.4 K2 23.3 24.4 24.7 24.8 K3 27.4 23.4 22.5 26.5 R 6.53 1.03 2.20 6.13 因素主次 A>D>C>B 最佳组合 A3B2C2D3 -
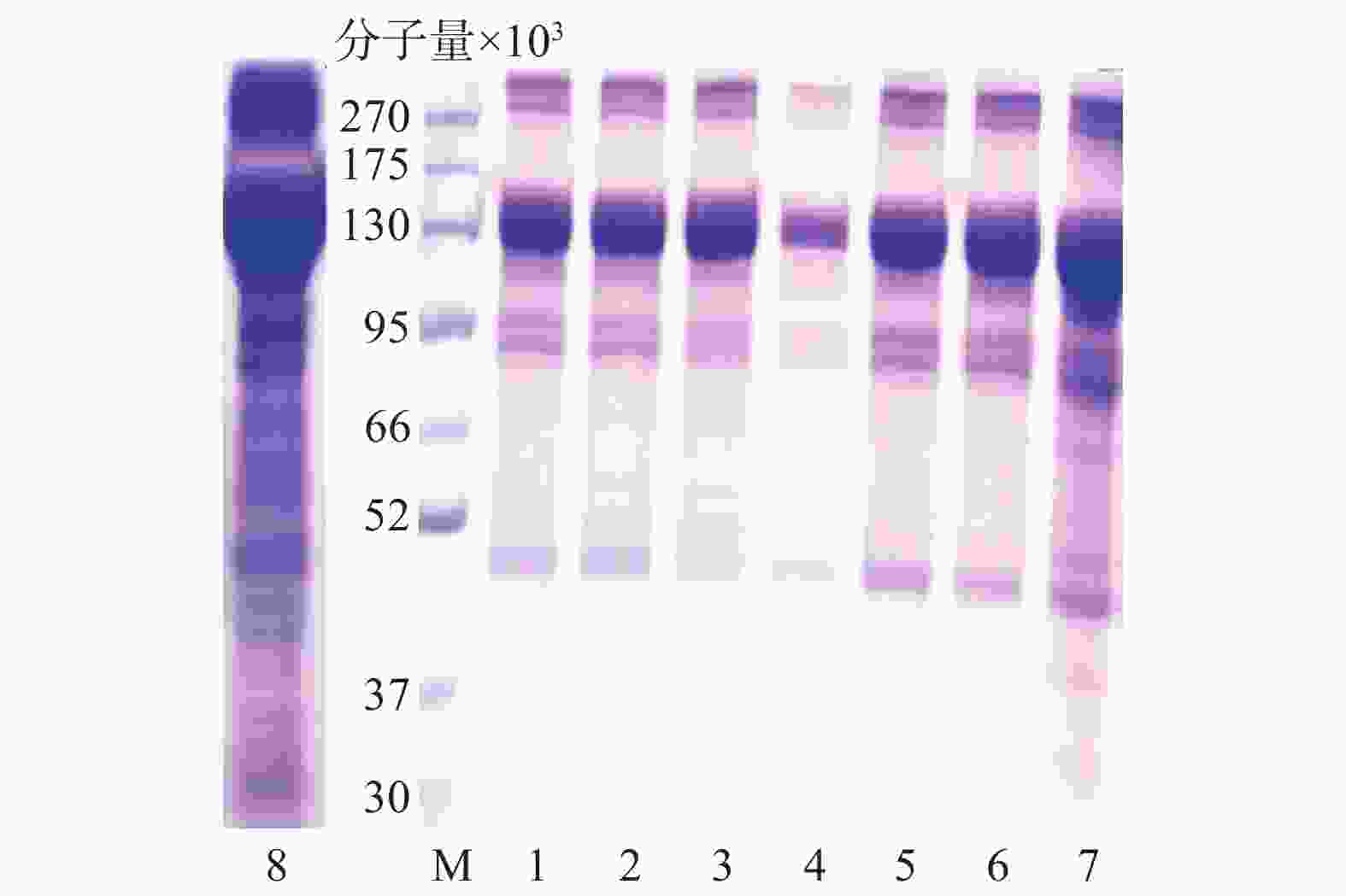
图2中水母胶原蛋白粗提物(泳道8)在分子量13万处含有大量的目标胶原蛋白,分子量10万以下有杂条带。不同规格透析袋处理(泳道1、2)后,分子量10万以下的杂蛋白部分去除;盐析结果显示,0.9 mol/L→0.9 mol/L→2.0 mol/L NaCl的盐析(泳道4)可以去除大量杂蛋白,但目标蛋白损失较多,而0.9 mol/L→0.9 mol/L→0.9 mol/L NaCl(泳道3)处理既可以保留目标蛋白又能够去除部分杂蛋白。最后超滤结果显示,分子量10万(泳道6)的超滤管可以明显减少杂蛋白含量。
-
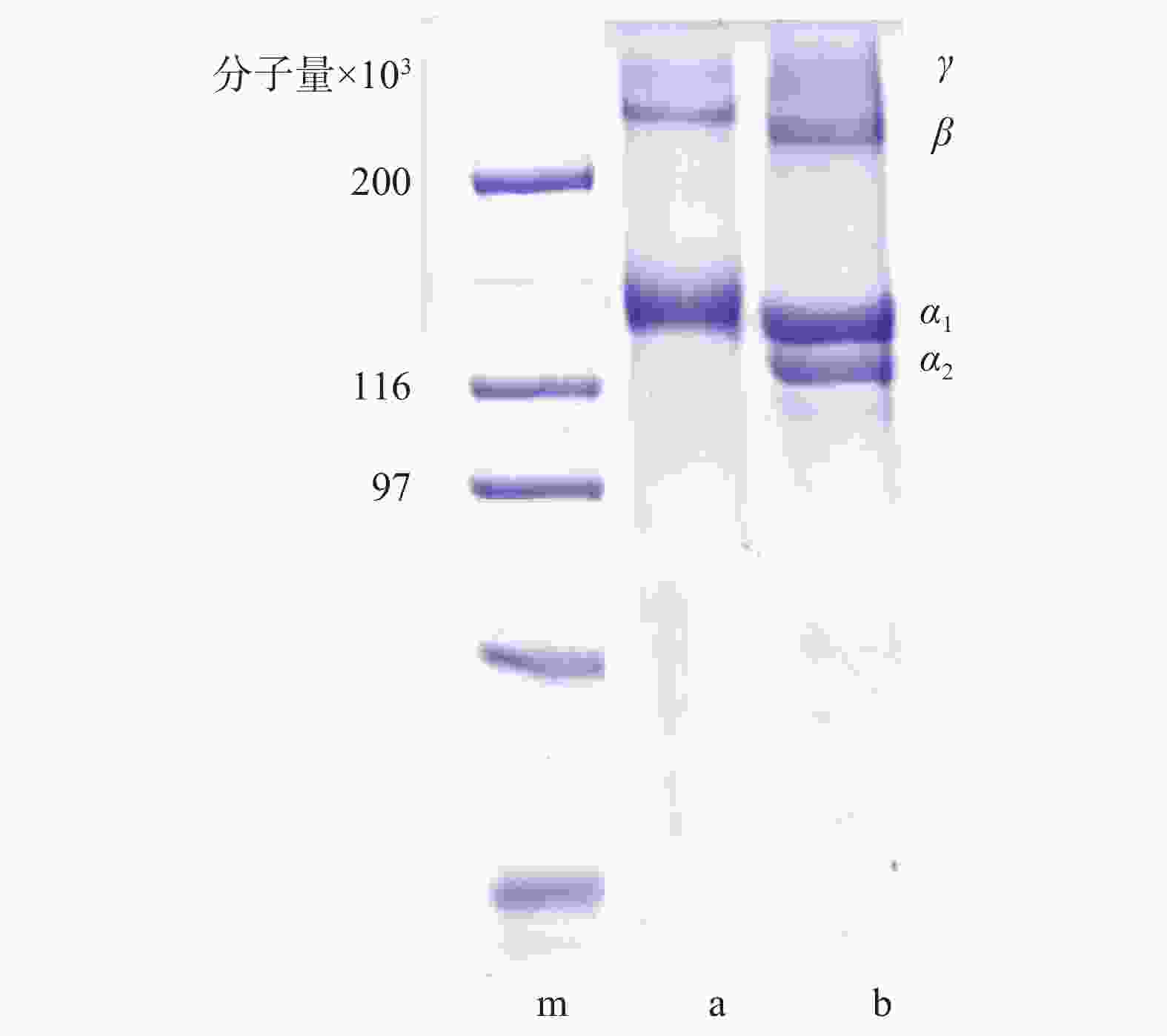
纯化实验结果提示,单一纯化方法不能完全去除杂蛋白,传统透析处理耗时长,而反复盐析会增加胶原蛋白溶液NaCl含量。综合权衡后确定纯化条件为0.9 mol/L→0.9 mol/L→0.9 mol/L NaCl盐析和100 kDa超滤组合。图3是组合纯化后胶原蛋白电泳图:泳道b为牛I型胶原蛋白标准品,在分子量13万左右有α1、α2链,而β链γ链的分子量都在20万以上。本实验提取的水母胶原蛋白(泳道a),分子量10万下基本没有杂蛋白,但α链只发现了一条,其分子可能是(α1)3[6-7],分子量在13万左右,符合I型胶原蛋白的特征。
-
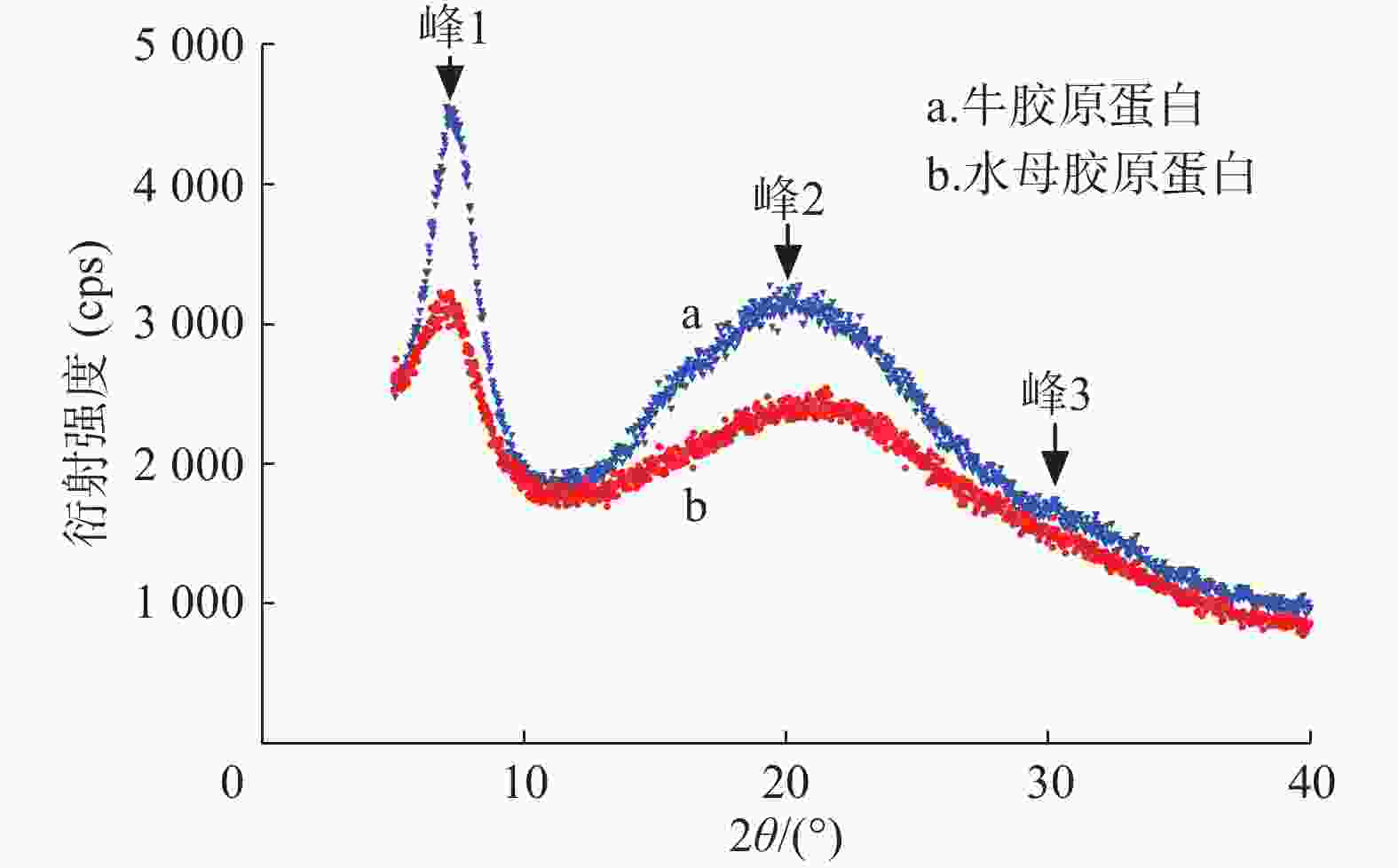
胶原蛋白X射线衍射分析结果如图4、表3所示。水母胶原蛋白和牛胶原蛋白都有3个衍射峰。峰1形状尖锐与胶原蛋白三螺旋结构有关,d值反映胶原蛋白分子链间距离[8],水母和牛胶原蛋白的d1值分别为1.244 nm和1.226 nm。在20°附近出现一个宽大峰(峰2),代表胶原蛋白纤维内部众多结构层次所引起的漫散射[9]。在30°附近出现了第3个峰(峰3),该峰较小,其d值显示三股螺旋结构中沿螺旋中心轴相邻氨基酸残基之间的距离[10],水母和牛胶原蛋白峰3的d3值分别为0.295 nm和0.296 nm,极为接近。说明水母胶原蛋白和牛胶原蛋白标准品一样,保持了完整的三股螺旋结构。
表 3 胶原蛋白X射线衍射峰对应的d值
组别 衍射峰 2θ/(°) d值(nm) 水母胶原蛋白 峰1 7.1 1.244 峰2 21.3 0.418 峰3 30.2 0.295 牛胶原蛋白 峰1 7.2 1.226 峰2 20.3 0.437 峰3 30.1 0.296 -
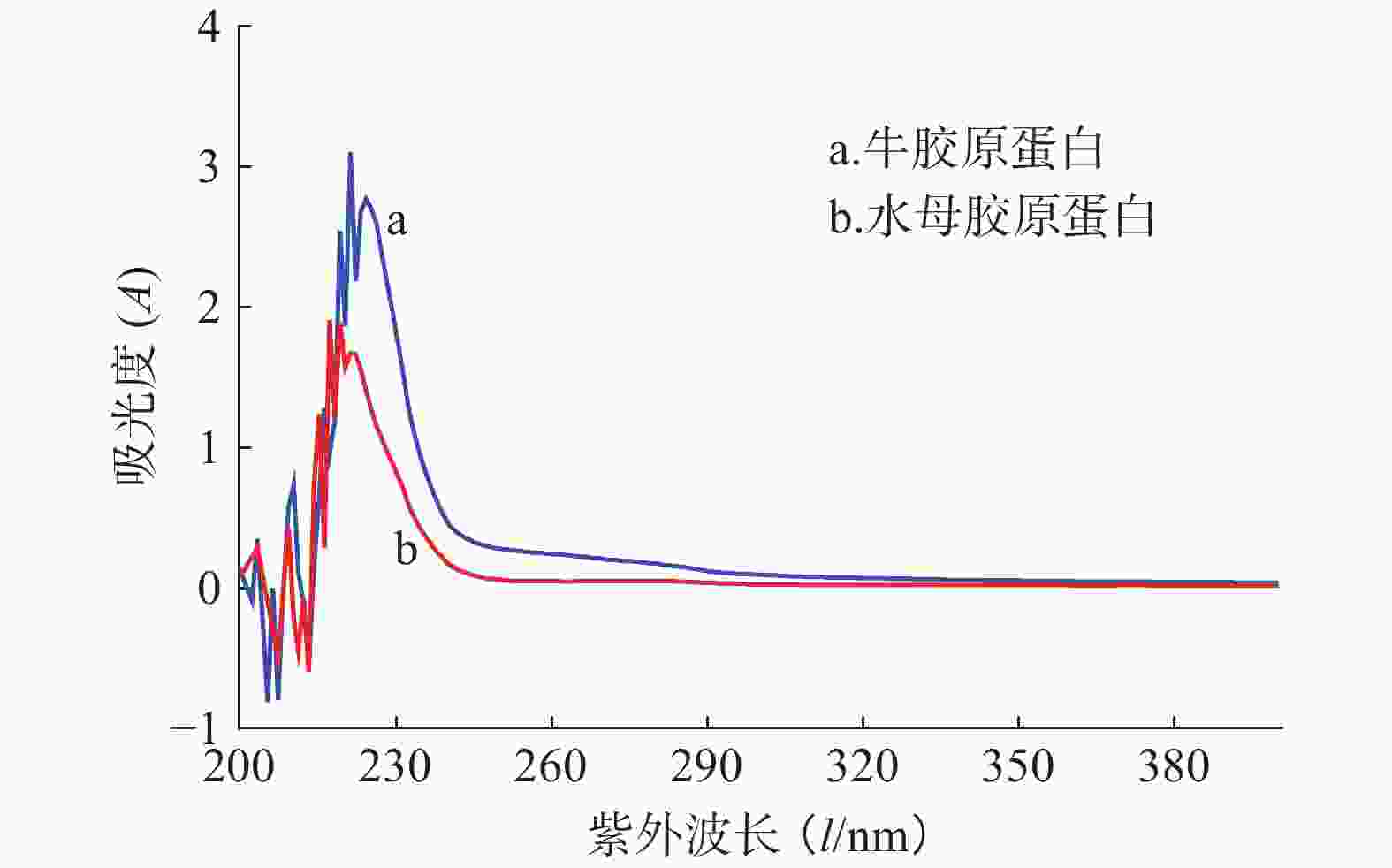
蛋白通常含有芳香族氨基酸酪氨酸、色氨酸和苯丙氨酸,这些氨基酸含有苯环共轭双键系统,在特定波长(280 nm和251 nm)处有最大吸收峰。但在胶原蛋白中这些氨基酸含量少,其紫外吸收峰主要集中在220~230 nm,主要是由羰基C=O的n→π跃迁所致。水母胶原蛋白的紫外光谱如图5所示,其最强吸收峰在220 nm处,与牛胶原蛋白吸收峰出现的位置类似,接近Ab Aziz等[11]报道的水母Rhopilema hispidum胶原蛋白紫外吸收峰(218 nm),提示本实验中提取的水母胶原蛋白纯度较高。
-
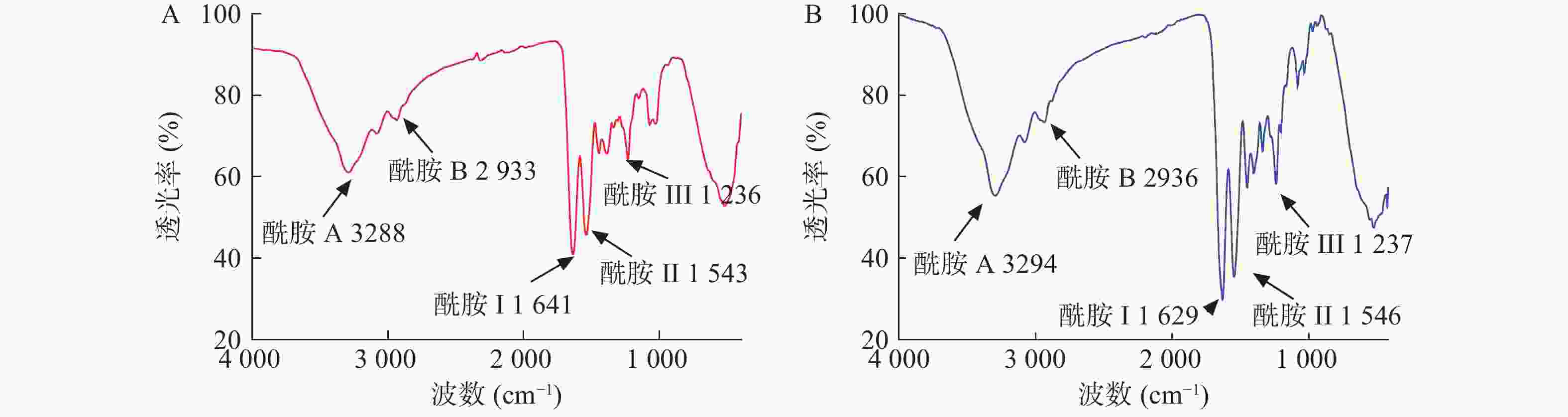
从图6可见,水母胶原蛋白酰胺A吸收峰为3288 cm−1,和Rastian等[12]检测的酰胺A(3292 cm−1)吸收峰接近,表明氢键存在于胶原蛋白结构中。胶原蛋白分子中CH2基团的不对称伸缩振动产生了酰胺B特征吸收峰[13-14],水母胶原蛋白的酰胺B在2933 cm−1处,和牛胶原蛋白的酰胺B(2936 cm−1)吸收峰类似。作为蛋白质二级结构变化的特征区域——酰胺Ⅰ带(1625~1690 cm−1),是由蛋白质肽链骨架的C=O伸缩振动产生[15],水母胶原蛋白的酰胺I带出现在1641 cm−1。水母胶原蛋白酰胺II带吸收峰出现在1543 cm−1,在胶原蛋白酰胺II带(1500~1600 cm−1)的范围内,可能是C—N键的伸缩振动和N—H弯曲振动产生。水母胶原蛋白酰胺Ш位于1236 cm−1处,主要是脯氨酸侧链和甘氨酸骨架的—CH2摇摆振动产生,提示所提取的水母胶原蛋白三螺旋结构完整性较好。
-
电泳图谱表明提取的水母胶原蛋白达到电泳纯(95%)。文献报道[16-18]天狼星红染料与胶原蛋白中的特征性结构Gly-X-Y结合,可以使用天狼星红染料对胶原蛋白进行快速检测。本实验测得每100 mg冻干的水母胶原蛋白样品中含有胶原蛋白96.85 mg,其纯度为96.85%。
-
如表4所示,水母胶原蛋白的氨基酸组成中,甘氨酸占34.8%,与云南深水鲷鱼皮胶原蛋白甘氨酸含量(35%)接近,比热带淡水鲤鱼鳞中胶原蛋白甘氨酸含量(30.6%)高[19]。水母的胶原蛋白中羟脯氨酸占6.3%,脯氨酸占8.2%,亚氨酸比例为14.5%。其脯氨酸羟基化度(羟脯氨酸含量/亚氨酸含量)为43.68%,比牛胶原蛋白标准品的羟基化度(39.92%)和Zhang等[7]提取的水母胶原蛋白的羟基化度(32.2%)都高。据文献报道[20],羟基化度越高,胶原蛋白的三螺旋结构越稳定。检测结果中还发现蛋氨酸、酪氨酸和组氨酸的含量比较低,缺乏色氨酸,这些都符合I型胶原蛋白的特点[21]。
表 4 二种胶原蛋白中不同氨基酸组分的百分比
氨基酸名称 氨基酸占比(%) 水母胶原蛋白 牛胶原蛋白 天冬氨酸Asp 7.83 4.57 苏氨酸Thr 3.55 1.73 丝氨酸Ser 4.89 3.19 谷氨酸Glu 9.98 7.27 甘氨酸Gly 34.82 34.37 丙氨酸Ala 8.36 12.46 缬氨酸Val 2.74 2.27 蛋氨酸Met 0.21 0.01 异亮氨酸Ile 1.88 1.22 亮氨酸Leu 3.09 2.64 酪氨酸Tyr 0.11 0.27 苯丙氨酸Phe 0.9 1.38 赖氨酸Lys 2.96 2.15 组氨酸His 0.29 0.48 精氨酸Arg 3.87 5.3 脯氨酸Pro 8.16 12.43 羟脯氨酸Hyp 6.33 8.26 合计 100 100 注:氨基酸分析采用氨基酸残基数占100个氨基酸残基的比例 -
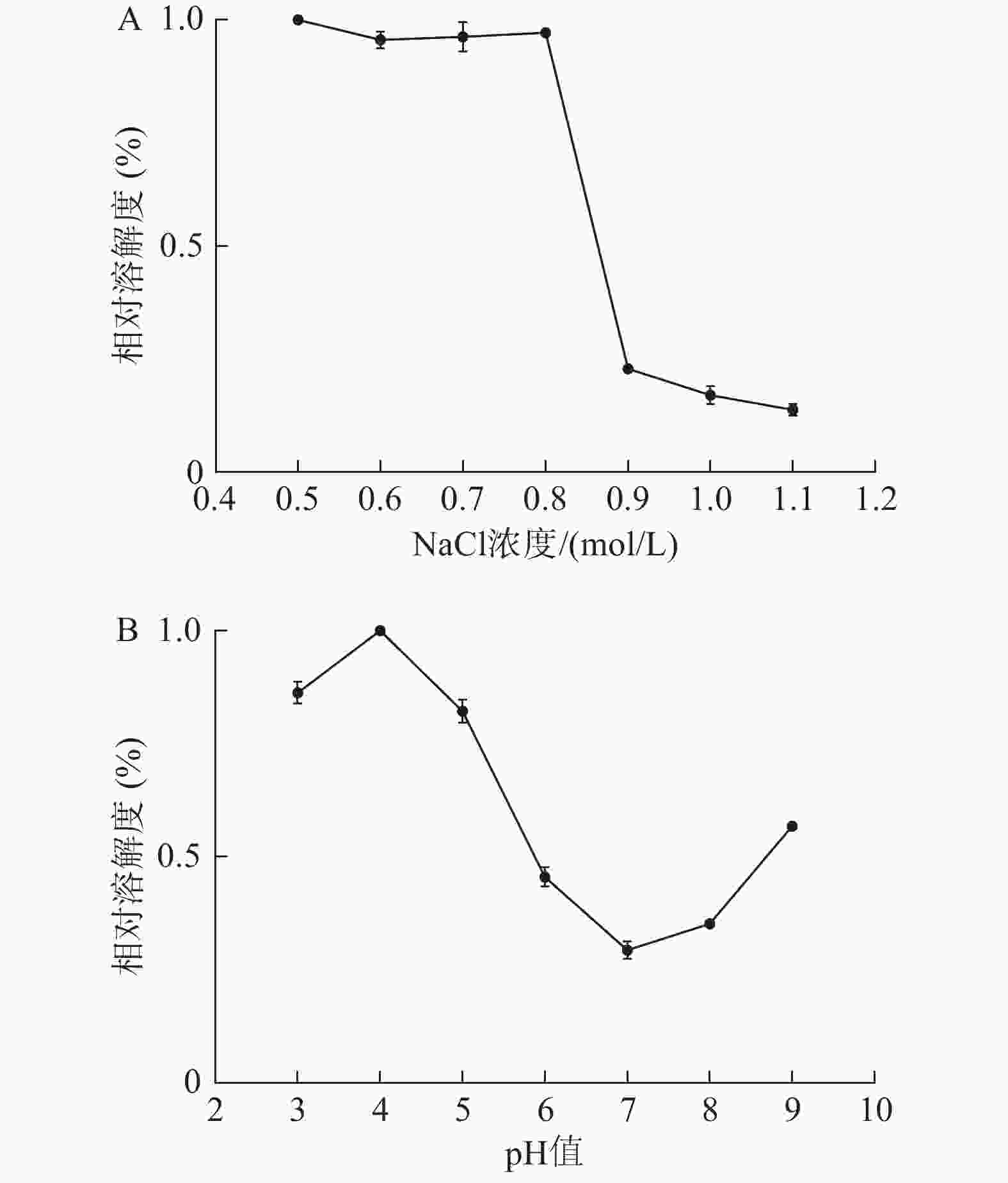
从图7A可见,当NaCl浓度在0.5~0.8 mol/L时,水母胶原蛋白相对溶解度比较稳定,保持着最大值。其原因可能是低浓度的盐离子可以与胶原蛋白分子结合,使得胶原蛋白分子带有更多的电荷,相互排斥,溶解度较大。当NaCl浓度达到0.9 mol/L时,水母胶原蛋白的溶解度急剧下降,相对溶解度不到23%,当NaCl浓度超过1.0 mol/L后,其相对溶解度在15%左右。可能因为NaCl的浓度较高时,极性较强的盐离子夺走了胶原蛋白结合的水分子,破坏了其周围的水化膜,盐析作用显现出来,溶解度下降。
从图7B可见,当溶液的pH在3~5时,水母胶原蛋白的相对溶解度比较大,维持在80%左右。其中pH为4时,溶解度最大,与海参胶原蛋白的溶解性类似[3]。当pH在6~8时,胶原蛋白的相对溶解度维持在较低值,尤以pH 7时溶解度最小,此时就是胶原蛋白的等电点。当pH超过8后,胶原蛋白溶液的溶解度又有所上升。
-
本实验通过单因素分析和正交实验优化了水母胶原蛋白的提取条件,确定最适条件为:乙酸0.4 mol/L、料液比1∶2 g/mL、胃蛋白酶0.3%、反应72 h。水母胶原蛋白的纯化方法优化为0.9 mol/L-0.9 mol/L-0.9 mol/L NaCl盐析和分子量10万超滤的组合方法。相比阳离子交换层析法和Sephacryl S-100凝胶过滤纯化方法,超滤不仅可以去除盐分和杂蛋白,还能快速富集胶原蛋白,缩短提取时间。
纯化的水母胶原蛋白通过天狼星红法检测其纯度为97%,高于从其他多种海洋生物提取的I型胶原蛋白纯度[22-23]。本实验中越前水母胶原蛋白干重得率为33%左右,相比于水母Chrysaora quinquecirrha胶原蛋白提取得率(1.2%干重)显著提高[24]。凝胶电泳显示提取的水母胶原蛋白构型可能是(α1)3,α1链分子量约为13万和10万以下基本没有杂条带,比Jankangram等[25]提取的水母胶原蛋白纯度更高。在氨基酸组成分析中,越前水母胶原蛋白甘氨酸占34.82%,羟脯氨酸占6.33%,脯氨酸占8.16%,没有检测到色氨酸。以上结果均表明水母胶原蛋白符合I型胶原蛋白的特点。光谱分析发现,分离纯化过程中水母胶原蛋白三螺旋结构保存较好。溶解度试验表明其在pH=4时溶解性最佳,当NaCl浓度升高至0.9 mol/L时溶解度快速下降。
总之,本研究通过优化提取纯化过程,缩短了水母胶原蛋白制备时间,提高了所得胶原蛋白的纯度,且水母胶原蛋白三螺旋结构保持完整,与牛I型胶原蛋白特征相似度很高,提示水母胶原蛋白可望成为哺乳动物胶原蛋白的替代品。鉴于水母胶原蛋白具有资源丰富、提取方便、生物相容性好等优点,可望成为生物医药、食品、化妆品等多领域的理想生物材料,具有良好的应用前景。
Isolation and characterization of collagen from the jellyfish Nemopilema nomurai
-
摘要:
目的 优化越前水母(Nemopilema nomurai)胶原蛋白提取工艺,并探究其性能。 方法 利用乙酸和胃蛋白酶提取胶原蛋白,通过盐析和超滤纯化水母胶原蛋白粗提物,并对水母胶原蛋白进行表征和性能分析。 结果 水母胶原蛋白纯度97%,得率33%(干重);X射线衍射、紫外光谱和傅里叶变换红外光谱检测结果表明,水母胶原蛋白在提取和纯化过程中保持了胶原蛋白三螺旋结构;氨基酸组成和凝胶电泳分析提示,水母胶原蛋白符合Ⅰ型胶原蛋白特征。溶解度实验表明,水母胶原蛋白在pH 3~5,NaCl浓度小于0.9 mol/L的条件下都具有良好的溶解性。 结论 所得水母胶原蛋白与牛Ⅰ型胶原蛋白特征相似,有望成为新的胶原蛋白资源。 Abstract:Objective To optimize the extraction process of collagen from the jellyfish (Nemopilema nomurai) and explore its characters. Methods The collagen was extracted with acetic acid and pepsin from jellyfish. The crude jellyfish collagen was purified by salting out and ultrafiltration. The purified collagen was characterized and analyzed by XRD (X-ray diffraction), UV (ultraviolet spectroscopy) and FTIR (fourier transform infrared spectroscopy). Results The purity of jellyfish collagen was 97%, the yield was 33% (dry weight). The jellyfish collagen maintained its triple helix structure during the extraction and purification process. Jellyfish collagen conformed to the characteristics of type I collagen according to amino acid composition and gel electrophoresis analysis. The jellyfish collagen exhibited a good solubility under the conditions of pH 3–5 and less than 0.9 mol/L of NaCl. Conclusion The extracted jellyfish collagen exhibited similar characteristics with bovine type I collagen and was a potential new source of collagen. -
Key words:
- Nemopilema nomurai /
- jellyfish /
- collagen /
- extraction /
- purification
-
表 1 水母胶原蛋白提取正交实验因素水平表
水平 因素 A加酶量(%) B乙酸浓度(mol/L) C料液比 D反应时间(h) 1 0.1 0.3 1∶1 24 2 0.2 0.4 1∶2 48 3 0.3 0.5 1∶3 72 表 2 水母胶原蛋白提取正交实验结果
水平 因素 A 加酶量(%) B 乙酸浓度(mol/L) C料液比(g/ml) D时间(h) 胶原蛋白得率(%) 实验1 0.1 0.3 1∶1 24 17.8±0.66 实验2 0.1 0.4 1∶2 48 23.2±0.94 实验3 0.1 0.5 1∶3 72 21.7±0.85 实验4 0.2 0.3 1∶2 72 26.7±0.58 实验5 0.2 0.4 1∶3 24 19.0±0.86 实验6 0.2 0.5 1∶1 48 24.2±0.76 实验7 0.3 0.3 1∶3 48 26.9±0.61 实验8 0.3 0.4 1∶1 72 31.1±0.50 实验9 0.3 0.5 1∶2 24 24.3±0.75 K1 20.9 23.8 24.3 20.4 K2 23.3 24.4 24.7 24.8 K3 27.4 23.4 22.5 26.5 R 6.53 1.03 2.20 6.13 因素主次 A>D>C>B 最佳组合 A3B2C2D3 表 3 胶原蛋白X射线衍射峰对应的d值
组别 衍射峰 2θ/(°) d值(nm) 水母胶原蛋白 峰1 7.1 1.244 峰2 21.3 0.418 峰3 30.2 0.295 牛胶原蛋白 峰1 7.2 1.226 峰2 20.3 0.437 峰3 30.1 0.296 表 4 二种胶原蛋白中不同氨基酸组分的百分比
氨基酸名称 氨基酸占比(%) 水母胶原蛋白 牛胶原蛋白 天冬氨酸Asp 7.83 4.57 苏氨酸Thr 3.55 1.73 丝氨酸Ser 4.89 3.19 谷氨酸Glu 9.98 7.27 甘氨酸Gly 34.82 34.37 丙氨酸Ala 8.36 12.46 缬氨酸Val 2.74 2.27 蛋氨酸Met 0.21 0.01 异亮氨酸Ile 1.88 1.22 亮氨酸Leu 3.09 2.64 酪氨酸Tyr 0.11 0.27 苯丙氨酸Phe 0.9 1.38 赖氨酸Lys 2.96 2.15 组氨酸His 0.29 0.48 精氨酸Arg 3.87 5.3 脯氨酸Pro 8.16 12.43 羟脯氨酸Hyp 6.33 8.26 合计 100 100 注:氨基酸分析采用氨基酸残基数占100个氨基酸残基的比例 -
[1] WIDDOWSON J P, PICTON A J, VINCE V, et al. In vivo comparison of jellyfish and bovine collagen sponges as prototype medical devices[J]. J Biomed Mater Res B Appl Biomater,2018,106(4):1524-1533. doi: 10.1002/jbm.b.33959 [2] SILVA T H, MOREIRA-SILVA J, MARQUES A L, et al. Ma- rine origin collagens and its potential applications[J]. Mar Drugs,2014,12(12):5881-5901. doi: 10.3390/md12125881 [3] LI P H, LU W C, CHAN Y J, et al. Extraction and characterization of collagen from sea cucumber (Holothuria cinerascens) and its potential application in moisturizing cosmetics[J]. Aquaculture,2020,515:734590. doi: 10.1016/j.aquaculture.2019.734590 [4] KHONG N M, YUSOFF F M, JAMILAH B, et al. Nutritional composition and total collagen content of three commercially important edible jellyfish[J]. Food Chem,2016,196:953-960. doi: 10.1016/j.foodchem.2015.09.094 [5] COENTRO J Q, CAPELLA-MONSONÍS H, GRACEFFA V, et al. Collagen quantification in tissue specimens[J]. Methods Mol Biol,2017,1627:341-350. [6] 李玉芬, 郑明星, 朱凡, 等. 海蜇胶原蛋白的制备及理化性质研究[J]. 福州大学学报(自然科学版), 2018, 46(2):286-294. [7] ZHANG J J, DUAN R, HUANG L, et al. Characterization of acid-soluble and pepsin-solubilised collagen from jellyfish (Cyanea nozakii Kishinouye)[J]. Food Chem,2014,150:22-26. doi: 10.1016/j.foodchem.2013.10.116 [8] SUN L L, LI B F, SONG W K, et al. Characterization of Pacific cod (Gadus macrocephalus) skin collagen and fabrication of collagen sponge as a good biocompatible biomedical material[J]. Process Biochem,2017,63:229-235. doi: 10.1016/j.procbio.2017.08.003 [9] 姚行行, 郭妍, 庄永亮. 云南鲷鱼骨胶原蛋白的制备及其理化性质[J]. 食品科学, 2018, 39(13):35-40. doi: 10.7506/spkx1002-6630-201813006 [10] DE CHEN J, LI L, YI R Z, et al. Extraction and characterization of acid-soluble collagen from scales and skin of tilapia (Oreochromis niloticus)[J]. LWT - Food Sci Technol,2016,66:453-459. doi: 10.1016/j.lwt.2015.10.070 [11] AB AZIZ N A, SALIM N, ZAREI M, et al. Extraction, anti-tyrosinase, and antioxidant activities of the collagen hydrolysate derived from Rhopilema hispidum[J]. Prep Biochem Biotech- nol,,2020:1-10. [12] RASTIAN Z, PÜTZ S, WANG Y, et al. Type I collagen from jellyfish Catostylus mosaicus for biomaterial applications[J]. ACS Biomater Sci Eng,2018,4(6):2115-2125. doi: 10.1021/acsbiomaterials.7b00979 [13] NOORZAI S, VERBEEK C J R, LAY M C, et al. Collagen extraction from various waste bovine hide sources[J]. Waste Biomass Valor,2020,11(11):5687-5698. doi: 10.1007/s12649-019-00843-2 [14] LIN X H, CHEN Y Y, JIN H X, et al. Collagen extracted from bigeye tuna (Thunnus obesus) skin by isoelectric precipitation: physicochemical properties, proliferation, and migration activi- ties[J]. Mar Drugs,2019,17(5):E261. doi: 10.3390/md17050261 [15] SONG W K, LIU D, SUN L L, et al. Physicochemical and biocompatibility properties of type I collagen from the skin of Nile tilapia (Oreochromis niloticus) for biomedical applications[J]. Mar Drugs,2019,17(3):E137. doi: 10.3390/md17030137 [16] ZHANG X, CHEN Y R, ZHAO Y L, et al. Type I collagen or gelatin stimulates mouse peritoneal macrophages to aggregate and produce pro-inflammatory molecules through upregulated ROS levels[J]. Int Immunopharmacol,2019,76:105845. doi: 10.1016/j.intimp.2019.105845 [17] RODRÍGUEZ F, MORÁN L, GONZÁLEZ G, et al. Collagen extraction from mussel byssus: a new marine collagen source with physicochemical properties of industrial interest[J]. J Food Sci Technol,2017,54(5):1228-1238. doi: 10.1007/s13197-017-2566-z [18] WALTER M N, DEHSORKHI A, HAMLEY I W, et al. Supra-molecular assembly of a lumican-derived peptide amphiphile enhances its collagen-stimulating activity[J]. Biomater Sci,2016,4(2):346-354. doi: 10.1039/C5BM00428D [19] CHINH N T, MANH V Q, TRUNG V Q, et al. Characterization of collagen derived from tropical freshwater carp fish scale wastes and its amino acid sequence[J]. Nat Prod Commun,2019,14(7):1-12. [20] BOU-GHARIOS G, ABRAHAM D, DE CROMBRUGGHE B. Type I collagen structure, synthesis, and regulation[M]//Principles of Bone Biology. Amsterdam: Elsevier, 2020: 295-337. [21] ASADUZZAMAN A K M, GETACHEW A T, CHO Y J, et al. Characterization of pepsin-solubilised collagen recovered from mackerel (Scomber japonicus) bone and skin using subcritical water hydrolysis[J]. Int J Biol Macromol,2020,148:1290-1297. doi: 10.1016/j.ijbiomac.2019.10.104 [22] ELANGO J, LEE J W, WANG S J, et al. Evaluation of differentiated bone cells proliferation by blue shark skin collagen via biochemical for bone tissue engineering[J]. Mar Drugs,2018,16(10):E350. doi: 10.3390/md16100350 [23] COELHO R C G, MARQUES A L P, OLIVEIRA S M, et al. Extraction and characterization of collagen from Antarctic and Sub-Antarctic squid and its potential application in hybrid scaffolds for tissue engineering[J]. Mater Sci Eng C Mater Biol Appl,2017,78:787-795. doi: 10.1016/j.msec.2017.04.122 [24] KRISHNAN S, PERUMAL P. Preparation and biomedical cha- racterization of jellyfish (Chrysaora Quinquecirrha) collagen from Southeast Coast of India[J]. Int J Pharm Pharm Sci,2013,5(3):698-701. [25] WICHUDA J, SUNTHORN C, BUSARAKUM P. Comparison of the properties of collagen extracted from dried jellyfish and dried squid[J]. Afr J Biotechnol,2016,15(16):642-648. doi: 10.5897/AJB2016.15210 -




 下载:
下载: