-
在正常条件下,大部分肝细胞处于静止状态(G0期),通常很少进入有丝分裂期。一旦肝细胞受到手术切除和药物等应激的刺激,它们会迅速对促分裂原产生反应,过渡到有丝分裂期,并开始增殖[1-4]。肝细胞增殖不仅是肝脏自我修复和再生的基础,也是应对慢性肝炎、肝硬化以及药物性肝损伤(DILI)等多种损害的重要机制。研究表明,肝脏出现病理性损伤后产生多种肝细胞因子,例如纤维蛋白原样蛋白(FGL1)、Hepassocin、肝细胞生长因子(HGF)等,在促进肝细胞增殖方面发挥重要作用[5-8]。例如,FGL1通过激活细胞增殖相关的信号通路促进肝细胞的再生,从而加速肝脏的修复[9]。此外,Hepassocin通过自分泌机制促进肝细胞生长[6]。这些研究提供了肝脏疾病治疗的新思路,尤其是调控这些肝细胞因子来加速肝功能的恢复。
Orosomucoid-1(ORM1),也称为α-1-酸性糖蛋白1(AGP1),作为一个已知的肝细胞因子[10],是一种主要由肝脏合成分泌的急性期蛋白,在应激条件下(如组织损伤和炎症)显著升高,具有调控细胞外基质(ECM)、调节糖代谢、维持血管通透性等重要的生物学功能[10-12]。此外,ORM1在结肠腺癌细胞、肝细胞、免疫细胞等多种细胞上,表现出促进增殖的作用[13-15]。但ORM1调控肝细胞增殖的具体作用机制尚不完全明确,有待进一步研究。
为进一步探究ORM1在肝细胞增殖中的具体作用及机制,本研究首先在两种肝细胞系上验证了ORM1促进肝细胞增殖,并通过对ORM1敲除小鼠的肝脏组织测序,挖掘ORM1调控肝细胞增殖的可能机制。本研究旨在揭示ORM1促进肝细胞增殖的潜在功能和机制,为肝脏损伤修复及相关疾病的治疗提供新的分子靶点和理论依据。
-
α1-酸性糖蛋白(美国 Sigma-Aldrich 公司)、CCK8试剂盒(Adamas life)、Lipofectamine 3000试剂(Thermo Fisher Scientific)。
-
小鼠肝癌细胞系Hepa1-6,购自中国科学院细胞库。培养液配方:DMEM、10%FBS、1%双抗生素。培养条件:5%CO2、37 ℃恒温孵育箱。人肝癌细胞系HepG2,购自武汉普诺赛生命科技有限公司。培养液配方:MEM(含NEAA)、10%FBS、1%双抗生素。培养条件:5%CO2、37 ℃恒温孵育箱。
-
细胞接种于96孔板,密度约104/孔,每组复孔为9;ORM1过表达、干扰或人源ORM给药(10、50、100 μg/ml)处理相应时间后,弃去培养基,在细胞贴壁后,使用无血清培养基处理细胞,培养相应时间后,加入CCK8试剂,吸光度测定(Epoch BioTeK酶标检测仪)450 nm处的A值,根据不同组之间的A值计算组间差异。
-
通过LipofectamineTM
3000 将ORM1过表达质粒(序列见NM_008768.2)或siRNA转染进细胞内,以实现过表达或干扰目标基因的目的。当细胞密度达到50%~70%时,进行过表达质粒的瞬时转染实验;当细胞密度达到30%~50%时,进行siRNA的瞬时转染实验。吸取舍弃原培养基后用1×PBS轻柔洗涤细胞1~2次,根据转染条件配制好转染试剂,随后将配置好含有过表达质粒(或siRNA)的DMEM培养基加入至细胞培养基中用于细胞继续培养,最后置于细胞培养箱中孵育24 h(若为转染siRNA,则孵育48 h)即可完成细胞瞬时转染试验。siRNA序列及转染试剂配制方法见表1、表2。siRNA名称 siRNA序列(5'→3') si-ORM1 CCACCAACUUGAUAAACGATT 培养皿 Opti-MEM (μl) Lipo3000 (μl) DNA转染 RNA转染 DNA (ng) P3000 (μl) RNA (pmol) 96孔板 2×10 0.3 100 0.2 20 -
使用ORM1基因敲除(KO)小鼠和对应的野生型(WT)小鼠(均为C57BL/6背景,n=6)。在小鼠24周龄时采集肝脏组织,液氮速冻并存储于−80°C。RNA-seq委托上海欧易生物公司进行,差异基因分析通过DESeq完成,筛选标准为FoldChange>1.5或<0.66,且P<0.05。
差异基因富集分析通过DAVID进行,进行Kyoto Encyclopedia of Genes and Genomes (KEGG)富集分析。KEGG分析用于揭示差异基因在代谢通路中的富集情况。富集分析筛选标准为P<0.05。
-
实验数据采用GraphPad Prism 9.0软件进行统计与分析。单因素两组之间相互比较,采用双尾非配对t检验(Student’t)检验分析;单因素多组之间相互比较,采用单向方差分析(One-way ANOVA)检验,组间均值两两比较采用Dunnett's multiple comparisons test。实验结果均采用“均数±标准误(Mean±SE)”表示。以P<0.05认为差异具有统计学意义。
-
肝脏组织在肝切除术后会进入肝细胞快速增殖状态[16]。通过检索GEO数据库,选取C57BL/6小鼠在2/3肝脏部分切除术(PH)后数据(GSE43687)进行分析。结果显示,肝脏组织中ORM1的表达在PH后1.5 h时无显著变化,在PH后12 h显著上升(图1)。这一结果提示ORM1可能参与肝脏再生过程。
-
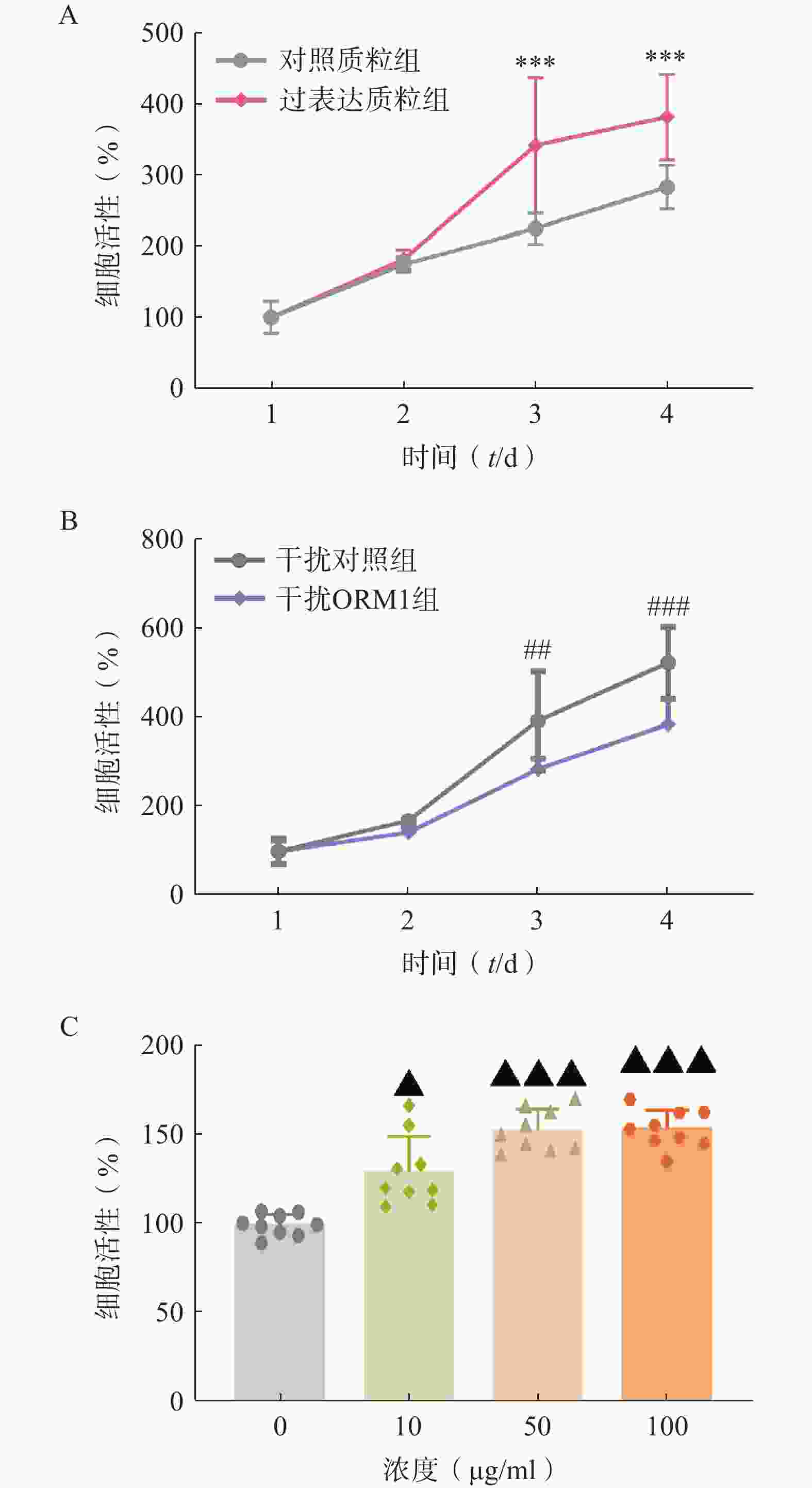
为验证ORM1对肝细胞增殖的影响,我们在小鼠和人的肝细胞系上进行了ORM1过表达、干扰或ORM外源性给药实验。在小鼠Hepa1-6肝癌细胞系过表达ORM1(pCMV-ORM1),与对照质粒组(pCMV)组相比,转染后第3、4天ORM1过表达质粒组的细胞增殖显著增加(图2A)。而干扰ORM1后细胞增殖能力呈现相反的结果(图2B)。人HepG2肝细胞上给予不同浓度外源性ORM,48 h后检测细胞增殖情况,可见随着ORM1浓度的增加,细胞增殖呈现显著上升(图2C)。上述结果表明ORM1对肝细胞增殖具有显著的促进作用。
-
为了进一步探究ORM1基因敲除后对肝脏组织的影响,我们对ORM1基因敲除(KO)小鼠和野生型(WT)小鼠的肝脏组织进行了测序。KEGG富集分析表明,在ORM1基因敲除小鼠与野生型小鼠的比较中,差异表达基因被富集在“细胞生长与死亡”和“细胞运输与自噬”等通路中(图3A),提示ORM1缺失会引起细胞生长和死亡相关的通路相关改变。
进一步信号通路的富集分析显示,PI3K-Akt、MAPK、PPAR、Hippo、Jak-Stat等通路在差异基因表达分析中有显著富集(图3B),其中,PI3K-Akt、MAPK、Hippo、Jak-Stat通路据报道与细胞增殖高度相关[17-19]。这些结果提示,ORM1基因敲除可能影响细胞增殖关键通路,通过调控细胞生长、死亡相关的基因影响肝细胞增殖。
-
为进一步明确ORM1在这些经典通路中的调控机制,我们重点分析了其中与细胞增殖相关的差异基因表达变化。在PI3K-Akt信号通路中,具有促增殖作用的Itgb8和Ntf3显著下调(图4A)。在MAPK信号通路中,同样具有促增殖作用的Map3k6在KO组中显著下调,而抑制细胞增殖作用的Gadd45a则显著上调,Hspa1b和Hspa2下调(图4B)。与之类似,Jak-Stat信号通路中的Il6ra和Lepr具有促增殖作用,其表达在KO组中也显著下调,而有抑制细胞增殖作用的Cish在KO组中的表达显著上调(图4C)。在Hippo信号通路中,具有促增殖作用的Tef7、Tead1、Ctgf在KO组中的表达显著下调(图4D)。这些结果表明,ORM1可能调控PI3K-Akt、MAPK、Jak-Stat和Hippo信号通路中的影响细胞增殖的多种关键信号分子影响肝细胞的增殖。
-
本研究中,我们揭示了ORM1在肝细胞增殖中的潜在调控机制。首先,利用GEO数据库(GSE43687)分析,发现ORM1在小鼠2/3肝切除术后12h表达升高,提示ORM1可能参与肝脏再生。而在体外肝细胞系中,过表达ORM1或外源性给药ORM,可以促进肝细胞增殖;相反,干扰ORM1抑制的肝细胞的增殖,进一步验证了ORM1对肝细胞增殖的促进作用。此外,我们对ORM1基因敲除小鼠组学分析,发现PI3K-Akt、MAPK、Hippo、Jak-Stat等细胞增殖相关通路的多个信号分子在ORM1缺失时表现出显著变化,提示这些关键通路可能参与了ORM1对肝细胞增殖的调控。
在PI3K-AKT信号通路中,Ntf3(neurotrophin-3)主要通过与受体TrkC结合,促进细胞的存活、增殖和分化[20]。ORM1缺失后Ntf3的下调可能导致细胞存活和再生能力减弱。而Itgb8(整合素β8)和Lamc2(laminin subunit gamma-2)作用类似,均是通过与细胞外基质(ECM)蛋白(如纤连蛋白、胶原蛋白等)结合,介导细胞与其周围环境的相互作用,从而影响细胞的增殖和分化[21-22]。ORM1缺失后,Itgb8和Lamc2下调提示ECM重塑减弱,从而无法为新生肝细胞的重新附着与生长提供必要的微环境支持。
在MAPK信号通路中,Gadd45a(growth arrest and DNA damage-inducible alpha)是一种生长停滞和DNA损伤诱导因子,通过抑制细胞周期相关激酶(如CDK1和CDK2),阻止细胞从G1期或G2/M期进入下个阶段[23]。ORM1缺失后Gadd45a上调提示可能出现细胞周期停滞,从而抑制了肝细胞的增殖。Map3k6(mitogen-activated protein kinase 6)作为一种激酶,通过磷酸化MAPK激酶调控下游的信号分子和后续的细胞生物学反应,如细胞增殖、分化、存活、迁移和应激反应[24]。ORM1缺失后Map3k6下调可能导致MAPK通路激活减少。Hspa1b和Hspa2是热休克蛋白,在抑制凋亡通路主要通过抑制线粒体凋亡途径,caspase的活化以及调控JNK信号通路发挥作用;同时,Hspa1b和Hspa2通过清除活性氧(ROS)和稳定线粒体功能,发挥抗氧化应激损伤的作用,进而增加细胞存活。Hspa1b和Hspa2的下调提示ORM1缺失可能削弱细胞的抗氧化应激能力,从而影响肝细胞存活[26]。
此外,Jak-Stat3信号通路激活通过诱导与细胞增殖和抗凋亡相关的基因表达,如Cyclin D1和Bcl-2,从而促进细胞增殖、存活和组织修复[27]。而Cish(cytokine-inducible SH2-containing protein)是该通路一个重要的负反馈调节因子,通过抑制Jak-Stat信号的活化,调控细胞因子信号传导的强度和持续时间,发挥抑制细胞增殖和促进细胞凋亡的作用[28]。与之相反,Il6ra是IL-6受体的亚基,IL-6结合IL-6受体后激活Jak-Stat3信号通路,诱导与细胞存活、增殖和组织修复相关基因的表达[29]。此外,Lepr(leptin receptor)是瘦素(leptin)的主要受体,该受体激活后亦可激活下游Jak-Stat3信号通路[27]。特别是在肝脏中,Lepr信号能够促进肝细胞的再生和修复能力[30]。而ORM1敲除时,Cish上调,Il6ra、Lepr下调均表明JAK-STAT通路激活减少,从而导致细胞增殖减弱。
最后,在Hippo信号通路中,Tcf7在Hippo信号通路中扮演着重要的角色,其与细胞增殖的关系主要通过YAP/TAZ的激活来实现,并参与促进细胞增殖[31],Ctgf是一种与细胞外基质(ECM)相关的结合肝素的蛋白,能够直接与整合素结合。它由成纤维细胞合成,并能促进细胞的增殖和趋化[32],ORM1敲除导致Hippo通路中Tcf7和Ctgf表达下调,可能通过解除其对肝细胞增殖的抑制作用而促进细胞增殖。ORM1缺失还导致了该通路Tead1基因的下调,而Tead1作为YAP(yes-associated protein)和TAZ的下游效应器,与YAP/TAZ结合后在细胞核中调控靶基因Birc5、Cyr61、CTGF和Myc等的表达,进而促进细胞增殖、抑制细胞凋亡,并推动组织生长和再生[33]。
本研究阐释了ORM1可能通过调控PI3K-Akt、MAPK、Hippo、Jak-Stat等信号通路发挥促进肝细胞增殖的作用。提示ORM1可能通过影响肝细胞存活、ECM重塑等一系列复杂机制调节肝细胞增殖过程。未来研究应进一步探讨ORM1在这些信号通路中的具体调控机制,特别是在不同病理条件下如何影响肝细胞的增殖、凋亡以及组织修复,为肝脏疾病的治疗提供新的潜在靶点。
Exploration of the role and mechanism of ORM1 in promoting hepatocyte proliferation
doi: 10.12206/j.issn.2097-2024.202410014
- Received Date: 2024-10-14
- Rev Recd Date: 2025-02-25
-
Key words:
- ORM1 /
- hepatocyte proliferation /
- mechanism of action /
- signaling pathway
Abstract:
| Citation: | YANG Jinrun, LI Xiang, SUN Yang. Exploration of the role and mechanism of ORM1 in promoting hepatocyte proliferation[J]. Journal of Pharmaceutical Practice and Service. doi: 10.12206/j.issn.2097-2024.202410014 |











 DownLoad:
DownLoad:


