-
骨骼肌约占人体重的35%,是人体内最大的器官系统之一,为人体提供运动所必须的产能,储能以及帮助调节体温[1]。骨骼肌具有强大的再生能力,这对肌肉损伤后修复及其他导致肌病具有重要意义[2]。已经有许多研究报道非肌源性细胞在再生过程中起到关键作用,比如以髓系为代表的免疫细胞被募集到损伤部位对肌肉修复发生产生影响[3]。最近的文献进一步揭示髓系细胞中单核细胞及巨噬细胞在骨骼肌再生反应中起到关键作用[4]。
随着流式分析仪器和试剂的进步,多色流式实验目前已被广泛应用[5]。多色流式细胞术的优势在于能够同时使用多个标记物进行单个细胞层面研究,分析组织中不同细胞群之间的关联性,同时也可以减少样本用量,提高样本检测通量,提高实验效率[6]。特别是在免疫细胞的研究方面,多色流式可以最大程度的同时检测样本中的不同免疫细胞表面蛋白表达程度,并直观的以降维分析方式展现出来,具有广阔的应用前景[7]。
本研究采用流式细胞仪对小鼠损伤腓肠肌的单细胞悬液进行数据采集。同时应用t-分部邻域嵌入算法(t-SNE)[8]和手动圈门分析所得结果,为流式数据分析和结果展示提供一种新的方法和思路。
-
雄性C57BL/6J(B6)同系小鼠用于小鼠骨骼肌流式分析实验。实验小鼠来自中国同济大学实验动物中心。所有动物实验遵守动物伦理指南,已获海军军医大学药物实验伦理委员会批准。
-
流式抗体为FITC标记的CD11b、APC-A700标记的F4/80、APC-A750标记的MHC II、PB450标记的Ly6G,BV610标记的CD45、BV650标记的CD11c、PE标记的Ly6C,抗体均购自美国Biolegend公司。Ⅱ型胶原酶购自瑞士Roche,心脏毒素购自美国MCE。
-
流式细胞仪(Beckman CytoFLEX S,美国),离心机(湘仪,中国)。
-
使用1%的戊巴比妥钠麻醉小鼠,假手术组对小鼠腓肠肌注射50 μl生理盐水,模型组对小鼠腓肠肌注射50 μl 10 μmol/L的心脏毒素,均在损伤7 d后处死小鼠。
-
颈椎脱臼法处死小鼠,使用酒精棉球擦拭消毒小鼠腿部表面后解剖小鼠,从两条腿上分离出腓肠肌。将其放入20 mm培养皿中,加入5 ml提前预冷的磷酸盐缓冲液(PBS)。使用锋利的剪刀将腓肠肌剪碎,加入浓度为5 mg/ml的Ⅱ型胶原酶5 ml,置于37 ℃孵箱孵育60 min。孵育后将细胞悬液通过40 μm尼龙筛网过滤,转移至新的15 ml离心管中。4 ℃,800×g离心5 min,弃掉上清液,将所得沉淀转移至5 ml流式管中,加入100 μl PBS重悬,即为腓肠肌单细胞悬液。
-
用PBS将细胞浓度调节至每100 μl约1×107个细胞。每100 μl液体中0.5 μl流式抗体,4 ℃孵育45 min。孵育后4 ℃,800×g离心5 min。弃掉上清液,用200 μl PBS重悬细胞,上机检测。
-
流式数据应用FlowJoTM v10.8.1流式分析软件(购自美国BD公司)对小鼠腓肠肌细胞进行数据分析。数据分析与图形呈现通过GraphPad Prism软件执行。实验数据主要以平均值±标准误(Mean±SEM)形式展示,两个独立样本之间采用t检验(t-test)进行两组样本的比较。P<0.05表示有显著性差异。
-
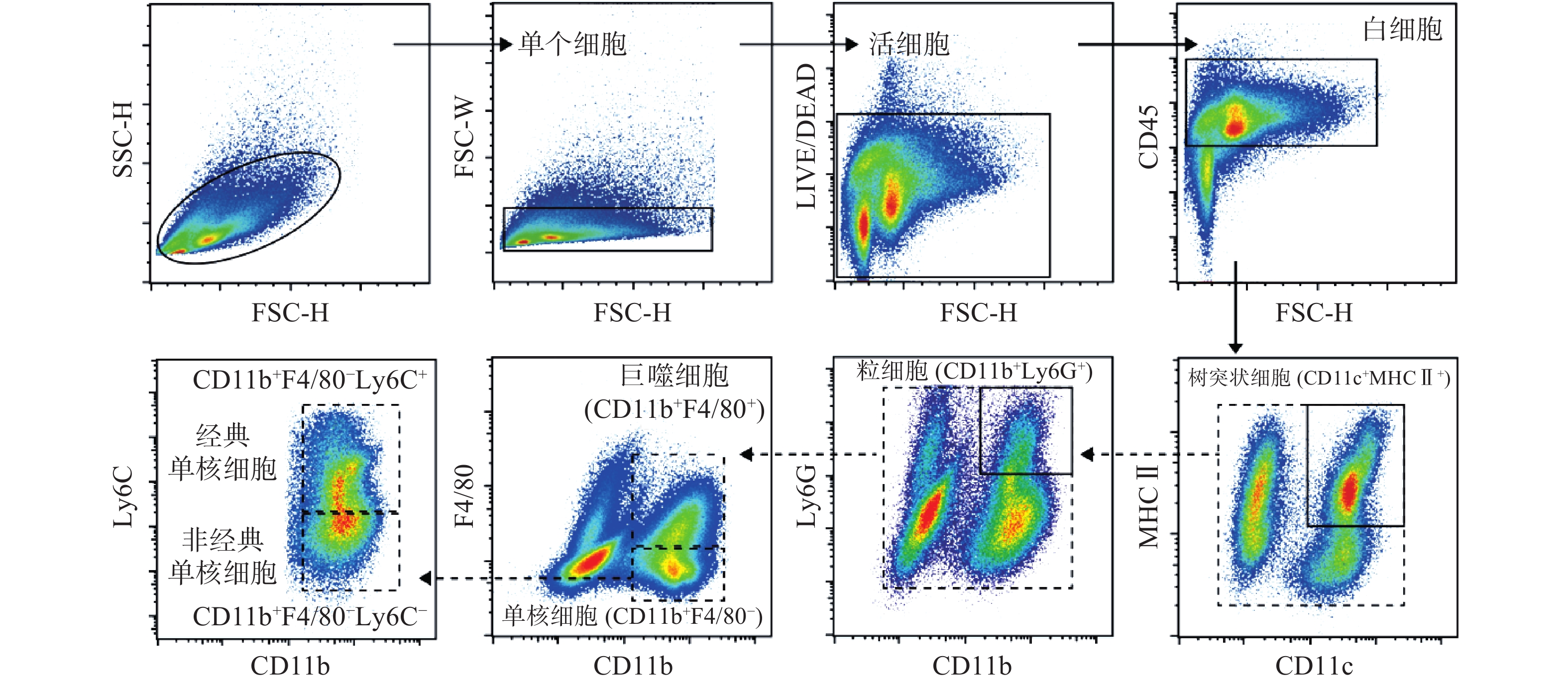
使用流式细胞术检测小鼠腓肠肌单细胞悬液中单核细胞圈门策略如图1所示。首先通过FSC-H和SSC-H圈出主要细胞群,根据FSC-H与FSC-W去除粘连细胞,通过LIVE/DEAD圈出活细胞。CD45用于圈选出白细胞群,结合CD11c、MHCⅡ、CD11b、F4/80、Ly6C和Ly6G圈选出CD11c阳性与MHCⅡ阳性树突状细胞、CD11b阳性与Ly6G阳性粒细胞、CD11b阳性与F4/80阳性巨噬细胞,Ly6C阳性单核细胞。各散点图中细胞分群界限清晰,流式圈门设置合理,为后续进一步的 t-SNE分析与手动圈门分析提供良好的数据基础。
-
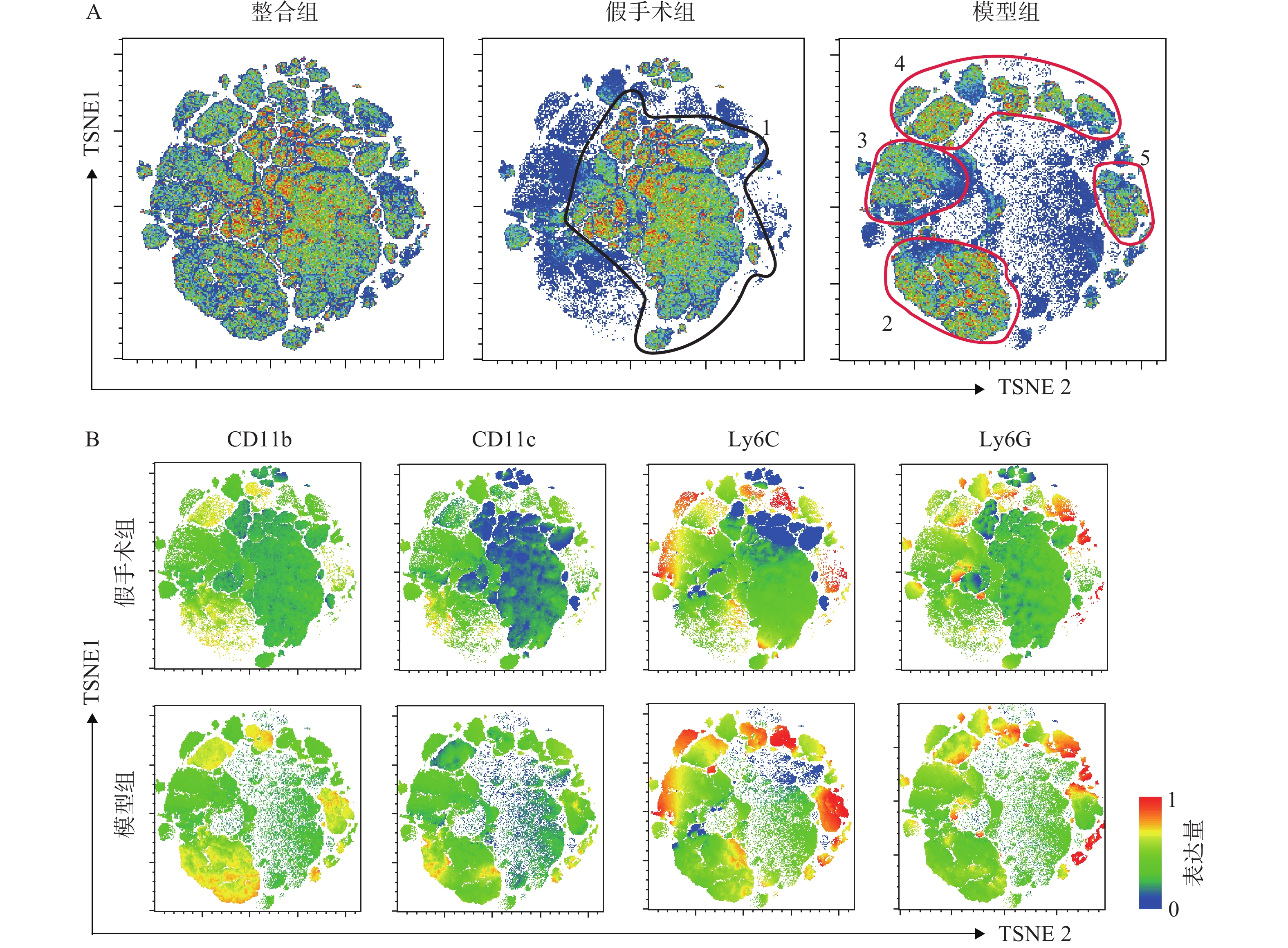
将经流式细胞仪采集的小鼠腓肠肌免疫细胞(CD45阳性)数据进行降维分析。如图2所示,每一个点对应一个细胞,图2B中根据荧光通道表达强弱进行着色,分别表征CD11b、CD11c、Ly6G和Ly6C的表达水平。t-SNE降维分析将高维的细胞数据以二维平面的方式直观呈现出来,这种形式不同于以往流式分析中的逐级圈门方式,能将各群细胞的抗原表达情况更加准确全面,直观地展现出来[8]。通过图2A可以看出假手术组与模型组的腓肠肌中免疫细胞构成发生了明显变化,假手术组主要以黑色圆圈1标志的细胞群为主,而在模型组中,主要以红色圈2、3、4、5标志的细胞群为主。结合图2B中CD11b、CD11c、Ly6C和Ly6G表达水平图,可以发现红色圆圈3、4、5细胞群高表达Ly6C,揭示造模后的免疫细胞浸润主要以高表达Ly6C的阳性细胞为主,同时模型组中的CD11b、CD11c、Ly6G表达水平明显高于假手术组,提示模型组炎症水平高于假手术组。总体来看,t-SNE分析结果直观明了地反映了细胞群体之间的相互关系和整体情况,为下一步手动圈门分析提供了指引方向。
-
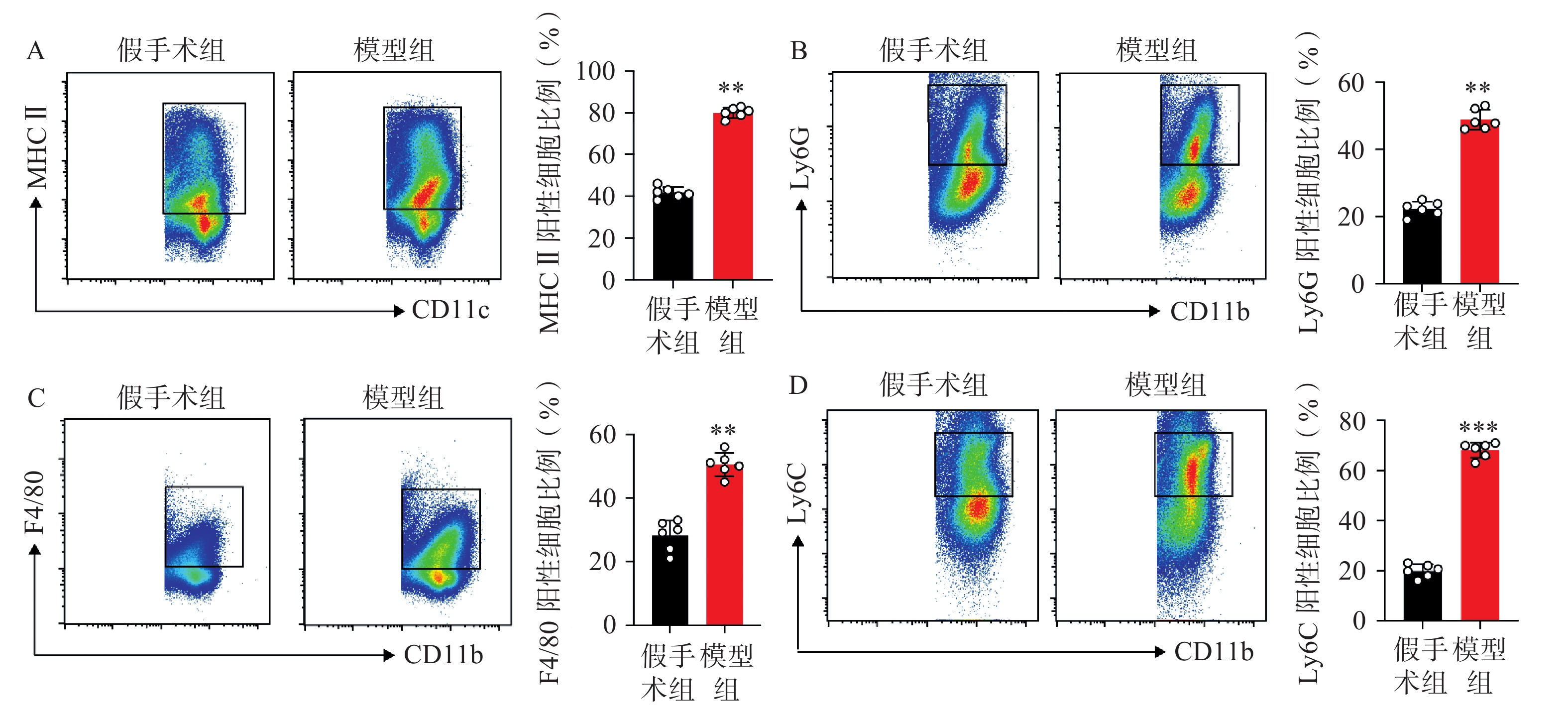
对小鼠CD45阳性免疫细胞进行进一步手动圈门分析,得到各细胞类型具体占比。如图3所示,从CD11c阳性细胞群中手动圈门发现模型组中MHCⅡ阳性树突状细胞比例显著高于假手术组(图3A);与假手术组相比,模型组中Ly6G阳性粒细胞占CD11b阳性细胞比例显著增加(图3B);F4/80阳性巨噬细胞占CD11b阳性细胞在模型组中显著增加,与前期的tSNE结果一致。值得注意的是,与假手术组相比,在CD11b阳性F4/80阴性细胞群中手动圈出的Ly6C阳性单核细胞群与树突状细胞、粒细胞和巨噬细胞相比,在模型组中增加比例最为明显。以上结果表明在肌肉损伤模型7 d后的模型中以树突状细胞、粒细胞、单核细胞、巨噬细胞为代表的髓系细胞免疫细胞浸润依然明显,并且在这之中单核细胞增加比例最多。
-
骨骼肌对很多生理病理造成的损伤有强大的修复能力[1],肌肉损伤修复是一个需要多类细胞协同合作的复杂过程[9-12],其中非肌源性细胞,特别是免疫细胞对损伤过程修复的干预有着十分重要的意义[10]。本文主要用流式细胞仪对小鼠骨骼肌部分髓系细胞进行分析,为后续的流式分选及单细胞测序实验指引了方向。
随着流式分析试剂和仪器的进步,多色流式实验已经广泛应用于各项研究,同传统2~3色的流式实验相比,多色流式能够同时使用多个标记物对单个细胞进行研究,分析多个细胞群之间的关联性,更全面地展示整体免疫微环境的变化。流式细胞数据分析常见软件包括Flowjo、FACS Diva、CytoBank等,可以为诸如细胞表型、荧光蛋白、细胞周期、细胞凋亡、细胞增殖、磷酸化蛋白检测、活性氧检测等提供便捷专业的分析。其中,FlowJo是较早为流式分析设计的软件,有多类插件可供选择,能将数据以csv文件导出,给后续的生物信息学分析提供了极大的便利。降维分析相较于传统的逐级圈门方法,减少了人为圈门引入的误差,通过整体分析也更有助于发现新的细胞群体和获得更为直观的整体表达情况。目前随着流式细胞术的不断深入发展,流式数据分析方法也不断更新,结合降维分析的方法为多色实验和单细胞测序实验都奠定了一定的基础。然而,降维方法本身并不能确认结果的正确与否,同时引入手动圈门也可能引入更大的人为误差。t-SNE虽然能够将高维数据以二维形式展示,但在降维过程中不可避免地会丢失部分信息,可能导致某些细胞群体的特征被忽略。除此之外,降维结果十分依赖于参数的设置,不同参数设置往往会导致结果差异巨大。因此,在使用这些方法时一定要根据数据本身的特性进行合适的参数选择,确保保留并尽可能多地提取到数据中有效信息。操作过程中,研究人员应通过多次实验和参数调优来找到最佳设置,以便最大限度地减少信息丢失和偏差。同时,结合其他分析方法,如统一流形逼近与投影法(UMAP)或主成分分析(PCA)等,通过对比不同降维方法的结果,进一步提高数据的可靠性和全面性。这不仅能提高对相关生物过程的理解,还能为未来的研究提供更为坚实的基础。
T-SNE能够将高维数据有效地降维成二维展示,使得复杂的细胞群体关系变得更加直观和易于理解。这种方法特别适用于大规模细胞数据的分析,如免疫细胞群体的分类和功能研究。在目前的研究中,t-SNE降维结合手动圈门的方法不仅提高了细胞群体的分辨率,还能更精确地捕捉到细胞间的微小差异。这对于理解骨骼肌损伤修复过程中不同髓系细胞的角色和动态变化具有重要意义。未来,这种方法可以进一步应用于其他生物医学领域,如肿瘤微环境分析、自身免疫疾病研究以及再生医学等。此外,随着机器学习和人工智能技术的发展,t-SNE等降维方法有望与这些技术结合,实现对流式细胞数据的自动化和智能化分析。这不仅能提高数据处理的效率,还能减少人为误差,提供更加客观和可靠的分析结果。本研究关注的小鼠髓系细胞是肌肉损伤修复的重要基础,但缺乏其他非肌源性细胞比如纤维成脂祖细胞(FAPs)、淋巴细胞、血管内皮细胞(VEC)等信息,展示肌肉损伤的微环境还不够全面。在未来的研究中,将把以上的细胞群体一并纳入分析,基于流式细胞术与生物信息学结合,推动研究更往深层次发展。
总的来说,自动降维分析可以将高维数据转换为低维空间,从而直观地对细胞进行聚类和分群。与此同时,手动圈门分析提供了对特定细胞群的精细控制和确认,可以根据已知的生物学标志物或功能特性对细胞进行分类和验证。这种方法的灵活性和直观性有助于深入理解细胞群的特征和功能。通过结合这两种分析方法,我们不仅可以获得全局性的细胞分布和关系图景,还能在具体的细胞群层面上进行精细化分析,能够提高数据解读的准确性和深度,从而更好地揭示生物学研究中的复杂现象,具有深远的科研意义。
Multicolor flow cytometric analysis method for skeletal muscle myeloid cells based on unsupervised automatic dimensionality reduction combined with manual gating
doi: 10.12206/j.issn.2097-2024.202404077
- Received Date: 2024-04-21
- Rev Recd Date: 2024-07-15
-
Key words:
- muscle regeneration /
- multicolor flow cytometer /
- bioinformatics /
- myeloid cells
Abstract: Objective To explore the analytical methods combining multicolor flow cytometry with bioinformatics techniques for analyzing myeloid cells in the gastrocnemius of mice after muscle injury, and provide an experimental foundation for the study of muscle regeneration mechanisms.
| Citation: | CAO Qi, ZHANG JiaBao, WANG Pei. Multicolor flow cytometric analysis method for skeletal muscle myeloid cells based on unsupervised automatic dimensionality reduction combined with manual gating[J]. Journal of Pharmaceutical Practice and Service. doi: 10.12206/j.issn.2097-2024.202404077 |








 DownLoad:
DownLoad: