-
结直肠癌(CC)发生率占所有肿瘤发生率的第3位,病死率仅次于肺癌,属于下消化系统恶性肿瘤[1]。目前,结肠癌的治疗主要采用多学科的综合治疗模式[2]。包括5-氟尿嘧啶、奥沙利铂与贝伐珠单抗等的组合[3-5]。然而,这些常规的化疗方案可能造成患者不耐受以及骨髓等的抑制。因此,寻找新的有效的药物对于现今结肠癌治疗具有重要意义。
紫杉醇(PTX)是一种广谱抗肿瘤活性的化疗药物,来源于太平洋紫杉树皮(红豆杉)[6,7]。临床试验结果表明,PTX在几种癌症治疗中有较好的活性,包括:乳腺癌、皮肤恶性肿瘤、非小细胞肺癌以及卵巢癌等[8,9]。然而,由于结肠癌中过表达的P糖蛋白(P-gp)引起了多重耐药性(MDR),导致PTX对结肠癌临床治疗效果不甚理想[10]。此外,PTX生物半衰期短,其一代药物Taxol以聚氧乙烯蓖麻油为表面活性剂,具有引起患者过敏反应的风险,从而限制了PTX临床疗效的发挥[11]。因此,迫切需要对PTX进行结构改进与剂型设计,改善其药物递送效率,提高生物利用度[12]。
脂肪酸作为生物膜和生物信号分子的重要成分,参与了细胞能量产生、代谢的过程。由于肿瘤细胞增殖快速,需要大量的细胞合成物质和能量的供应,因此,患有恶性肿瘤的患者其脂肪酸合成也较快。其中,肿瘤细胞因为迅速繁殖对含有16个碳原子的棕榈酸(PA)为主的脂肪酸需求量大,因此利用PA进行修饰有利于药物被肿瘤细胞摄取[13,14]。再者,研究发现,由PA修饰的紫杉醇,能降低其对P-gp的亲和力,避免了PTX进入肿瘤细胞后的外排,提高紫杉醇对于结肠癌治疗的有效性[15]。
此外,作为一种成熟的药物载体,脂质体(Lip)在体内可被降解、无毒性和免疫原性,能够增强药物在体内的稳定性,从而可以减少给药剂量、降低毒副作用,并且其表面具有可修饰性[16],例如,采用聚乙二醇磷脂(PEG-DSPE)修饰的脂质体因其空间位阻效应可延长其在体内的循环时间[17]。同时结合肿瘤组织的增强通透性和滞留效应(EPR),使药物通过被动靶向递送到靶部位[18]。
结合以上背景,本研究首先通过棕榈酸酯与紫杉醇共价键结合构建紫杉醇棕榈酸酯(PTX-PA),并建立基于高效液相(HPLC)的定量分析方法,旨在降低其对P-gp的亲和力,避免PTX进入肿瘤细胞后被外排,从而改善紫杉醇毒性较大、生物半衰期短、成药性差等问题,提高紫杉醇对于结肠癌治疗的有效性。其次,我们将PTX-PA包载进PEG修饰的脂质体构建紫杉醇棕榈酸酯的脂质体(PTX-PA/Lip),以实现其长循环,增加PTX的疗效、降低其毒副作用。最后,采用工艺筛选与单因素处方优化的方法制备最佳PTX-PA/Lip,为PTX-PA的制剂学研究奠定基础[19]。
-
高效液相色谱仪(安捷伦科技有限公司,美国);十万分之一电子天平(MS105DU,梅特勒托利多公司,瑞士);超滤管(30 kD,密理博公司,美国);低温高速离心机(Eppendorf-200,艾本德公司,德国);高压均质机(NanoGenizer,美国);Zeta-sizer Nano粒度仪(Nano-ZS,马尔文公司,英国)。
-
紫杉醇购自江苏红豆杉生物科技股份有限公司,纯度≥98%;棕榈酸购自中国医药集团上海化学试剂公司,纯度≥99%;蛋黄卵磷脂(PC98-T)、胆固醇、DSPE-PEG 2000均购自上海艾韦特医药科技有限公司;1-(3-二甲氨基丙基)-3-乙基碳二亚胺(EDC)、4-二甲氨基吡啶(DMAP)、乙酸乙酯、二氯甲烷、无水乙醇、石油醚均购自中国医药集团上海化学试剂公司,分析纯;乙酸乙酯、PC-98T蛋黄卵磷脂(上海艾韦特医药科技有限公司);胆固醇(上海艾韦特医药科技有限公司);二氯甲烷、DSPE-PEG 2000(上海艾韦特医药科技有限公司);无水乙醇、石油醚购自中国医药集团上海化学试剂公司;甲醇购自美国默克公司,色谱纯。
-
PTX-PA前药由PTX与PA发生酯化反应合成,其合成过程如下[20,21]:精密称取PTX 0.85 g,加入无水二氯甲烷 30 ml。依次加入精密称取的EDC 0.19 g、DMAP 0.15 g和PA 0.31 g,在氮气保护下室温搅拌反应12 h。反应结束后,用5%柠檬酸水溶液、饱和食盐水洗涤3遍,旋蒸除去有机溶剂,即得PTX-PA粗品。采用石油醚和乙酸乙酯通过柱层析法对PTX-PA进行分离、纯化。洗脱完成后,将产物旋蒸去除有机溶剂,得到的白色固体即为PTX-PA,样品经核磁共振氢谱、碳谱确定为PTX-PA,样品纯度98.5%。
-
精密取适量的PTX-PA粉末,采用甲醇溶解,定容,通过全波长(190~400 nm)扫描测定其紫外最大吸收波长λmax。
本实验采用Agilent Eclipse plus C18色谱柱(4.6 mm×250 mm,5 μm),流动相采用甲醇/水(95∶5,V/V),进样量20 μl,流速1.0 ml/min。
-
空白溶液的配制:精密量取不含药的空白脂质体1 ml加入适量的甲醇溶液,超声,用甲醇定容至25 ml,0.45 μm的微孔滤膜过滤,滤液即为空白溶液。
对照品溶液的配制:精密称取PTX-PA 粉末50 mg,用甲醇溶解并定容至50 ml,过滤,即得PTX-PA对照品储备溶液。
供试品溶液的配制:精密量取1 ml PTX-PA/Lip,加入适量甲醇溶解、超声破乳、定容至25 ml,过滤,滤液即为供试品溶液。
-
分别取适量空白溶液、对照品溶液和供试品溶液,用流动相稀释至适当的浓度后,按照“色谱条件”中建立的高相液相参数进行进样分析。
-
精密量取适量PTX-PA对照品储备液依次稀释为浓度1、5、10、25、50、100 μg/ml的PTX-PA系列浓度。按照“色谱条件”中的高效液相参数进行进样分析(n=5),并记录不同浓度的PTX-PA的色谱峰面积。以浓度(C)为X轴、峰面积(A)为Y轴进行回归。
-
日内精密度考察:精密吸取3种不同浓度(5、25、100 μg/ml)的 PTX-PA对照品溶液,对同一浓度溶液连续进样5次,每次10 µl,按照“2.2.1”项下色谱条件进行分析,记录各个浓度吸收峰面积。
日间精密度考察:精密吸取3种不同浓度(5、25、100 μg/ml)的 PTX-PA对照品溶液,对同一浓度溶液连续进样5 d,每天1次,每次10 µl,按照“2.2.1”项下色谱条件进行分析,记录第0、1、2、3、4天的吸收峰面积,计算样品浓度,考察仪器的日间精密度。
-
空白脂质体超声破乳,配制成3种不同浓度(1、10、100 μg/ml),连续进样5次,每次10 µl,记录各吸收峰面积,考察重复性。精密吸取浓度为50 μg/ml的 PTX-PA供试品溶液,于0、2、4、6、8、12、24 h进样测定,每次进样10 µl,记录各紫外吸收峰面积,考察样品的稳定性。
-
空白脂质体超声破乳,分别加入浓度为1 mg/ml的PTX-PA溶液0.5、2.5、5 ml,采用流动相稀释定容至100 ml,分别进样,并结合PTX-PA的理论浓度(5、25、50 μg/ml)进行加样回收率的计算与分析。
-
(1) 薄膜分散法
精密称取PTX-PA 20 mg、蛋黄卵磷脂350 mg、胆固醇5 mg和DSPE-PEG2000 25 mg,加入适量的二氯甲烷使其充分溶解。然后旋蒸除去有机溶剂,使圆底烧瓶底部形成一层均匀透明的薄膜,再加入预热至同等温度的重蒸水10 ml,震荡、水化,得PTX-PA/Lip粗品。将得到的粗品经探头超声(1 min)、过滤处理后,即得PTX-PA/Lip纳米给药系统[19]。
(2) 高压均质法
将薄膜分散法制得的PTX-PA/Lip粗品置于高压均质机中,经3次均质处理后(均质压力12 000 psi),即得PTX-PA/Lip纳米给药系统[23,24]。
(3)挤出法
将薄膜分散法制得的PTX-PA/Lip粗品置于挤出器中,使分别经过孔径为0.2、0.1、0.05 μm的聚碳酸酯膜,即得PTX-PA/Lip纳米给药系统[25-27]。
-
(1)磷脂种类的选择
采用薄膜分散法考察不同磷脂制备的PTX-PA/Lip,包括:氢化磷脂(HSPC)、蛋黄卵磷脂(PC98-T)、蛋黄磷脂(EPCS)、二棕榈酸磷脂酰胆碱(DPPC),以形态、粒径、包封率为指标进行评价。
(2)磷脂和药物/胆固醇比例的考察
分别以磷脂和药物的质量比(5∶1、10∶1、20∶1、30∶1、40∶1)/PC98-T和胆固醇的质量比(4∶0.05、4∶0.1、4∶0.2、4∶0.3、4∶0.4、4∶0.5)为自变量制备PTX-PA/Lip脂质体,考察不同处方的粒径、粒径分布、包封率,确定处方中磷脂与药物/胆固醇的质量比。
(3)药物和DSPE-PEG2000比例的考察
以PTX-PA和DSPE-PEG2000的质量比(1∶0.5、1∶1、1∶1.5、1∶2、1∶2.5)为自变量,考察其用量对制剂的外观澄明度、纳米粒子大小等是否产生影响。
(4)薄膜蒸发法的温度考察
将旋转蒸发仪温度分别设置为35、40、45、50、55 ℃,考察薄膜蒸发过程中温度对PTX-PA/Lip形态、粒径、包封率等的影响。
(5)探头超声时间的考察
以探头超声PTX-PA/Lip粗品的时间为自变量,考察不同超声时间(30、60、90、180、240 s)对PTX-PA/Lip纳米制剂形态、纳米粒子大小的影响。
-
数据采用IBM SPSS Statistics 27.0进行统计分析,采用单因素方差分析ANOVA进行显著性检验与评价。
-
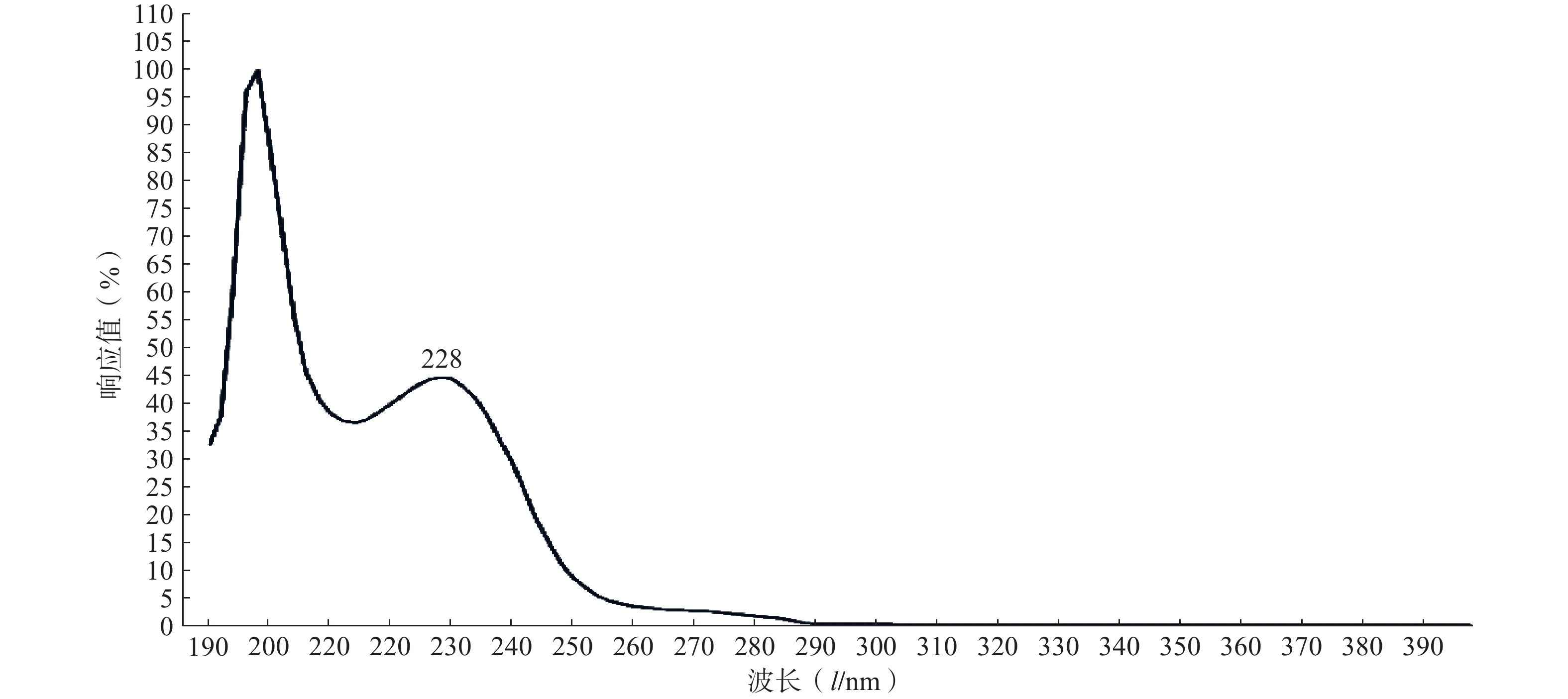
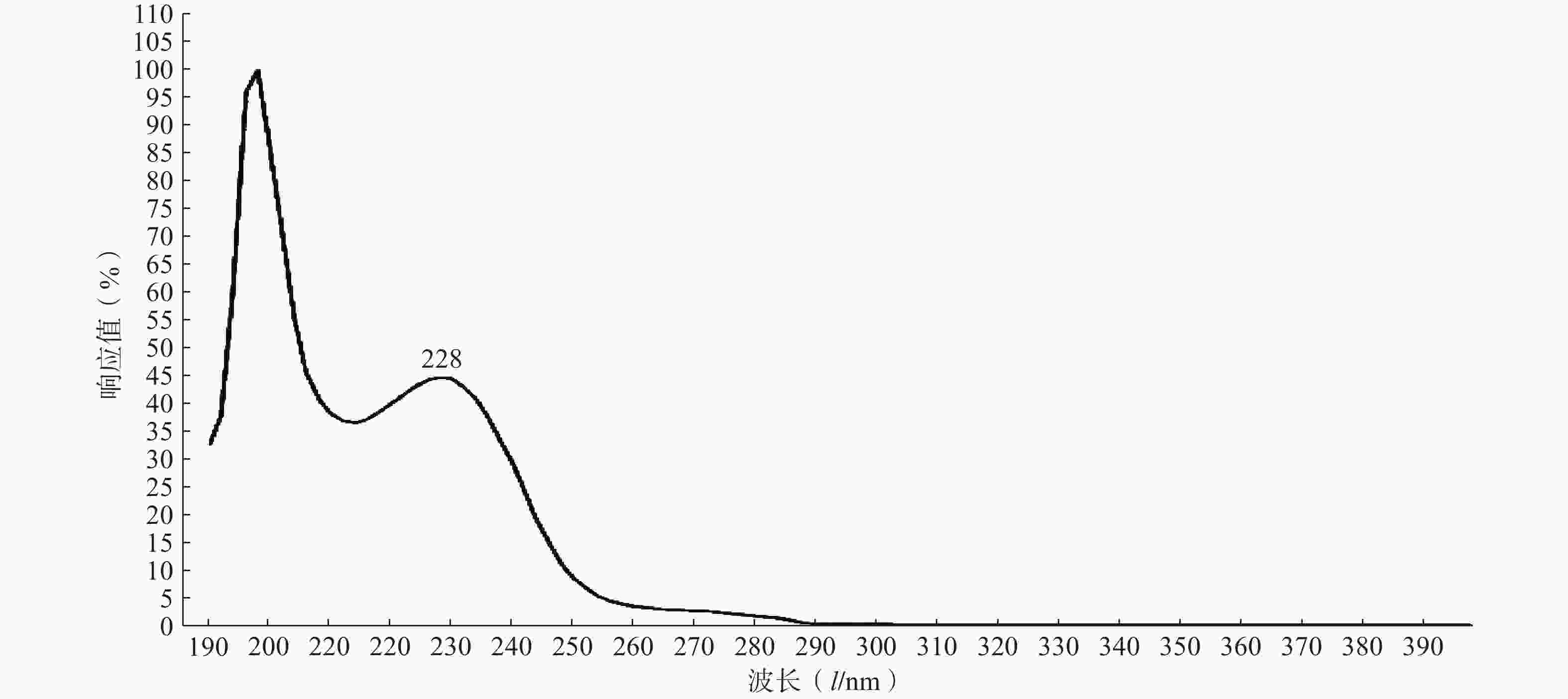
实验结果如图1所示,选用PTX-PA的最大吸收波长为228 nm为测定波长。
-
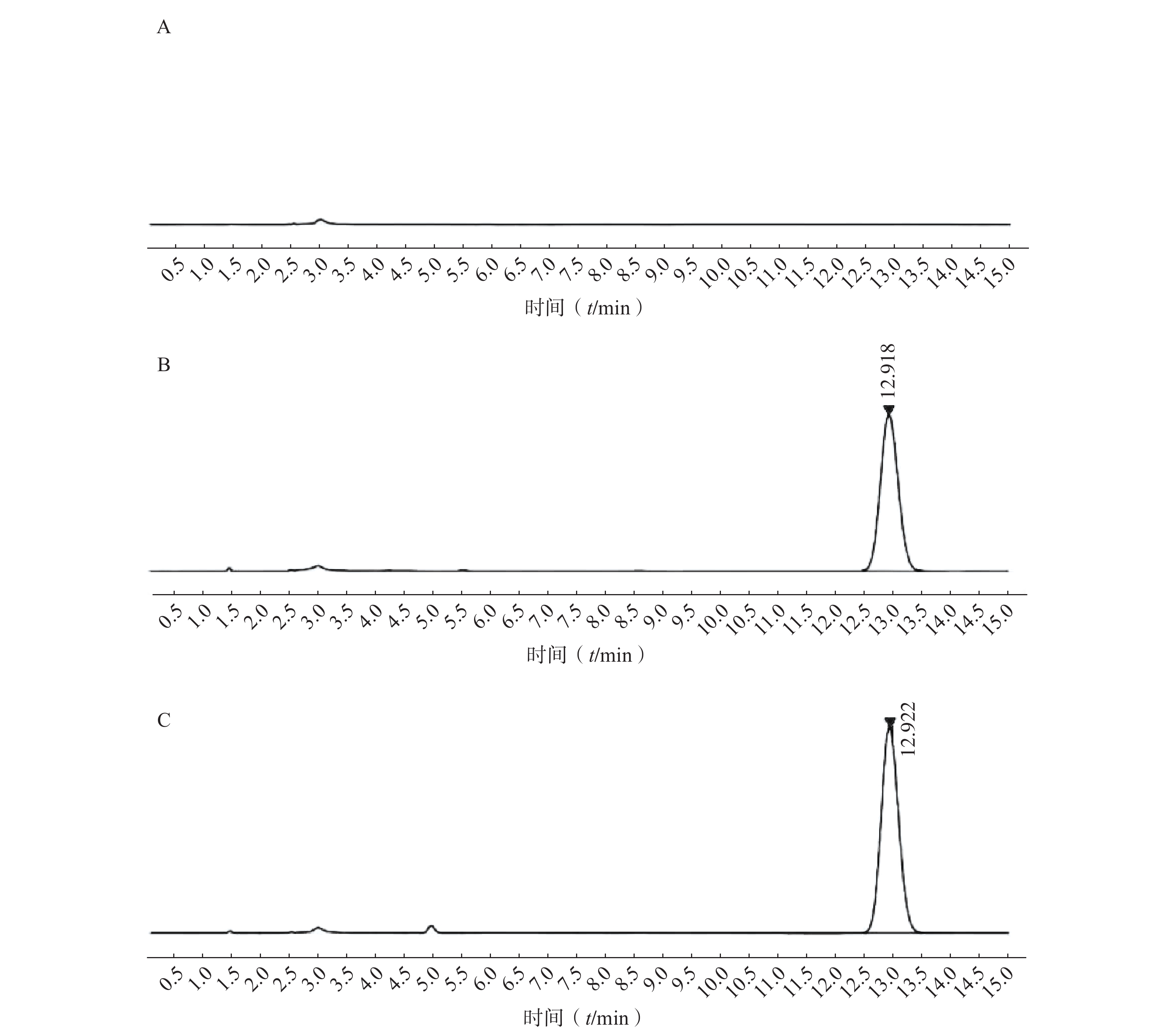
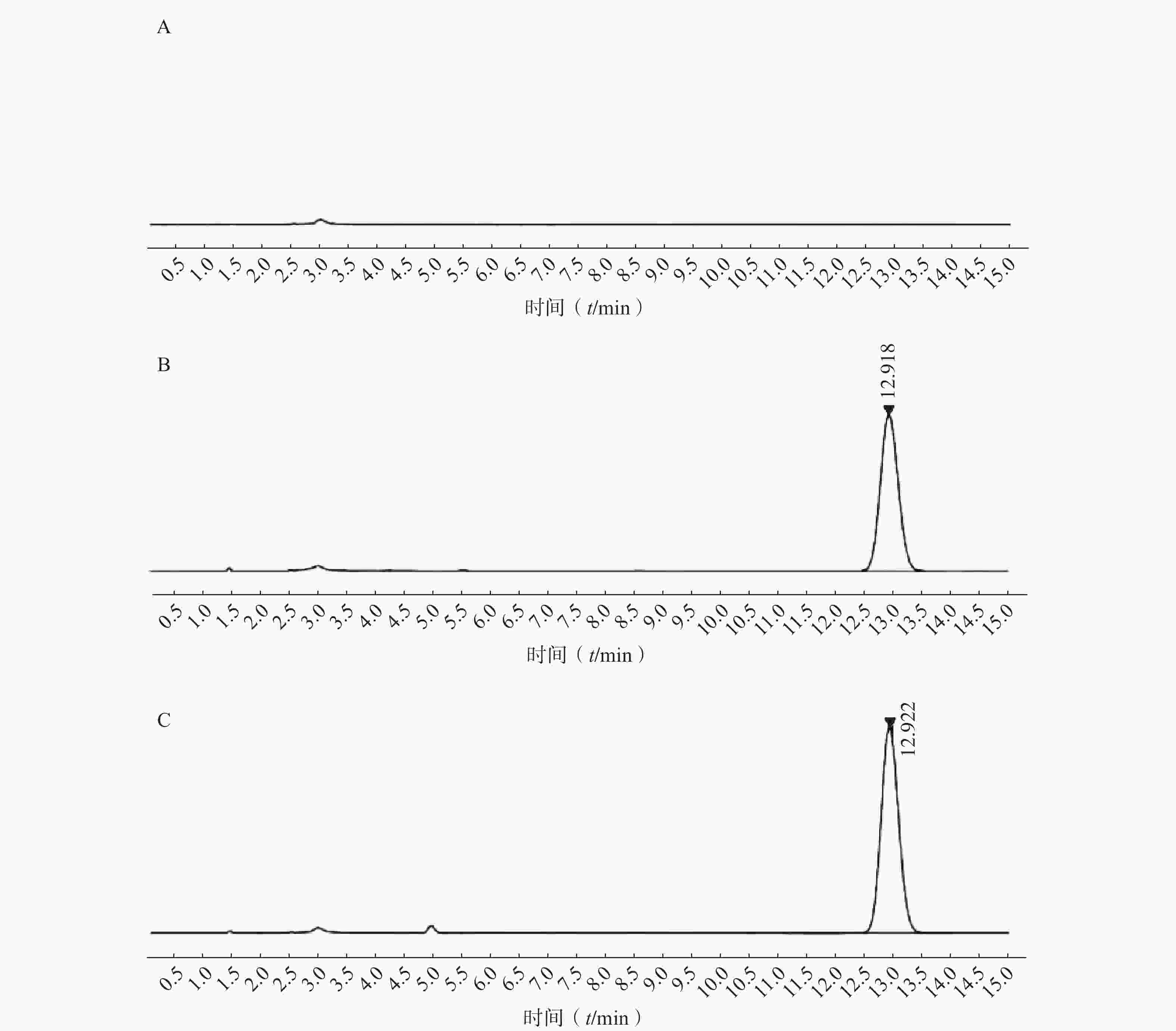
如图2所示,本章所建立的色谱条件对PTX-PA检测具有专属性,溶剂以及样品中的辅料对PTX-PA的检测不产生干扰。
-
按照2.2.4方法进行回归,得PTX-PA的吸收峰面积-浓度在1~100 μg/ml的浓度范围内为线性方程:A=15.14 C+10.81(r=0.999 8)。
-
按照2.2.5方法进行精密度考察,结果如表1所示,日内与日间精密度各时间点峰面积的RSD均小于3%,表明仪器的日内与日间精密度符合测定要求。
理论浓度(μg/ml) 实测浓度(μg/ml) RSD(%) 日内 5.00 4.98±0.13 2.65 25.00 25.30±0.55 2.18 100.00 99.66±1.11 1.11 日间 5.00 4.99±0.11 2.31 25.00 25.50±0.57 2.23 100.00 100.65±1.38 1.37 -
按照2.2.6方法进行研究,精密吸取3种不同浓度的 PTX-PA溶液,连续进样5次并记录各吸收峰面积。各浓度峰面积RSD均<3%,表明仪器符合检测检测要求。此外,稳定性结果表明,样品溶液峰面积的RSD为0.81%,表明制备的PTX-PA溶液在24 h内稳定。
-
按照2.2.7方法计算加样回收率,结果如表2所示:低、中、高3个浓度的加样回收率均在95%~105%之间,且RSD分别为2.39%、1.80%、2.34%,表明本实验建立的高效液相色谱定量方法可用于PTX-PA的含量测定。
理论浓度(μg/ml) 检测浓度(μg/ml) 回收率(%) RSD(%) 5 5.02±0.12 100.4 2.39 25 24.98±0.45 99.92 1.80 50 50.01±1.17 100.02 2.34 -
采用不同方法制备的PTX-PA/Lip表征结果如表3所示,按照2.4方法进行统计学分析,3种制备方法的包封率无显著性差异,但采用薄膜分散法制备的PTX-PA/Lip粒径与PDI更小。因此,本研究优选薄膜分散法来构建PTX-PA/Lip。
制备方法 粒径(l/nm) PDI 包封率(%) 薄膜分散法 76.76±3.39 0.104±0.02 79.38±2.00 高压均值法 125.11±5.32 0.139±0.03 78.87±2.00 挤出法 128.87±4.92 0.239±0.05 81.38±1.11 -
(1)磷脂种类的选择
按照2.3.2(1)制备的PTX-PA/Lip表征结果如表4所示,以PC98-T为膜材制备的纳米给药系统粒径小、外观澄明、粒径分布均匀、包封率较高,因此选择PC98-T作为本研究中的磷脂。
磷脂种类 外观 粒径(l/nm) PDI 包封率(%) PC98-T 半透明 76.76±3.39 0.104±0.02 79.38±2.00 HSPC 有沉淀 177.86±5.39 0.532±0.08 59.06±1.32 EPCS 半透明 135.12±5.65 0.108±0.03 73.23±1.15 DPPC 有沉淀 158.26±4.11 0.669±0.05 53.27±2.68 (2)磷脂和药物比例的考察
按照2.3.2(2)项下确定处方中药物和磷脂的用量,其结果如表5所示,磷脂PC98-T和药物的质量比大于10时,制备的PTX-PA/Lip外观澄明度、粒子大小、粒径分散系数等参数无显著性差别。随着磷脂浓度不断增加,药物的包封率不断增加,当PC98-T和PTX-PA的质量比为20∶1时,脂质体对药物的包封率最高,后期考虑到经济成本,将PC98-T和PTX-PA的质量比定为20∶1。
磷脂∶药物 外观 粒径(l/nm) PDI 包封率(%) 5∶1 略透明 134.62±2.95 0.364±0.04 58.15±1.73 10∶1 有沉淀 90.29±4.66 0.151±0.04 71.56±1.60 20∶1 半透明 84.58±1.33 0.11±0.02 83.50±0.92 30∶1 半透明 86.06±2.71 0.09±0.05 73.44±4.44 40∶1 有沉淀 88.86±1.91 0.199±0.05 68.37±11.08 (3)磷脂和胆固醇比例的考察
按照2.3.2(2)方法研究,结果如表6所示,随着胆固醇用量增多,制剂变浑浊,粒径增大,载药量显著降低。因此,胆固醇不加入本制剂的处方中。
磷脂∶胆固醇 外观 粒径(l/nm) PDI 包封率(%) 4∶0.05 半透明 115.37±4.48 0.200±0.07 71.57±1.28 4∶0.1 半透明 160.16±3.15 0.251±0.01 61.08±3.13 4∶0.2 半透明 182.75±2.43 0.217±0.04 54.97±0.95 4∶0.3 乳白色 241.90±12.09 0.697±0.12 54.11±1.64 4∶0.4 乳白色 255.33±8.27 0.700±0.138 48.84±0.78 (4)药物和DSPE-PEG2000比例的考察
按照2.3.2(3)方法研究,其结果如表7所示,DSPE-PEG2000对包封率没有显著性影响,但当DSPE-PEG2000含量不断增加时,纳米粒子的颗粒大小先降低,当药物与DSPE-PEG2000质量比小于1∶1.5时,粒径无显著性变化,因此,药物与DSPE-PEG2000的质量比选择1∶1.5。
药物∶DSPE-
PEG2000外观 粒径(l/nm) PDI 包封率(%) 2∶1 半透明 82.86±2.15 0.107±0.01 90.48±0.49 1∶1 半透明 78.16±2.05 0.351±0.38 90.41±0.34 1∶1.5 半透明 72.23±2.60 0.110±0.02 89.66±1.25 1∶2 半透明 74.64±1.81 0.140±0.04 90.90±2.93 1∶2.5 半透明 75.38±2.10 0.097±0.04 89.48±0.67 (5)薄膜蒸发法的温度考察
按照2.3.2(4),采用不同温度制备纳米制剂表征结果如表8所示,在筛选的5个温度中,当温度为45 ℃时,脂质体粒径最小、粒径分散性好、包封率最高,因此,本研究选用45 ℃作为薄膜蒸发温度。
温度(T/ ℃) 外观 粒径(l/nm) PDI 包封率(%) 35 略透明 159.42±2.42 0.545±0.08 54.94±1.85 40 半透明 105.93±6.13 0.269±0.03 73.98±1.60 45 半透明 76.97±2.50 0.105±0.049 91.13±1.45 50 半透明 91.93±2.60 0.181±0.05 80.27±2.13 55 半透明 112.23±6.37 0.233±0.06 74.15±2.12 (6)探头超声时间的考察
按照2.3.2(5)方法进行研究,结果如表9所示:处理时间较短时,纳米粒径较大,颗粒大小分布不均匀;随着超声处理的延长,粒径减小,包封率也提高;超声时间过长,脂质体结构破坏,导致药物泄露、包封率降低。因此将探头超声处理时间定为90 s。
超声时间(t/s) 外观 粒径(l/nm) PDI 包封率(%) 30 沉淀 278.09±4.73 0.857±0.10 42.83±2.76 60 半透明 113.21±11.16 0.485±0.04 54.96±2.41 90 半透明 78.13±2.78 0.055±0.02 92.74±0.77 180 半透明 123.17±8.39 0.430±0.08 76.29±1.76 240 沉淀 261.85±4.94 0.915±0.20 50.42±2.74 -
综上研究,采用的最优处方和制备工艺如下:精密称取PTX-PA 20 mg、PC98-T 400 mg、DSPE-PEG2000 30 mg,加入适量二氯甲烷溶解,接着45 ℃旋蒸去除有机溶剂,再向圆底烧瓶底部薄膜中加入10 ml重蒸水(预热至同等温度),震荡、水化,得PTX-PA/Lip粗品,最后粗品探头超声(90 s)、过滤(0.22 μm),得最终样品PTX-PA/Lip纳米给药系统。
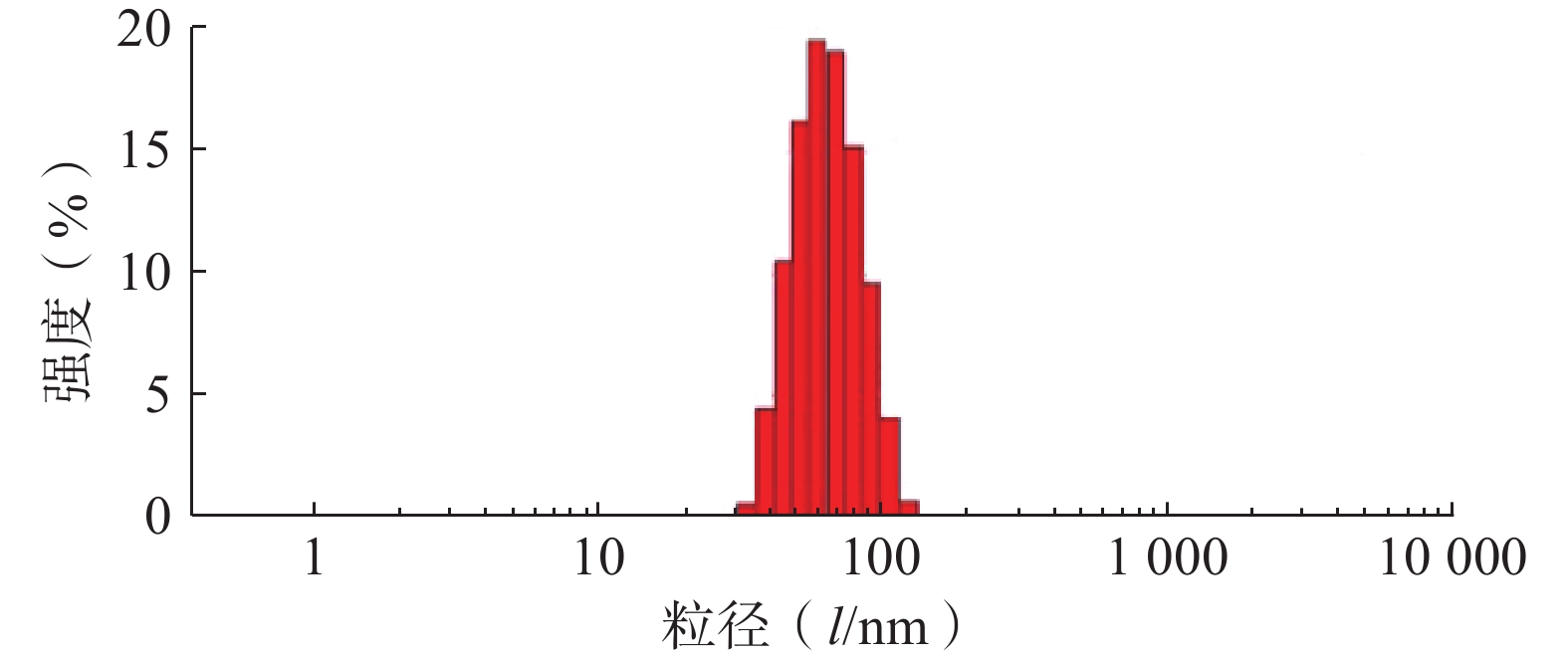
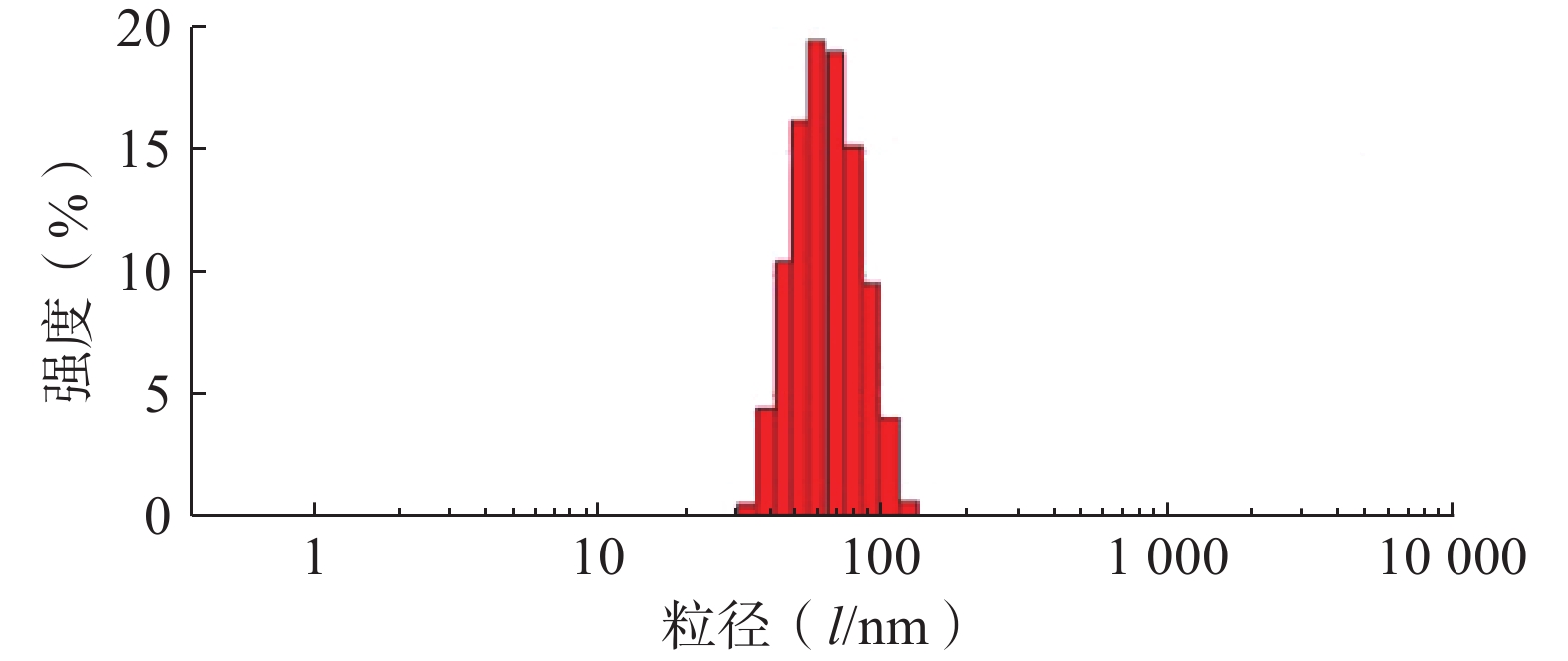
采用Zeta-sizer Nano粒度仪测定最优PTX-PA/Lip的粒径、PDI与zeta电位。结果如图3所示,制备的PTX-PA/Lip脂质体粒径大小为(62.75±1.81) nm,PDI为(0.076±0.020),Zeta电位为(−15.9±0.21) mV,表明制备的PTX-PA/Lip纳米给药系统粒径较小、分布均匀、具有良好的分散性。
-
本实验合成紫杉醇前药——紫杉醇棕榈酸酯PTX-PA,建立PTX-PA的HPLC定量测定方法,经一系列方法学验证,表明其符合PTX-PA定量分析要求,为后续试验奠定了基础。本实验采用薄膜分散法制备PTX-PA脂质体,工艺简便,技术成熟,并通过单因素筛选对PTX-PA脂质体进行处方优化。本文基于纳米技术成功制备出棕榈酸修饰的紫杉醇脂质体,增强了紫杉醇在靶细胞的递送,为PTX-PA后续的药效学研究奠定基础。
Synthesis of paclitaxel palmitate and the formulation optimization of its liposomes
doi: 10.12206/j.issn.2097-2024.202404062
- Received Date: 2024-04-17
- Rev Recd Date: 2024-07-18
- Available Online: 2024-09-20
- Publish Date: 2024-09-25
-
Key words:
- paclitaxel /
- palmitic acid /
- liposomes /
- prodrug /
- pharmaceutical research
Abstract:
| Citation: | CHEN Bingchen, WANG Sizhen, GUO Beibei, YANG Feng. Synthesis of paclitaxel palmitate and the formulation optimization of its liposomes[J]. Journal of Pharmaceutical Practice and Service, 2024, 42(9): 379-384, 410. doi: 10.12206/j.issn.2097-2024.202404062 |







 DownLoad:
DownLoad: