-
慢性脑缺血(CCI)是指各种原因引发的长期大脑血灌流量不足,在血管性痴呆和阿尔茨海默病等神经系统疾病的发展过程发挥重要作用[1-2]。长期慢性脑缺血会导致慢性神经炎症、海马自噬异常、脑部神经元凋亡[3-4],为此,CCI已经严重威胁人类的健康。肠道被称为人类的“第二大脑”,肠道微生物参与周围神经系统和中枢神经系统的双向调节,并通过脑-肠互动(即脑-肠轴)与机体的神经系统密切相关[5]。研究证明中枢系统疾病会导致肠道菌群失调[6],患者发生脑卒中后,不仅会出现胃肠道并发症,还会发生肠道菌群失调,例如肠道菌群中的阿克曼菌属(Akkermansia)会发生变化[7]。同时,肠道菌群失调也推动了脑卒中等疾病的发展,文献报道厚壁菌门增加与认知功能损伤有一定的关联[8-9]。因此,肠道菌群参与了脑部神经系统疾病的进展。中药复方虎杖清脉饮是上海市著名中医脉管病专家奚九一教授数十年临床诊治经验的总结,临床上对辩证属“热郁毒聚,脉滞络痹”的脑小血管损伤疗效显著。有报道虎杖清脉饮通过调节p38和NF-κB信号通路,抑制高糖诱导的人视网膜毛细血管内皮细胞的损伤[10],提示虎杖清脉饮具有抗炎和抗凋亡作用。然而,虎杖清脉饮对慢性脑缺血的治疗作用缺乏临床前研究,作用机制尚不清楚。因此,本实验研究虎杖清脉饮对慢性脑缺血小鼠认知功能的影响,并基于肠道菌群角度初步探讨其作用机制,为防治慢性脑缺血提供新的思路。
-
24只C57BL/6J雄性小鼠(20±5) g,购自常州卡文斯实验动物有限公司(动物合格证号:202112546)。饲养于海军军医大学药学系动物房,饲养条件为温度(24 ± 2) ℃,相对湿度70 %,每天光照时间为08:00至20:00,自由进食饮水。所有操作均符合海军军医大学实验动物伦理要求。
-
虎杖清脉饮由上海中医药大学附属岳阳中西医结合医院提供。由虎杖、垂盆草、豨莶草、连翘、黄芪、鸡血藤和川芎七味常用中药制备[10]。所有药品粉碎成粗粉,蒸馏水浸泡,煮沸2次,每次40 min,合并滤液,浓缩至0.675 g/ml。银杏叶提取物由上海阿拉丁生物化学技术有限公司提供。
-
Morris 水迷宫(上海奥尔科特生物科技有限公司);组织脱水机、包埋机(武汉俊杰电子有限公司);倒置生物显微镜(日本尼康);病理切片机(上海俫卡仪器有限公司);DYY-6C 型核酸电泳仪、ND2000 型光度计、9700 型PCR 仪、Quantus™型高灵敏荧光计、Miseq PE300测序平台(美吉生物公司)。
-
24只小鼠适应性饲养7 d后,随机分为4组:假手术组、模型组、阳性药组(银杏叶提取物)、虎杖清脉饮组,每组6只。小鼠腹腔注射1 %戊巴比妥钠(10 ml/kg)麻醉,并暴露颈总动脉(CCAs)。在体视显微镜下,将微型弹簧圈(钢丝直径0.08 mm,线圈内径0.18 mm,螺距0.5 mm,总长度2.5 mm)螺旋旋转固定在双侧颈总动脉上致颈总动脉狭窄使脑慢性灌注不足,建立BCAS模型。然后缝合手术部位,并对术后小鼠进行护理,直到它们意识清醒。造模6 w后,各组开始进行灌胃给药12 w。阳性药组给予银杏叶提取物(GBE)30 mg/kg,虎杖清脉饮组(HZQMY)给予虎杖清脉饮13.5 mg/kg,假手术组(Sham)和模型组(BCAS)给予等量生理盐水处理。
-
Morris水迷宫实验分为前5 d的定位航行实验和第6 d的空间探索实验。定位航行实验:主要用于测试小鼠的空间学习能力。实验历时5 d,每天每只小鼠训练3次。训练时随机选择一个象限开始,按顺时针方向训练3次。每次将该象限的池壁中点作为入水点,将小鼠面向池壁轻轻放入水中,尽量保持每次入水方式的一致,减少人为影响。小鼠每次分别从不同象限入水寻找逃逸平台,若小鼠找到登上平台,并停留5 s以上,则计时结束,水迷宫装置自动记录小鼠从入水到寻台成功的时间,即为逃避潜伏期。如果在60 s后仍未登上平台,计时也将停止,将小鼠人为引上平台休息1 min,且当次的逃避潜伏期记录为60 s。
空间探索实验:主要用于测试小鼠的空间记忆能力。在定位航行实验结束的第2d,撤除平台,选择与第四象限最远的第二象限池壁中点为小鼠入水点,将小鼠面向池壁轻轻放入池中,使小鼠自由游泳60 s并记录这60 s内小鼠在原平台的停留时间、穿过原平台所在位置的次数作为判断小鼠空间记忆能力差异的指标。
-
治疗结束后,每组各取6只小鼠,用1 %戊巴比妥钠(10 ml/kg)腹腔注射麻醉,4 %多聚甲醛灌注后,取脑石蜡包埋,切片,厚度5 μm,用于LFB(Luxol Fast Blue stain)染色。将石蜡切片常规脱蜡至水,加入LFB染色液于60 ℃烤箱染色3 h。95 %乙醇洗去多余染色液,蒸馏水冲洗。Luxol分化液分化15 s,70 %乙醇分色。重复分化步骤,直至胼胝体和皮质之间形成鲜明对比。梯度乙醇脱水,二甲苯透明,中性树胶封片,在显微镜下采集图片。
-
末次给药后禁食12 h,脱颈椎处死小鼠,处死方法符合动物福利伦理要求,无菌条件下取盲肠内容物,置于液氮中速冻保存。送至美吉生物技术股份有限公司进行DNA提取,合格样品进一步进行高通量测序。
-
运用美吉生物信息云(https://cloud.majorbio.com/)进行数据的处理,利用美吉生信云UParse软件(v7.0.1090)进行OTU(operational taxonomic units)分析、Alpha多样性分析、稀释曲线分析;利用美吉生信云tax_summary_a文件夹中的数据表和R语言(version 3.3.1)工具统计和作图进行物种组成分析;利用Qiime计算Beta多样性距离矩阵;利用美吉生信云进行线性判别分析(LEfSe),计算多级物种之间的差异。
-
采用统计软件SPSS 19.0、GraphPad 9.0进行分析。符合正态分布的计量数据以(
$\bar{x}$ ±s)表示,多组间比较采用单因素方差分析(One-Way ANOVA)。以P<0.05表示有显著性差异,以P<0.01表示有极显著性差异。 -
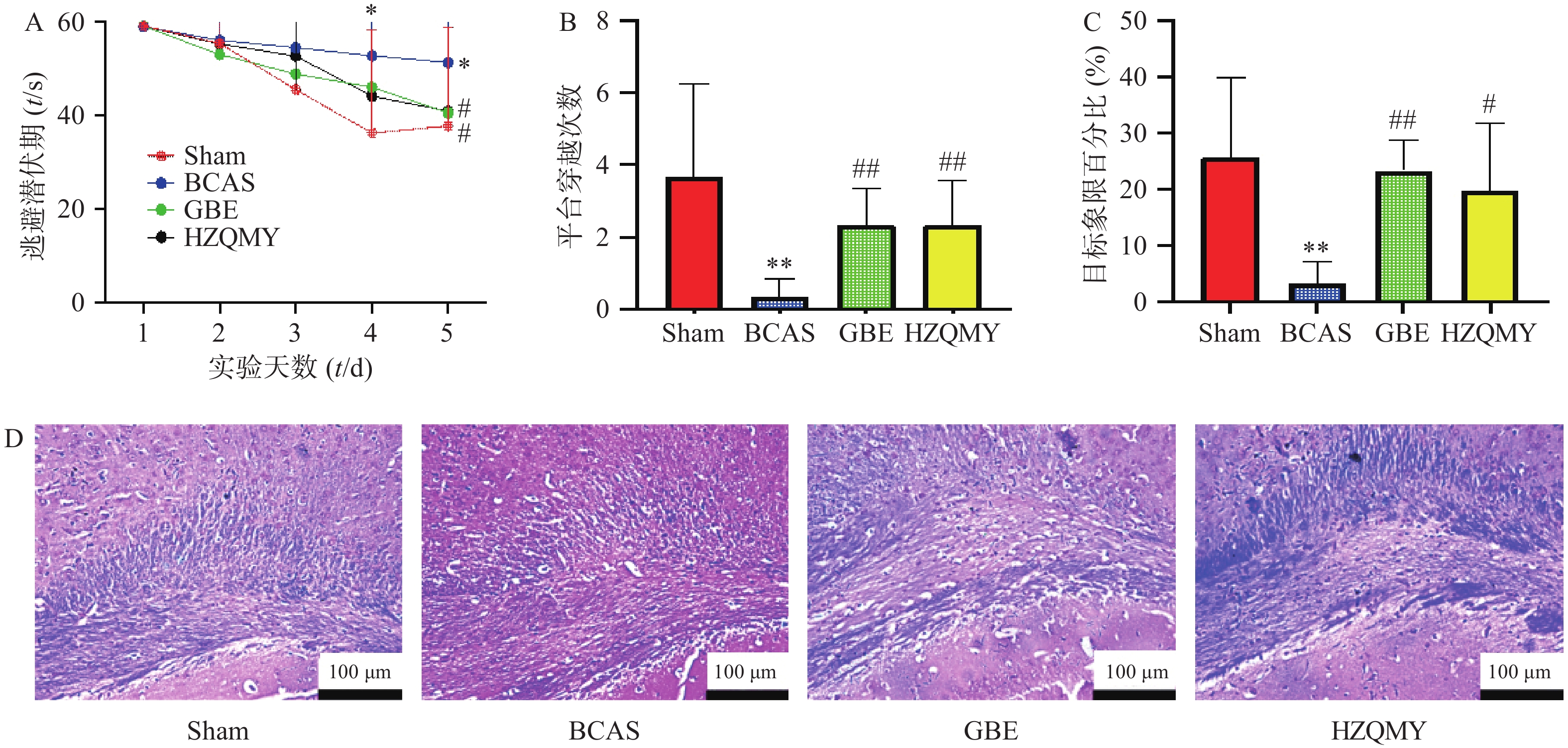
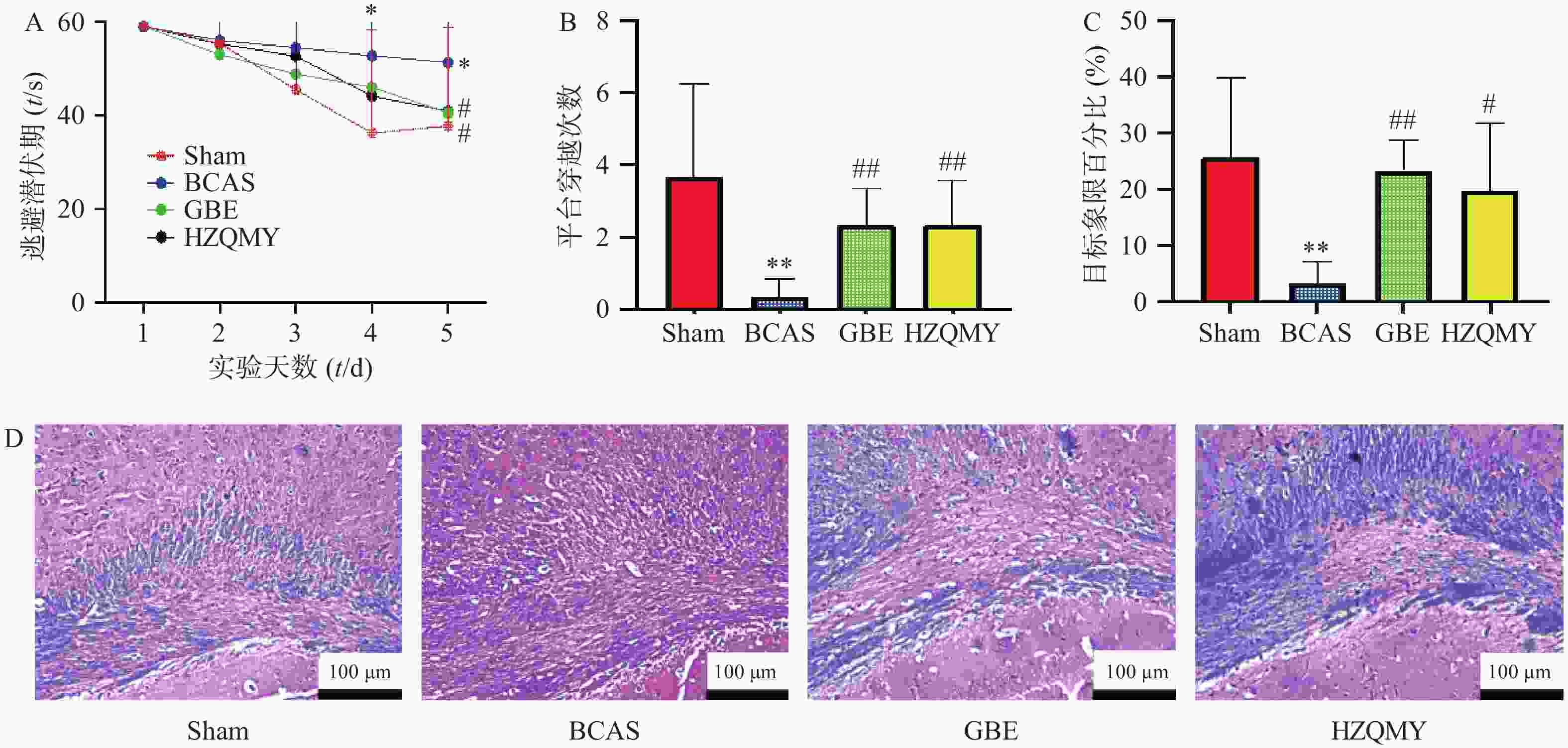
如图1A所示,假手术组小鼠从水迷宫实验第1 d开始到第5 d,逃避潜伏期在不断减少。而模型组小鼠随天数的增加,找到平台的时长并没有明显缩短,并且与假手术组相比,第4天和第5天逃避潜伏期有显著性差异(P<0.05),各给药组小鼠逃避潜伏期在逐渐减少,第5天阳性药组、虎杖清脉饮组与模型组之间的逃避潜伏期差异有统计学意义(P<0.05)。如图1B所示,模型组小鼠的跨越平台次数显著少于假手术组(P<0.01)。而虎杖清脉饮组的跨越平台次数显著大于模型组(P<0.01)。如图1C所示,模型组小鼠的目标象限百分比显著少于假手术组(P<0.05),阳性药组和虎杖清脉饮组的目标象限百分比均显著大于模型组(P<0.05),提示虎杖清脉饮可以改善慢性脑缺血小鼠的学习记忆能力。如图1D所示,假手术组中,小鼠胼胝体的LFB染色,髓鞘排列整齐,无水肿、碎裂及空泡的形成。模型组,LFB着色浅,髓鞘崩解,部分髓鞘空泡化。经银杏叶提取物和虎杖清脉饮治疗,髓鞘病变减轻,染色加深,提示虎杖清脉饮可以改善慢性脑缺血小鼠的白质损伤。
-
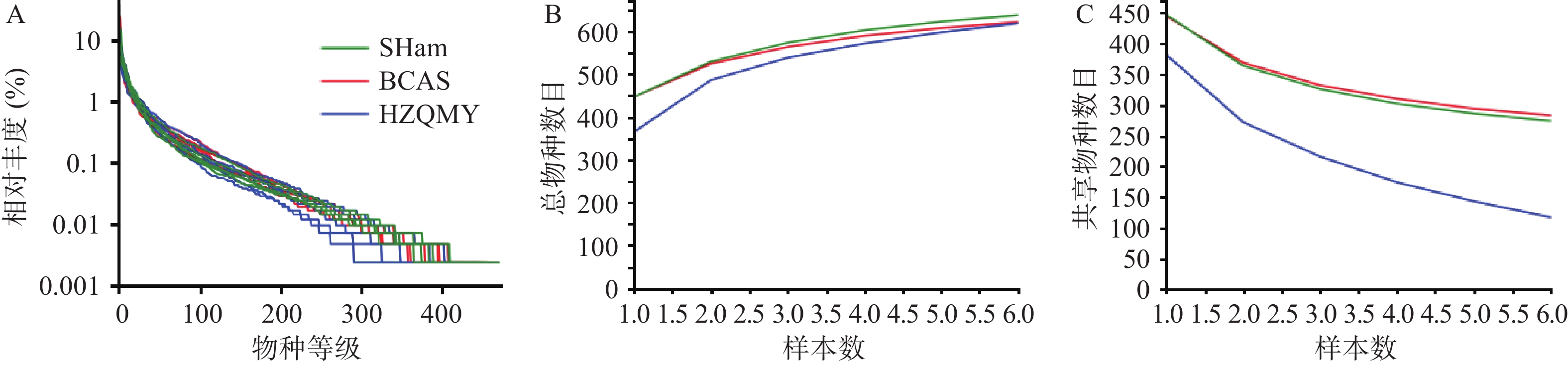
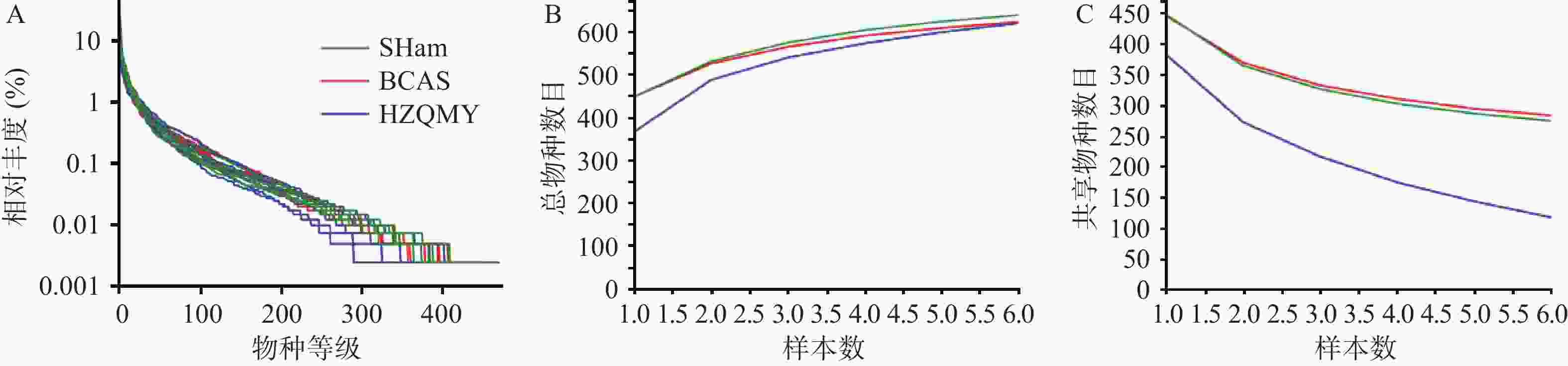
各组小鼠肠道菌群优化后序列数目为964830,碱基数目为398083175,平均长度为412 bp,序列长度分布在400~440 bp内。图2A为3组小鼠肠道微生物等级丰度曲线,从丰度曲线可以看到各组在缓慢平稳下降,说明各组小鼠肠道菌群物种丰富度高并且分布均匀。图2B、2C所示,总物种曲线可分析样本包含的物种总和,共享物种曲线可分析样本共享物种数目,本研究各组总数目和共享项目增加或减少趋势均逐步减缓并趋于平坦,表明各组样本量满足评估物种丰富度和核心物种数的要求。
-
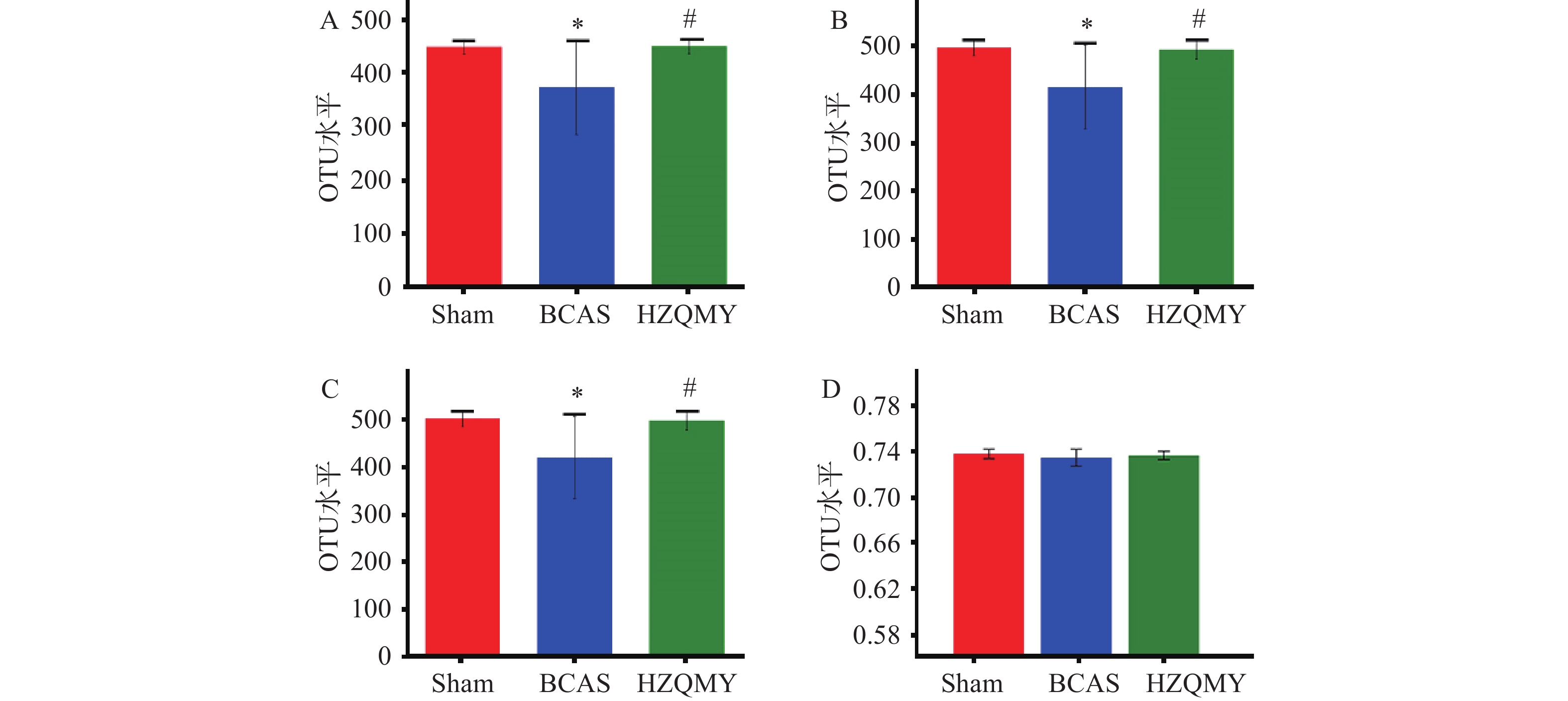
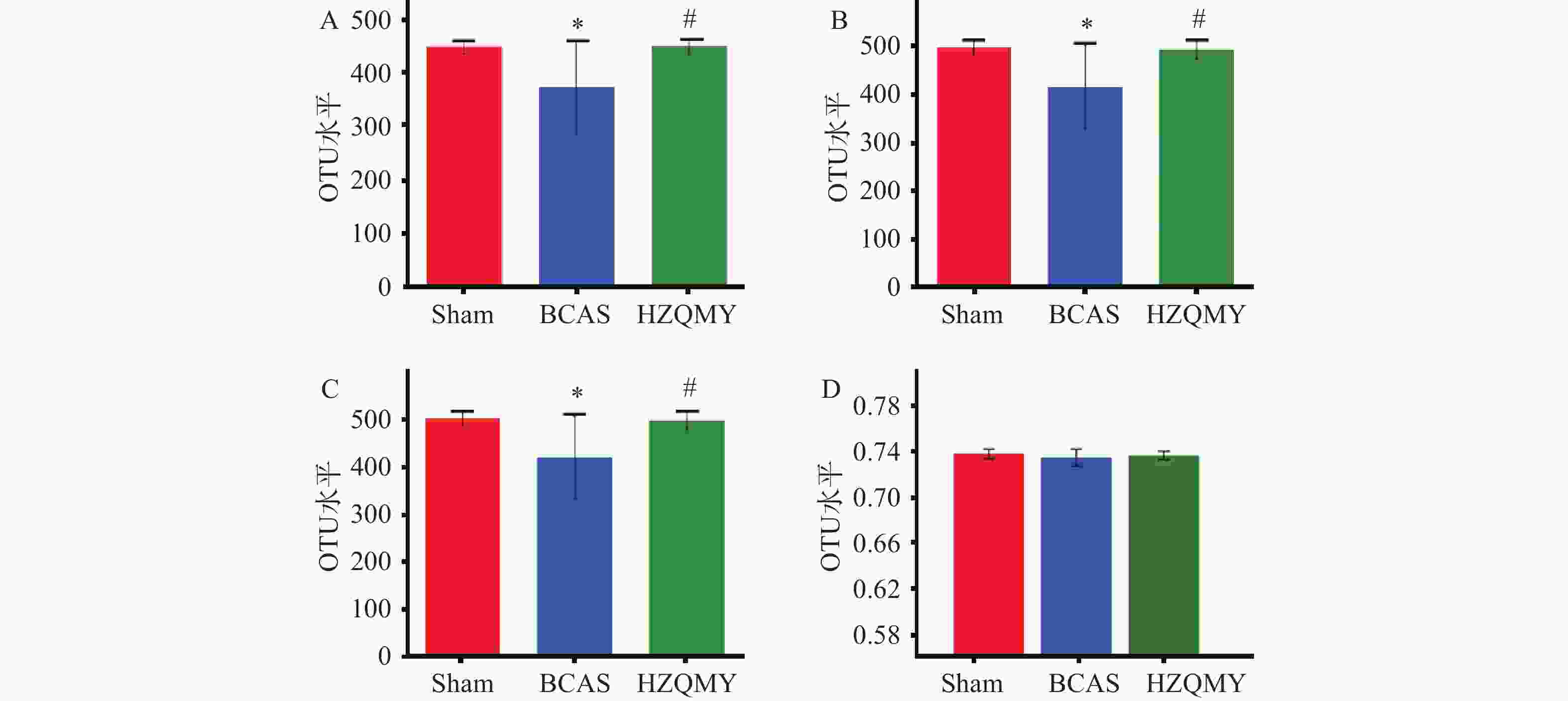
如图3A、3B、3C所示,丰富度实际观测值指数、物种丰富度ACE指数和物种丰富度Chao1指数可解释生物群落丰富度。相较于假手术组,模型组小鼠肠道菌群丰富度显著下降(P<0.05);相较于模型组,虎杖清脉饮组肠道菌群丰富度显著升高(P<0.05),说明虎杖清脉饮可以提升模型组小鼠肠道菌群的丰富度。如图3D所示,3组小鼠肠道菌群的Shannon均匀度测量指数无明显差异。综上,模型组慢性脑缺血小鼠菌群的物种丰富度明显下降,虎杖清脉饮可提升慢性脑缺血小鼠菌群的物种丰富度。
-
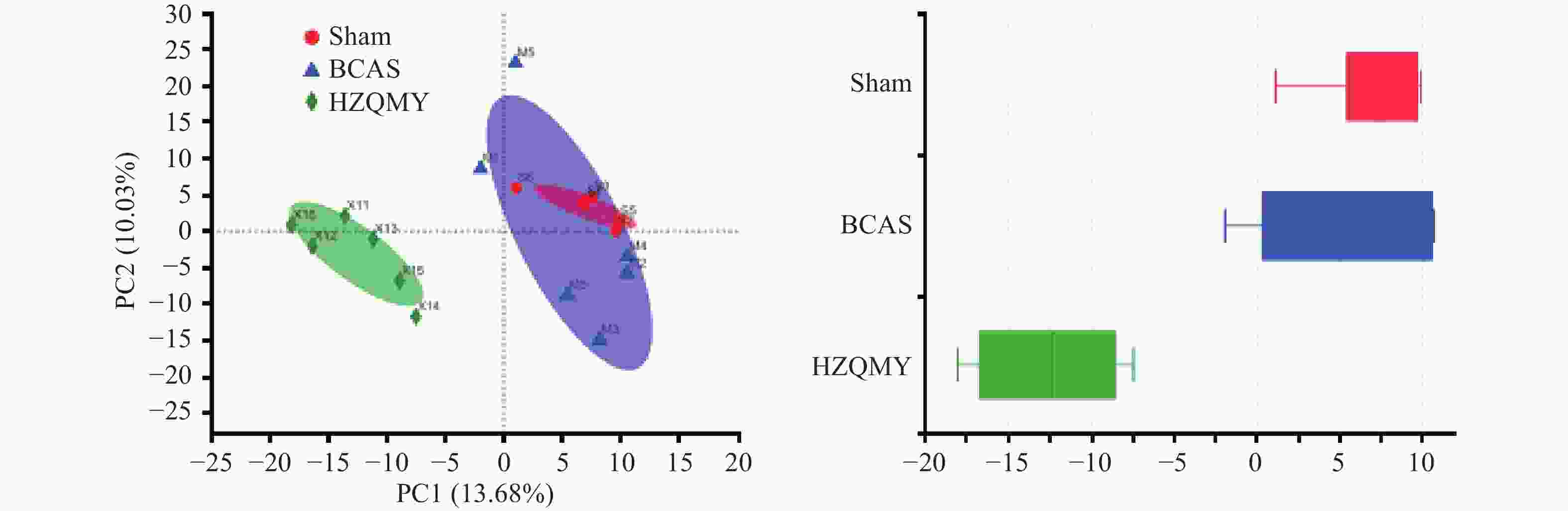
通过主成分分析(PCA)各组小鼠样本菌群群落组成差异,运用反差分解,在图中通过距离反映不同组之间的组成差异,如样本物种组成越相似,反映在主成分分析图中的距离越近。假手术组和模型组聚集在一起,说明模型组对肠道菌群的影响较小。而虎杖清脉饮组与模型组距离较远,说明慢性脑缺血小鼠肠道菌群改变较小,虎杖清脉饮具有调控模型组小鼠肠道菌群组成的作用(图4)。
-
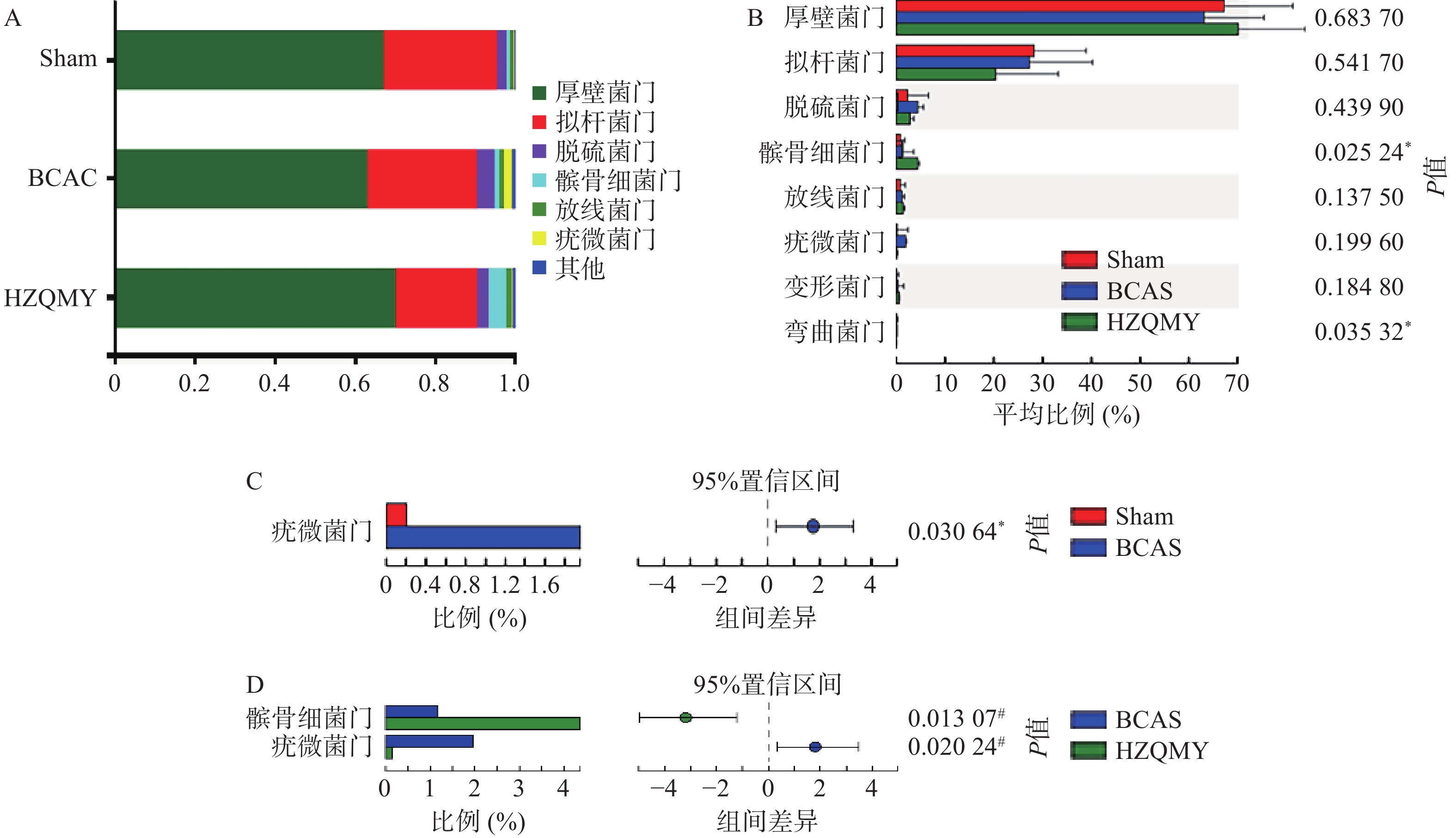
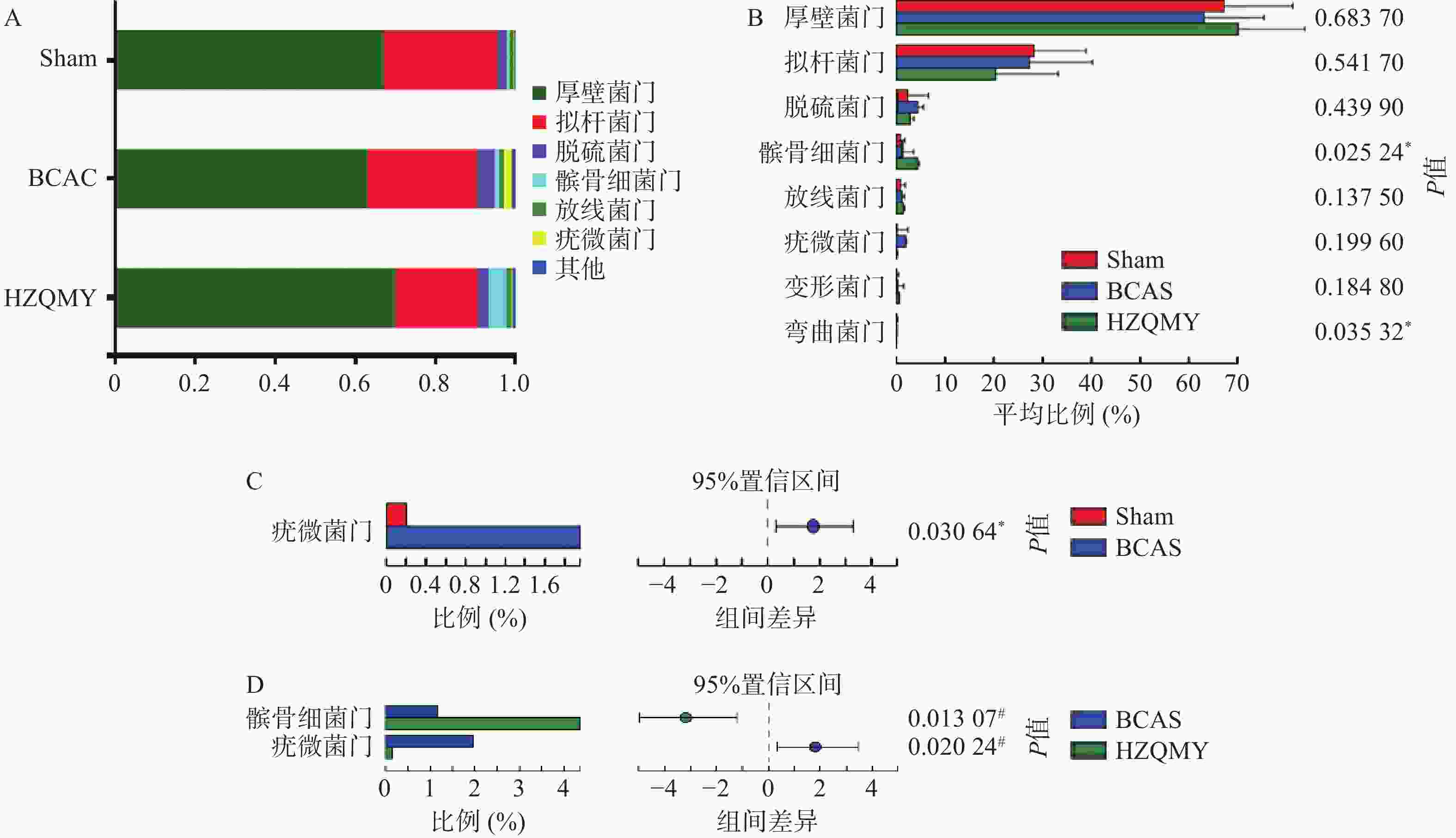
门水平上,3组小鼠肠道中占主导地位的微生物主要有厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidota)、脱硫菌门(Desulfobacterota)、髌骨细菌门(Patescibacteria)、放线菌门(Actinobacteriota),其中后壁菌门和拟杆菌门为优势门类(图5A)。由图5B所示,各组小鼠肠道菌群中髌骨细菌门
和弯曲菌门丰度有显著性差异(P<0.05)。如图5C所示,相较于假手术组,模型组疣微菌门丰度显著升高(P<0.05)。如图5D所示,相较于模型组,虎杖清脉饮组小鼠的疣微菌门丰度显著降低(P<0.05),髌骨细菌门丰度显著增加(P<0.05)。门水平差异性分析显示,慢性脑缺血小鼠疣微菌门丰富度增加;虎杖清脉饮降低慢性脑缺血小鼠疣微菌门和增加髌骨细菌门的群落丰度。 -
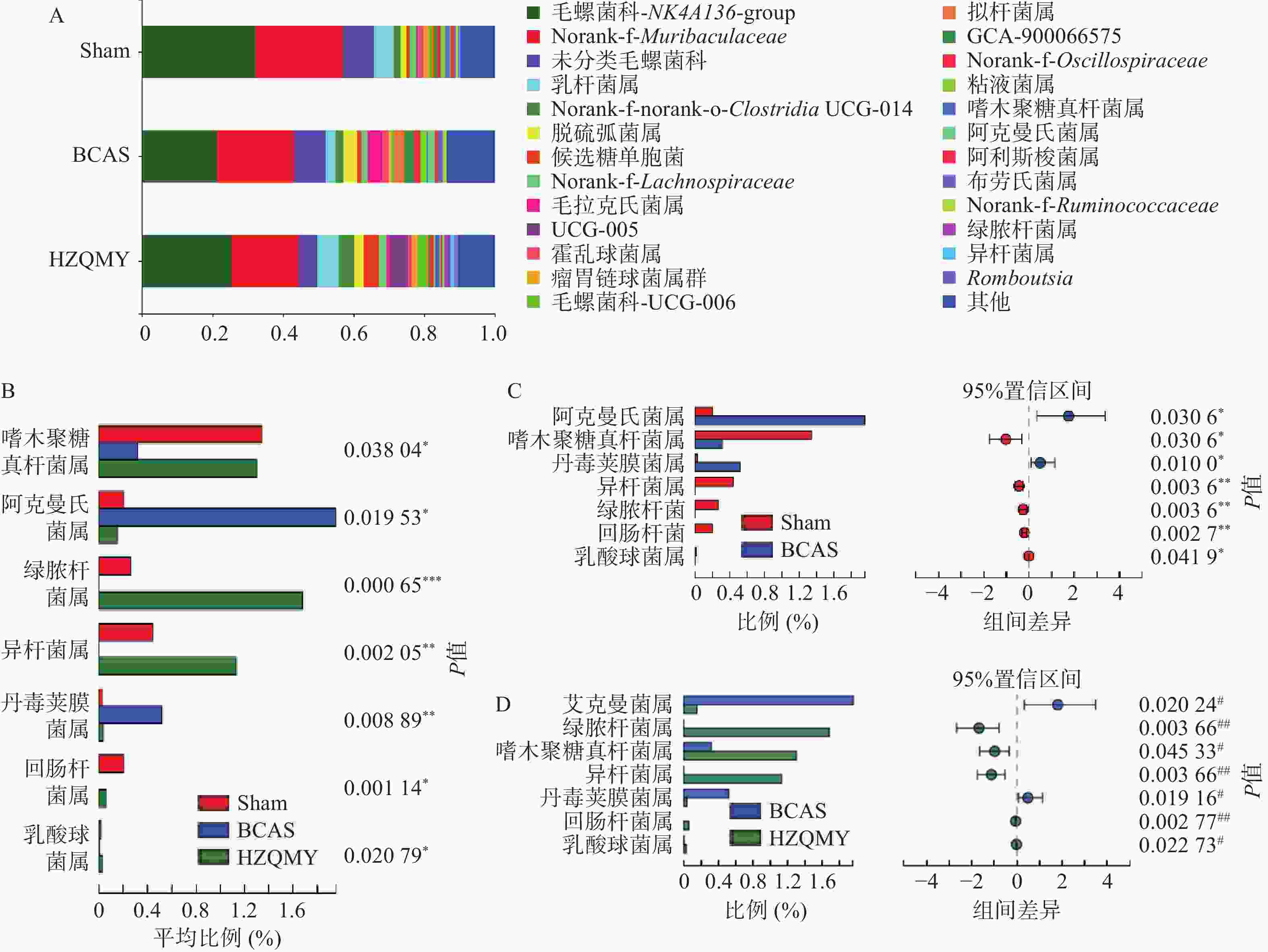
属水平上,3组小鼠肠道中优势菌为毛螺菌科_NK4A136_group、norank_f_Muribaculaceae和乳杆菌属(Lactobacillus)等(图6A)。如图6B所示,3组小鼠的肠道菌群中,阿克曼菌属(Akkermansia)、绿脓杆菌(Turicibacter)、嗜木聚糖真杆菌属(Eubacterium_xylanoPhilum_group)、异杆菌属(Allobaculum)、丹毒荚膜菌属(Erysipelatoclostridium)、回肠杆菌(Ileibacterium)、乳酸球菌属(Lactococcus)群落丰度具有显著性差异(P<0.05,P<0.01)。如图6C所示,与假手术组相比,模型组阿克曼菌属、丹毒荚膜菌属丰度显著上升(P<0.05);嗜木聚糖真杆菌属、异杆菌属、绿脓杆菌、回肠杆菌和乳酸球菌属丰度显著下降(P<0.05,P<0.01)。如图6D所示,与模型组相比,虎杖清脉饮组的阿克曼菌属、丹毒荚膜菌属丰度显著下降(P<0.05);嗜木聚糖真杆菌属、异杆菌属、绿脓杆菌、回肠杆菌和乳酸球菌属丰度显著上升(P<0.05,P<0.01)。
-
如表1所示,LEfSe可以检测各组之间存在显著丰度差异特征。相较于假手术组,模型组疣微菌门(P_Verrucomicrobiota)、疣微菌纲(c_Verrucomicrobiae)、疣微菌目(o_Verrucomicrobiales)、阿克曼菌科(f_Akkermansiaceae)等相对丰度显著上调;嗜木聚糖真杆菌属(g_Eubacterium_xylanophilum_group)、罗氏菌属(g_Roseburia)、回肠杆菌属(g_Ileibacterium)等相对丰度显著下调,表明慢性脑缺血小鼠上述肠道菌群丰度发生显著性变化。
菌群 模型组vs
假手术组虎杖清脉饮组vs
模型组疣微菌门(P_Verrucomicrobiota) ↑ ↓ 疣微菌纲(c_Verrucomicrobiae) ↑ ↓ 疣微菌目(o_Verrucomicrobiales) ↑ ↓ 克里斯滕菌目(o_Christensenellales) ↑ 阿克曼菌科(f_Akkermansiaceae) ↑ ↓ 克里斯滕菌科(f_Christensenellaceae) ↑ 粪芽孢菌属(g_Coprobacillus) ↑ ↓ 阿克曼菌属(g_Akkermansia) ↑ ↓ 嗜胆菌属(g_Bilophila) ↑ 克里斯滕菌属
(g_Christensenellaceae_R-7_group)↑ 丹毒荚膜菌属(g_Erysipelatoclostridium) ↑ ↓ 嗜木聚糖真杆菌属(g_Eubacterium_xylanophilum_group) ↓ 罗氏菌属(g_Roseburia) ↓ 未分类克里斯滕森菌科(g_unclassified_f_Christensenellaceae) ↓ 异杆菌属(g_Allobaculum) ↓ ↑ 理研菌属(g_Rikenella) ↓ 绿脓杆菌属(g_Turicibacter) ↓ ↑ g_Tyzzerella ↓ 回肠杆菌属(g_Ileibacterium) ↓ 蓝细菌纲(c_Cyanobacteriia) ↓ f_Tannerellaceae ↓ f_norank_o_Chloroplas ↓ g_norank_f_norank_o_Chloroplast ↓ 副杆菌属(g_Parabacteroides) ↓ o_PeptostrePtococcales-Tissierellales ↑ 髌骨细菌门(P_Patescibacteria) ↑ c_Saccharimonadia ↑ o_Saccharimonadales ↑ f_Saccharimonadaceae ↑ 丹毒丝菌科(f_Erysipelotrichaceae) ↑ 消化链球菌科(f_Peptostreptococcaceae) ↑ g_Candidatus_Saccharimonas ↑ g_UCG-005 ↑ g_Romboutsia ↑ 嗜木聚糖真杆菌属(g_Eubacterium_xylanophilum_group) ↑ g_norank_f_Atopobiaceae ↑ 安德克氏菌属(g_Adlercreutzia) ↑ 分节丝状菌属(g_Candidatus_Arthromitus) ↑ g_Lachnospiraceae_UCG-006 ↑ g_NK4A214_group ↑ 注:↑表示相对丰度增加,↓表示相对丰度降低。 相较于模型组,虎杖清脉饮组疣微菌纲(c_Verrucomicrobiae)、蓝细菌纲(c_Cyanobacteriia)、疣微菌门(P_Verrucomicrobiota)、阿克曼菌科(f_Akkermansiaceae)、阿克曼菌属(g_Akkermansia)、粪芽孢菌属(g_Coprobacillus)、丹毒荚膜菌属(g_Erysipelatoclostridium)、副杆菌属(g_Parabacteroides)等相对丰度显著下调;丹毒丝菌科(f_Erysipelotrichaceae)、消化链球菌科(f_PeptostrePtococcaceae)、绿脓杆菌属(g_Turicibacter)、异杆菌属(g_Allobaculum)、嗜木聚糖真杆菌属(g_Eubacterium_xylanophilum_group)等相对丰度显著上调。说明虎杖清脉饮通过调节嗜木聚糖真杆菌属、异杆菌属、绿脓杆菌、疣微菌、阿克曼菌和丹毒荚膜菌的丰度,达到治疗慢性脑缺血的治疗作用。
-
慢性脑缺血会损害脑血管,导致患者身体残疾、认知障碍或抑郁样行为。慢性脑缺血(CCI)被认为是血管性痴呆的一个病理生理标志[1-2],它是血管认知障碍(VCI)最严重的阶段和形式,与推理、学习和记忆方面的问题有关[11-12]。
近年来,大量的研究展示了肠道微生物对人体的生长发育有重要作用,当肠道微生物失调时,可能造成神经功能缺陷,进而出现神经退行性疾病[13-14]。肠道微生物参与周围神经系统和中枢神经系统的双向调节,并通过脑-肠轴调节参与机体的免疫、代谢、神经、内分泌等系统,进而影响多种神经系统疾病的发生[15-16]。研究显示,神经类疾病如阿尔兹海默症、抑郁症、帕金森疾病等都存在宿主肠道菌群紊乱的现象,并且发现肠道菌群能通过神经内分泌和自主神经实现脑-肠信号转导,从而参与调节宿主的神经-内分泌-免疫网络,影响宿主的情绪、认知或行为改变[17]。
虎杖清脉饮由虎杖、垂盆草、豨莶草、连翘、黄芪、鸡血藤和川芎组成,虎杖为君药,《药性论》曰:“虎杖,压一切热毒”。虎杖性味苦,寒,在方中起清热解毒、凉血祛瘀的功效。虎杖对神经具有保护作用,如虎杖苷可通过调控lncRNA-MALAT1发挥脑微血管内皮细胞保护作用;虎杖苷可以激活SIRT1信号通路减轻大鼠创伤性脑损伤[18]。连翘[19]、垂盆草及豨莶草[20-21]共为臣药。连翘味苦,微寒,属于清热解毒药,《医学衷中参西录》:连翘具升浮宣散之力,可流通气血。垂盆草味甘、淡,性凉,豨莶草性味辛、苦,寒,二者具有清热解毒,祛风通络之功。三药联用助虎杖清热解毒,又能增强通络的作用。鸡血藤[22]、黄芪共为方中佐药。鸡血藤温而不烈,活血祛瘀兼有补血功效;黄芪甘温,具有益气扶正之功,治久病气虚。三者可治血瘀气虚兼症,并能制君药和臣药苦寒,保护脾胃。川芎[23]辛温,既能祛风,又能行气活血,引诸药上行巅顶,为佐而兼使之用。其中的川芎嗪、阿魏酸、藁本内酯等[24-25]化学成分有明显脑保护作用。诸药合用,共奏清热解毒、活血通络之功。本研究通过减少颈总动脉的血流量,成功建立慢性脑缺血小鼠的模型。
通过水迷宫实验和LFB染色表明虎杖清脉饮对小鼠慢性脑缺血具有保护作用,从肠道菌群的角度观察发现慢性脑缺血将会导致小鼠菌群的物种的丰富度有所下降,并且其中疣微菌门、阿克曼菌属和丹毒荚膜菌属相对丰度上升,而嗜木聚糖真杆菌属和异杆菌属的相对丰度下降;虎杖清脉饮具有增加小鼠肠道菌群物种丰富度的作用,以及回调因为慢性脑缺血而导致菌属变化的作用。阿克曼菌隶属于疣微菌门,是肠道微生物中唯一一个来自疣微菌门的细菌。阿克曼菌[26] 是一种以肠黏膜层中的黏蛋白为食,降解黏蛋白和黏液层。当艾克曼菌异常增加时,会导致肠道屏障的受损,进而诱发肠道炎症和LPS大量进入血液影响其他脏器。有相关文献报道[27] ,在中风患者的肠道艾克曼菌中异常增长。同时,丹毒荚膜菌[28]的丰度也随着帕金森患者胃肠功能障碍增加而增加,这与我们的实验结果相符。嗜木聚糖真杆菌和异杆菌[29-30] 属于短链脂肪酸产生菌,短链脂肪酸[31-32] 可以降低肠道的通透性以及加强肠道屏障的防御力,调节免疫细胞趋化性、活性氧(ROS)释放以及细胞因子释放而具有抗炎功能,短链脂肪酸也可以促进脑内海马神经的发生和延长。虎杖清脉饮减少阿克曼菌属的相对丰度;增加嗜木聚糖真杆菌属和异杆菌属的相对丰度,进而维持肠道屏障功能的完整性,降低机体内的炎症反应,保护血脑屏障[5]。综上所述,虎杖清脉饮对慢性脑缺血小鼠的治疗作用与其对慢性脑缺血小鼠肠道菌群失调的改善作用具有相关性。
Effects of Huzhang Qingmai decoction on cognitive function and intestinal flora in mice with chronic cerebral ischemia
doi: 10.12206/j.issn.2097-2024.202208106
- Received Date: 2022-08-28
- Rev Recd Date: 2023-03-20
- Publish Date: 2023-05-25
-
Key words:
- HZQMY /
- chronic cerebral ischemia /
- cognitive function /
- 16S rRNA /
- intestinal flora
Abstract:
| Citation: | GUO Yuchen, DING Huamin, DENG Shanshan, ZHANG Yuefan, LI Tiejun. Effects of Huzhang Qingmai decoction on cognitive function and intestinal flora in mice with chronic cerebral ischemia[J]. Journal of Pharmaceutical Practice and Service, 2023, 41(5): 302-309. doi: 10.12206/j.issn.2097-2024.202208106 |








 DownLoad:
DownLoad: