-
我国乙肝患病率高,因此重视各类肝病研究和治疗极为重要[1]。肝纤维化作为各类肝脏疾病的前期症状,更应重点关注。肝纤维化是肝脏内弥漫性细胞外基质过度累积,导致肝内纤维结缔组织异常沉积的自我损伤修复反应[2],是多数慢性肝脏疾病向肝硬化进展的必经过程[3],会引发腹水、肝性脑病等并发症,极大地危害了人类的生命健康。因此,在早期就重视肝纤维化,并采取积极有效的治疗措施对于阻止该疾病的进一步发展,甚至逆转肝纤维化具有重要的意义。目前已有大量中医药研究表明,药性以寒性、温性居多,药味以苦味、辛味为多,归经以肝经、脾经、胃经为主的中药对于抗肝纤维化有较为显著的作用[4]。
白芍为毛茛科植物芍药(Paeonia tacti lora Pall)的干燥根,味苦酸甘,性微寒,归肝、脾经,兼具正治、旁治、反治三法而调肝[5]。有研究认为白芍为肝病治疗方面极为重要的一味药,白芍及其复方可用于肝纤维化疾病的治疗,并产生明显的改善作用[6-7],但具体作用机制尚不明确。因此,本研究基于网络药理学“多成分、多靶点、多途径”的方法,分析白芍治疗肝纤维化过程中的活性成分、作用靶点及多种途径,为后续基础研究及临床实验研究提供数据支持及科学依据。
-
在中药系统药理学数据库和分析平台TCMSP(https://old.tcmsp-e.com/tcmsp.php)数据库Herb Name中输入“白芍”,设置ADME参数为:口服生物利用度(OB)>30%、类药性(DL)>0.18,筛选白芍的有效活性成分。进入PubChem(https://pubchem.ncbi.nlm.nih.gov/)数据库查找与白芍有效活性成分相对应的Smiles表达式,导入Swiss Target Prediction(http://swisstargetprediction.ch/)数据库,预测白芍有效活性成分对应的靶点。
-
使用GeneCards(https://www.genecards.org/)数据库、OMIM(https://omim.org/)数据库筛选肝纤维化对应靶点,以“liver fibrosis”为关键词进行筛选。
-
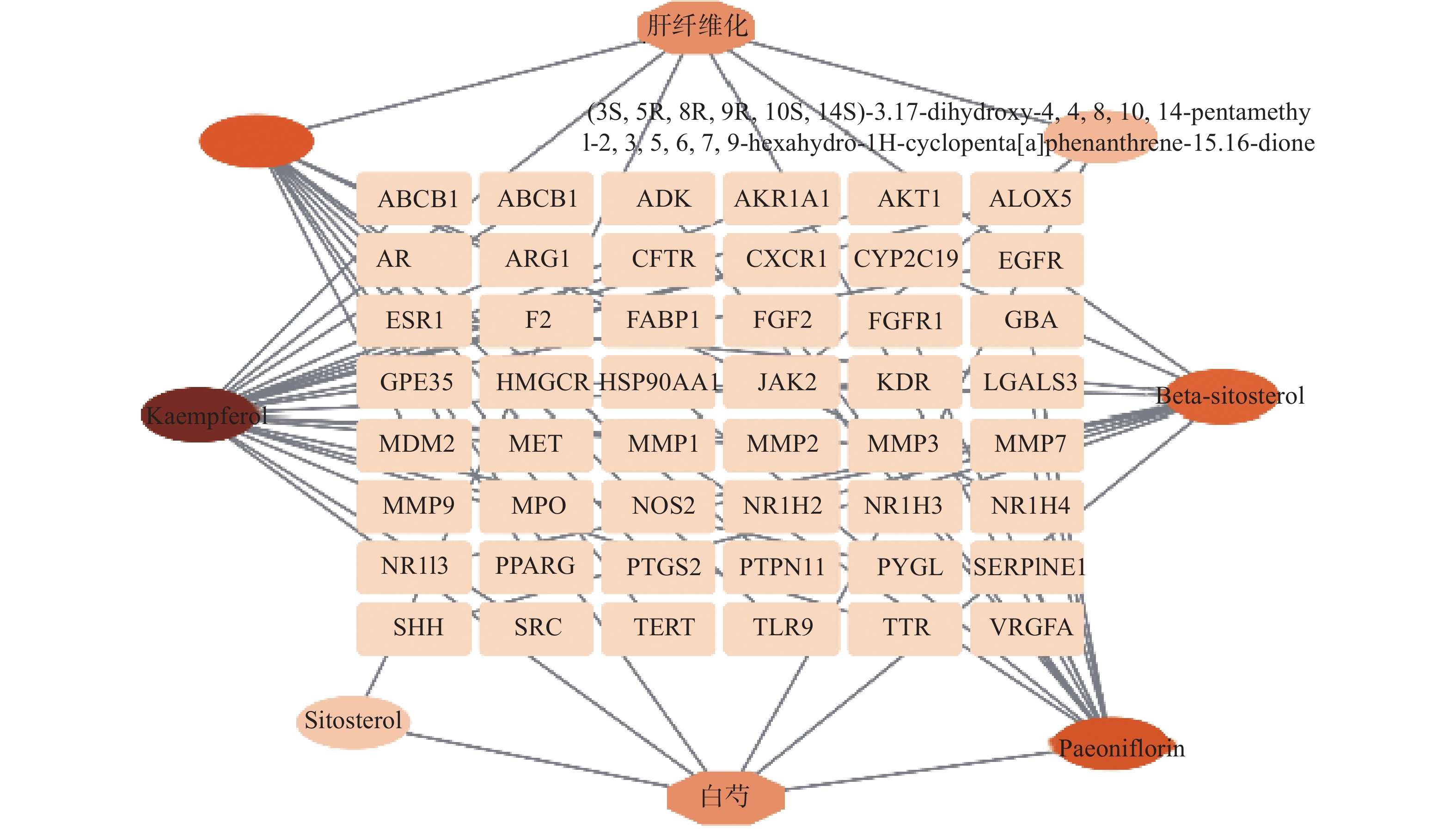
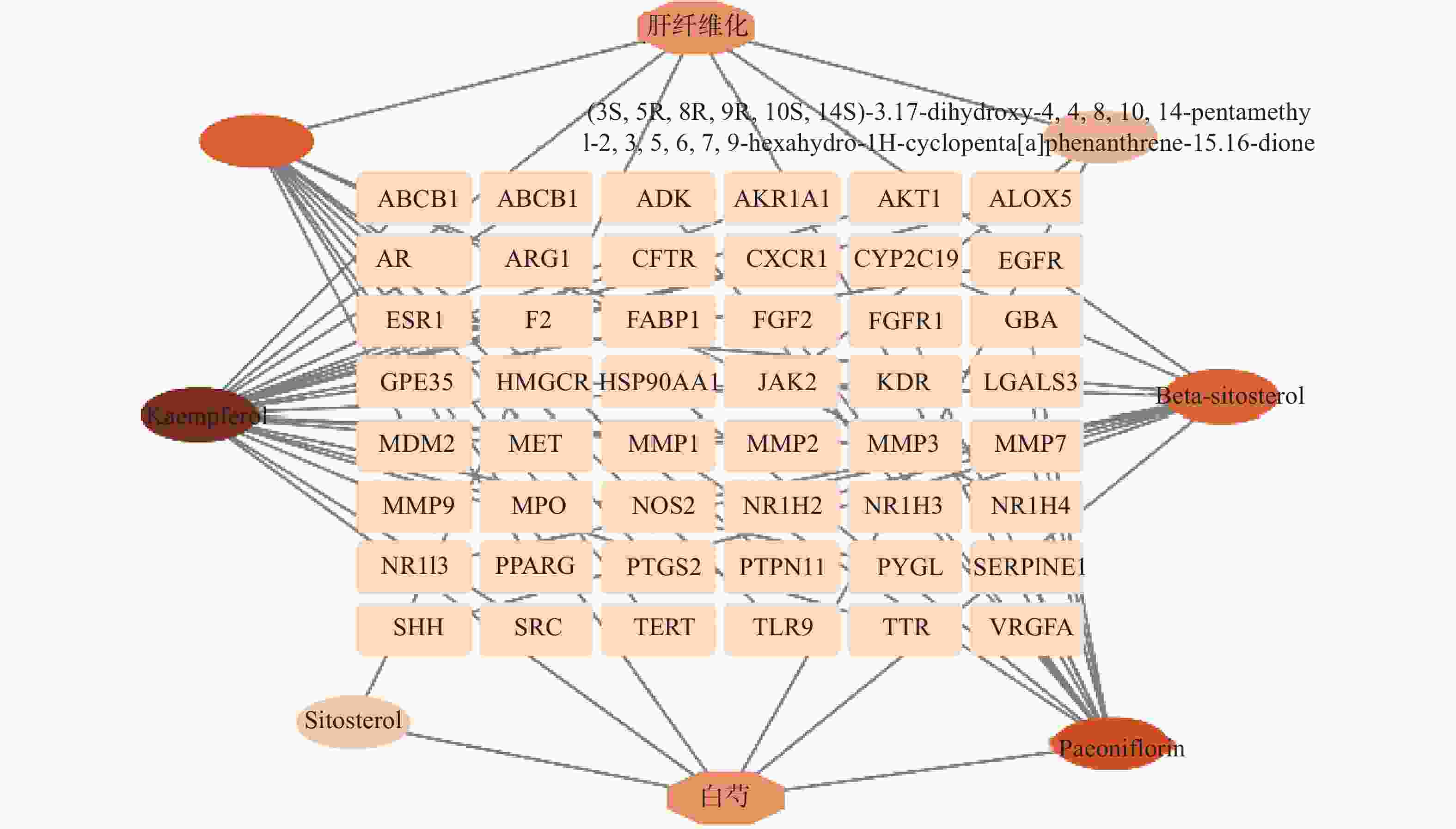
通过Venny(https://bioinfogp.cnb.csic.es/tools/venny/)平台绘制韦恩图,筛选白芍与肝纤维化疾病的共同靶点。将共同靶点的数据导入Cytoscape3.9.0软件,构建“白芍-活性成分-靶点-肝纤维化”网络图进行分析,根据Degree值区别节点大小,Degree值越大,表明该节点在网络中越重要。
-
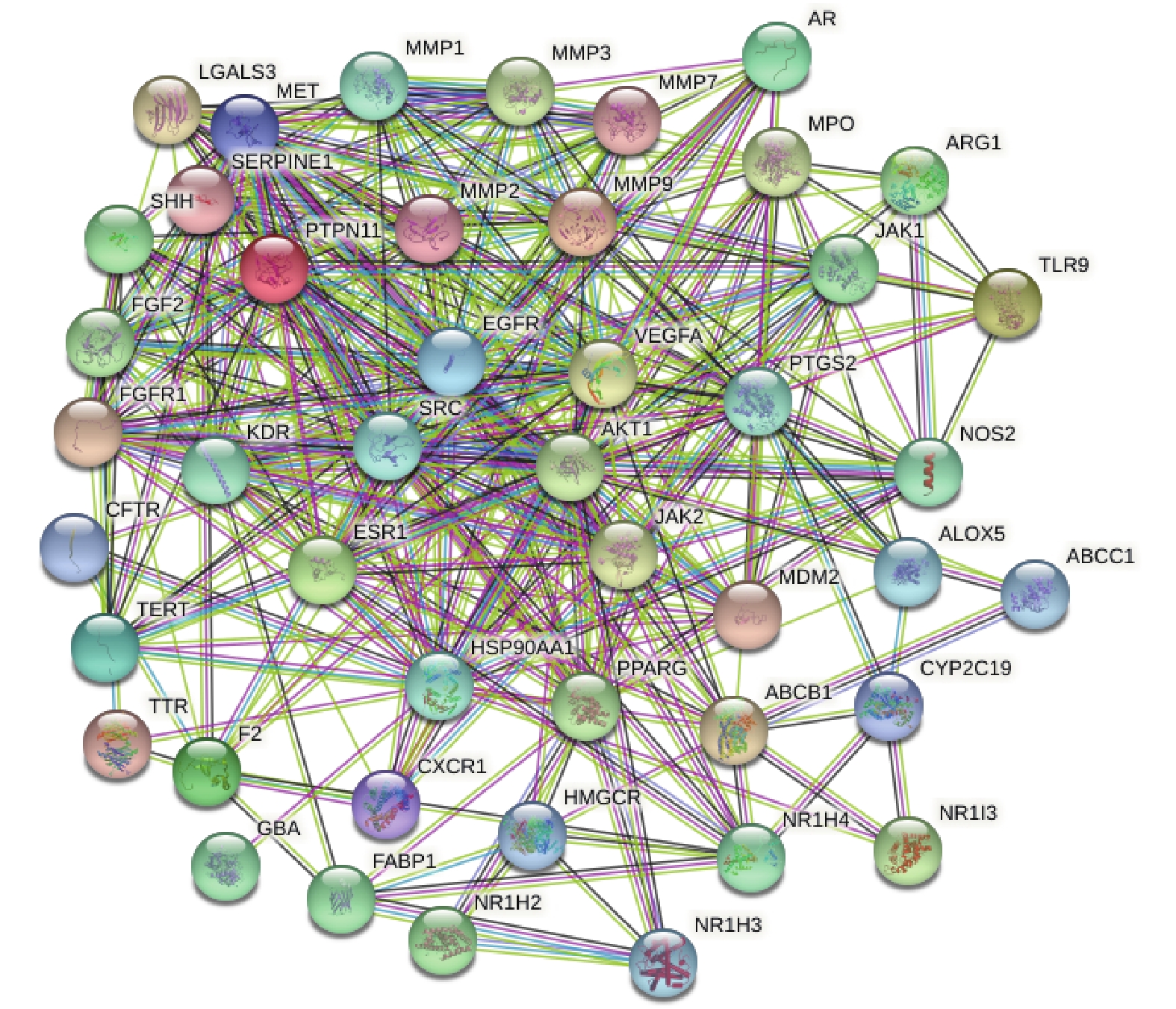
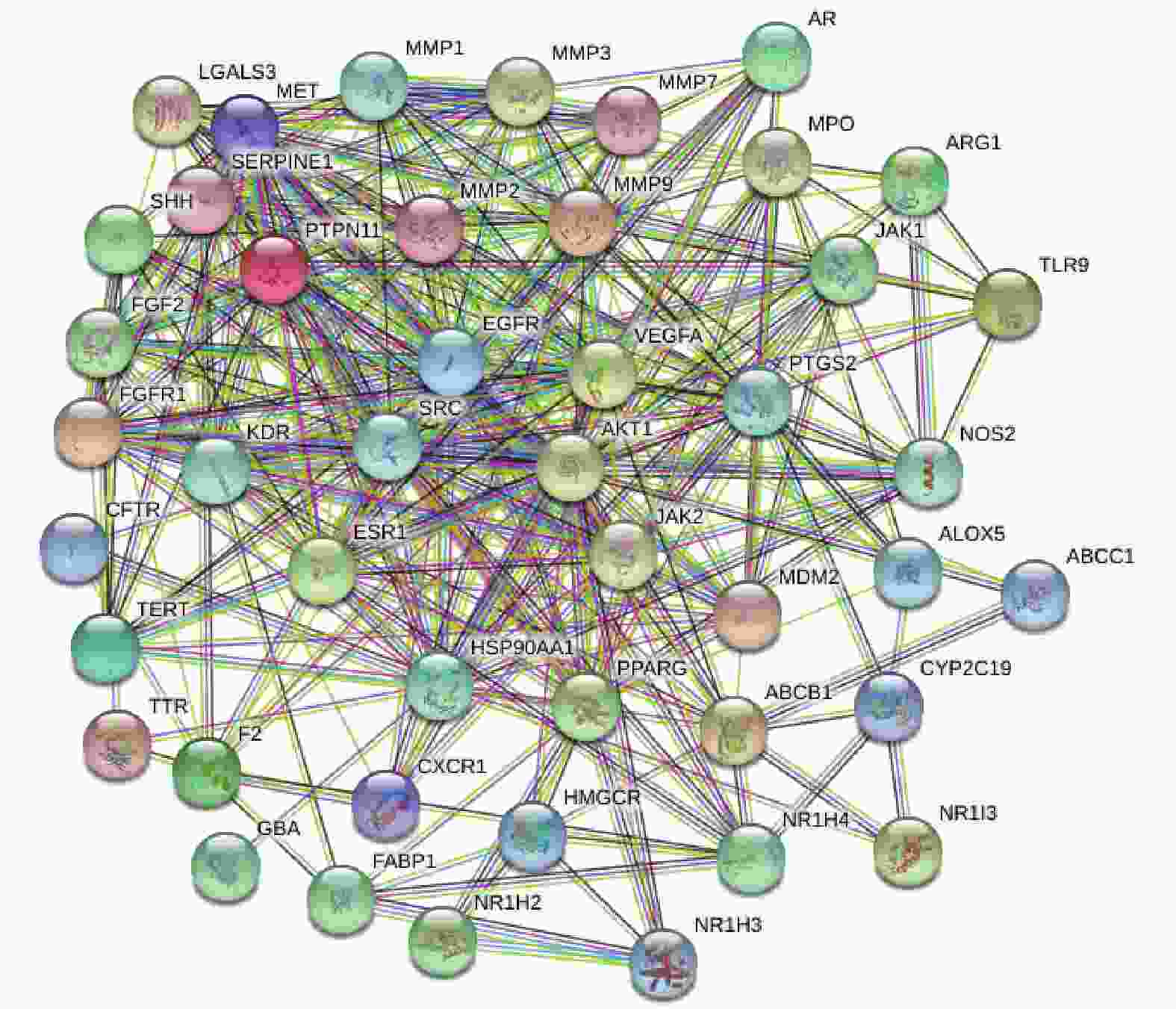
将上述白芍于肝纤维化疾病的共同靶点的数据导入String(https://cn.string-db.org/)数据库,物种(Organisms)选择人(Homo sapiens),设置为medium confidence(0.400),构建蛋白相互作用图,即PPI网络,并下载其TSV文件,导入Cytoscape3.9.0软件中进行拓扑参数分析,并根据Degree值区别节点的大小,Degree值越大,表明该节点在网络中越重要 。
-
将白芍与肝纤维化共同的49个靶点信息输入DAVID(https://david.ncifcrf.gov/)数据库,设置物种为人,P<0.01,分别勾选GO分析中的生物过程(BP)、细胞组成(CC)、分子功能(MF)以及Pathway中的KEGG进行富集分析,提取结果后,应用微生信(http://www.bioinformatics.com.cn/)平台绘制气泡图进行可视化分析,其中P值显示为各节点的颜色变化,基因数显示为气泡大小。
-
在TCMSP数据库中发现85个白芍的化学成分,设置ADME参数为口服生物利用度(OB)<30%、类药性(DL)<0.18后即筛出13个白芍的有效活性成分。将活性成分导入PubChem数据库查找Smiles表达式,其中有4个活性成分(MOL001910、MOL001918、MOL001928、MOL001930)未查询到相应的Smiles表达式。将剩余9个有效活性成分导入Swiss Target Prediction数据库,预测白芍有效活性成分对应的靶点,其中有2个活性成分(MOL001921、MOL000492)无相关作用靶点。因此,共获得符合筛选条件的白芍活性成分6个,见表1。
成分代码 成分名称 中文名称 OB% DL MOL001919 (3S,5R,8R,9R,10S,14S)-3,17-dihydroxy-4,4,8,10,
14-pentamethyl-2,3,5,6,7,9-hexahydro-1H-cyclopenta
[a]phenanthrene-15,16-dione(3S,5R,8R,9R,10S,14S)-3,17-二羟基-4,4,8,10,
14-五甲基-2,3,5,6,7,9-六氢 -1H-环戊
[a]菲 -15,16-二酮43.56 0.53 MOL001924 paeoniflorin 芍药苷 53.87 0.79 MOL000211 Mairin 白桦脂酸 55.38 0.78 MOL000358 beta-sitosterol β-谷甾醇 36.91 0.75 MOL000359 sitosterol 谷甾醇 36.91 0.75 MOL000422 kaempferol 山萘酚 41.88 0.24 -
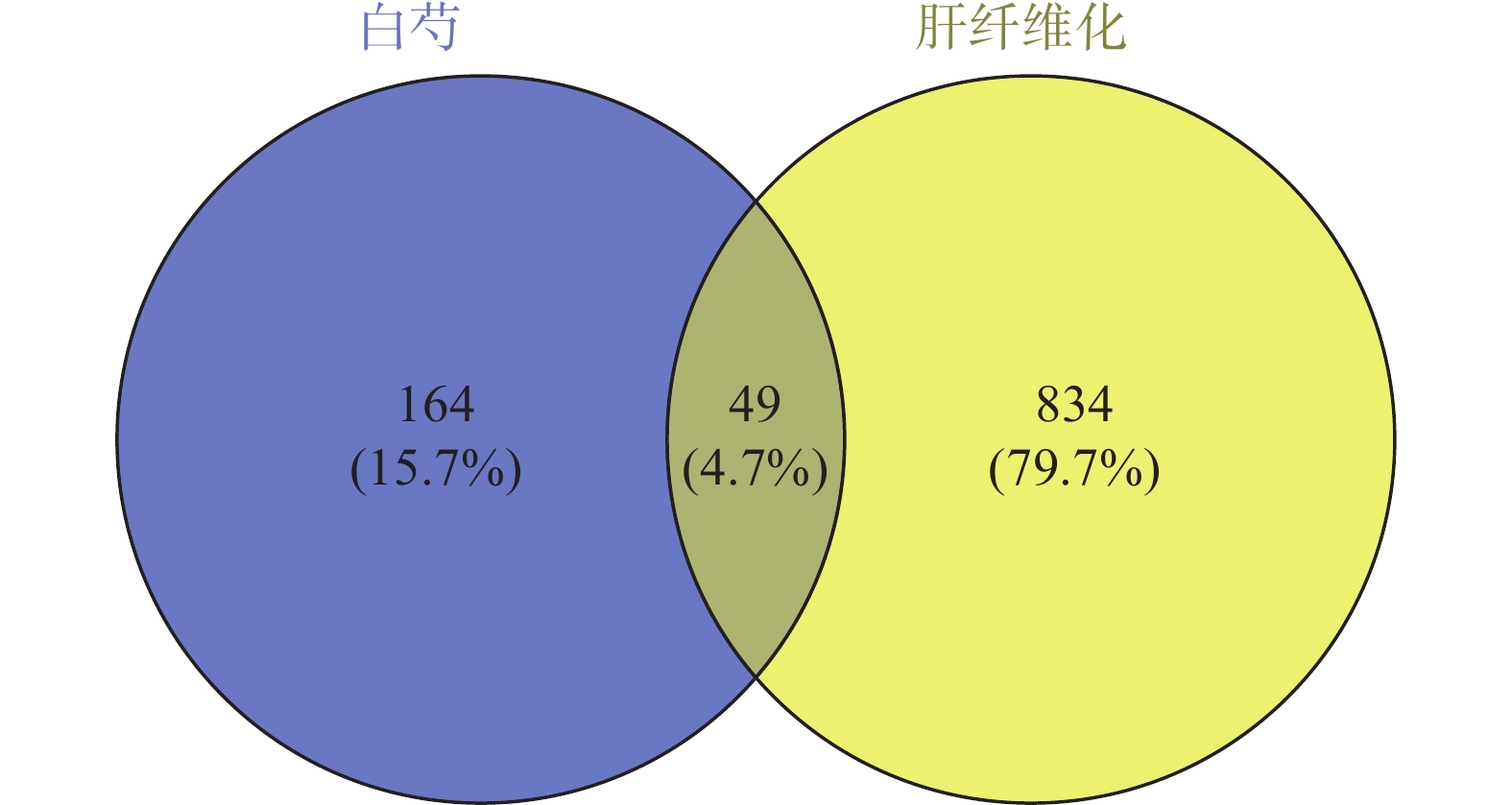
通过检索GeneCards数据库,共获得7711个肝纤维化疾病靶点,设置“Relevance Score”>10,筛选出靶点773个,再检索OMIM数据库,共得到56个条目,去重后共得到155个靶点。将二数据库所得到的疾病靶点汇总并去重,共得到883个靶点。绘制韦恩图,见图1。通过二者交集部分可知白芍治疗肝纤维化的潜在靶点有49个。
-
利用Cytoscape3.9.0软件构建“白芍-有效成分-交集靶点-肝纤维化”网络图,见图2,根据Degree值区别节点大小,Degree值越大,颜色越深。因此,分析结果表明,白芍治疗肝纤维化的主要活性成分前四位为山奈酚、芍药苷、白桦脂酸及β-谷甾醇。
-
将药物白芍与疾病肝纤维化的共同作用靶点导入String数据库,物种(Organisms)选择人(Homo sapiens),设置为medium confidence(0.400),获得节点数(node)49,边数(edge)328,平均节点度(average node degree)13.4,平均局部聚类系数(avg. local clustering coefficient)0.633,PPI富集P<1×10−16,构建白芍与肝纤维化共同靶点蛋白PPI网络图,见图3。
-
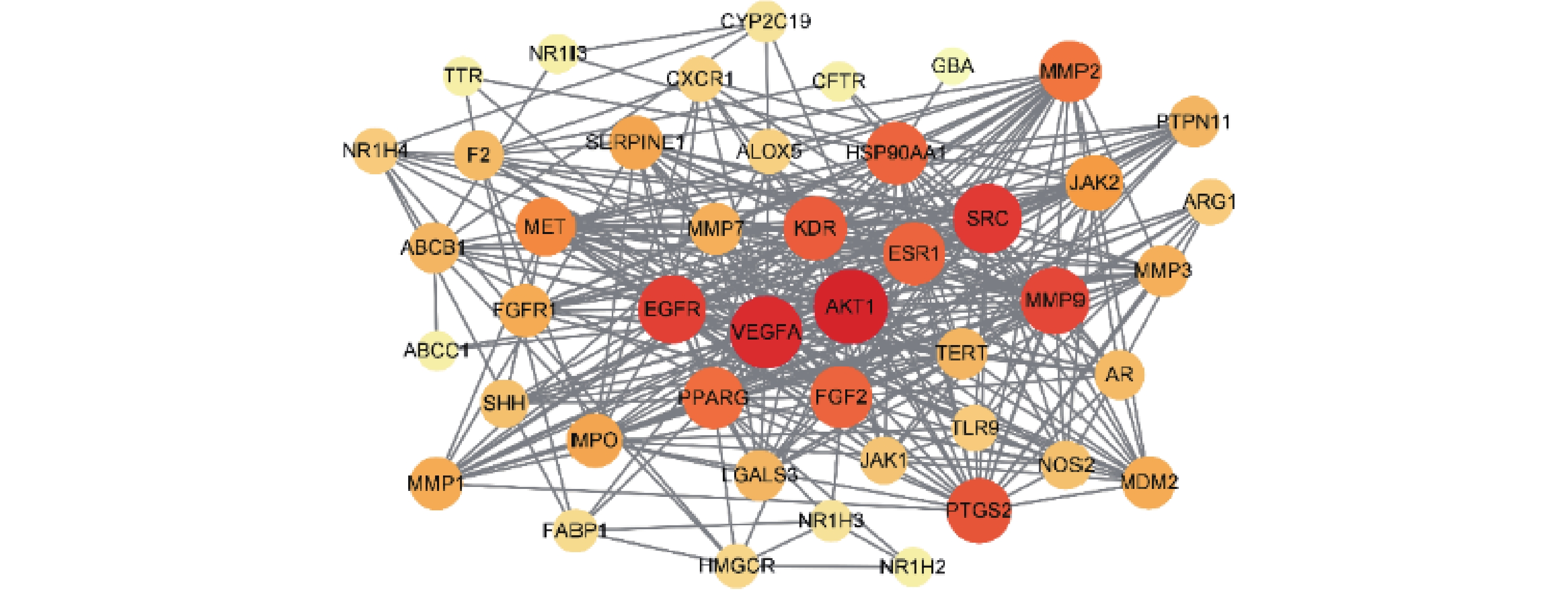
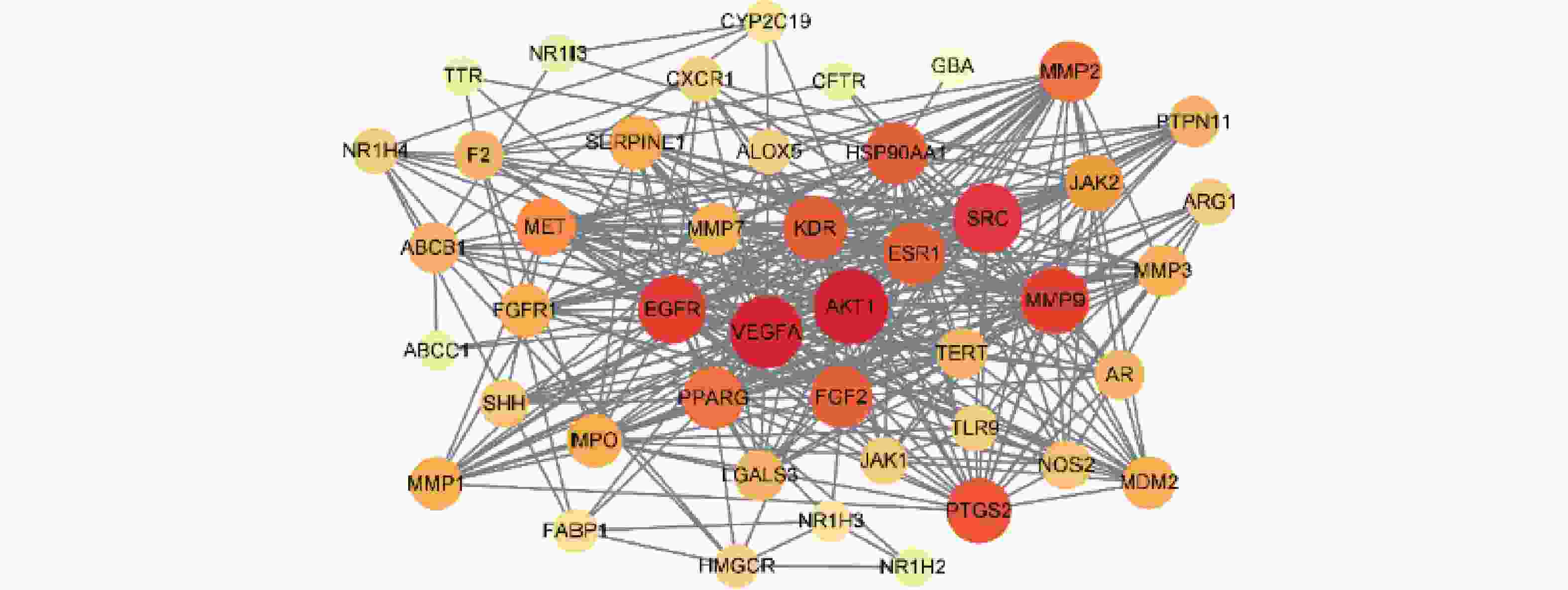
将白芍与肝纤维化共同作用靶点导入Cytoscape3.9.0软件进行网络分析(见图4)。Degree值越大,圆形的直径越大,颜色越红,说明在该网络中的关联度就越高,其中,Degree值排名前5的分别为丝氨酸/苏氨酸蛋白激酶1(AKT1)、血管内皮生长因子A(VEGFA)、肉瘤基因(SRC)、表皮生长因子受体(EGFR)和基质金属蛋白酶-9(MMP9),他们的Degree值分别为35、33、30、29和28。因此,推测这些靶点在白芍治疗肝纤维化过程中具有较为重要的作用。
-
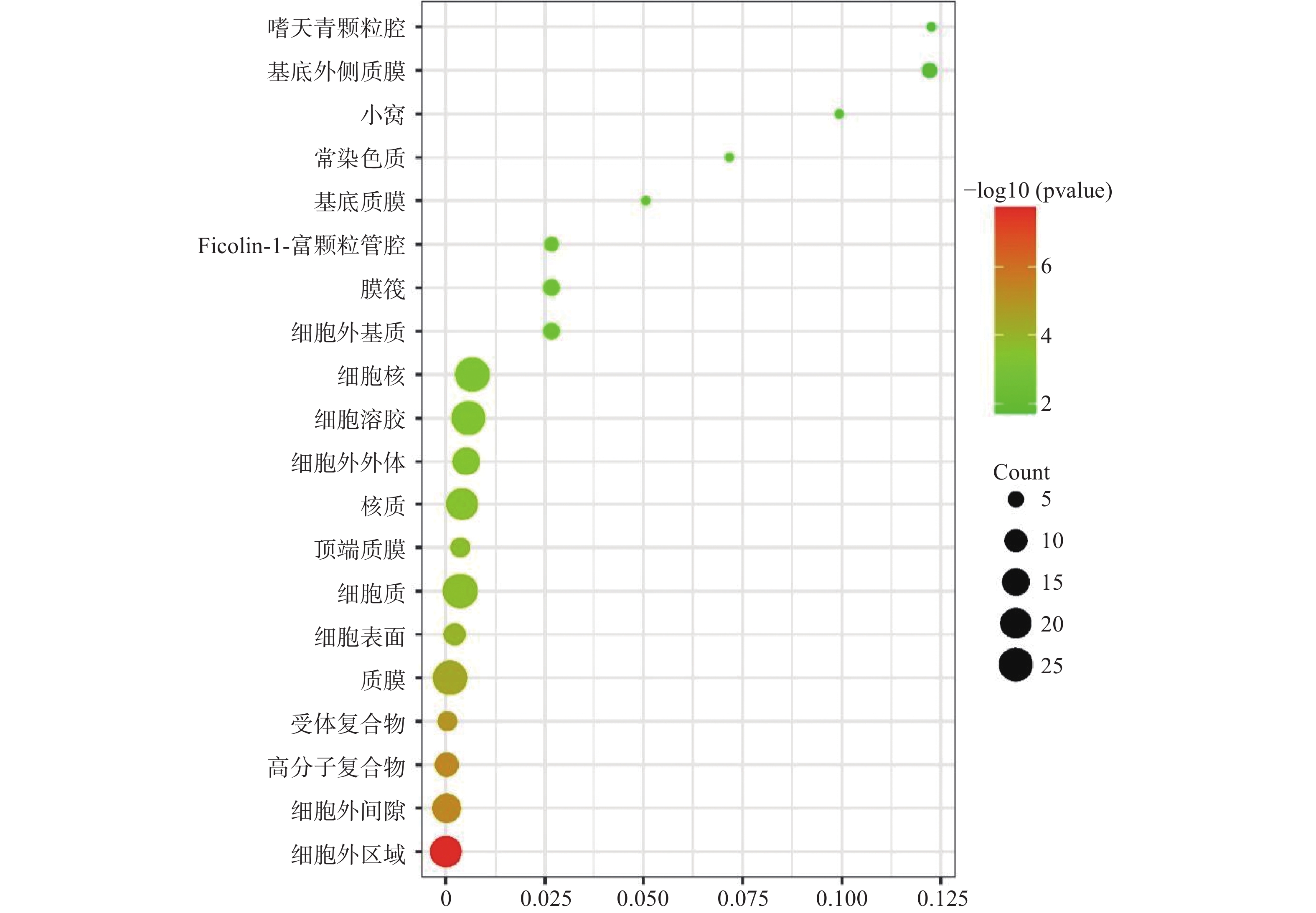
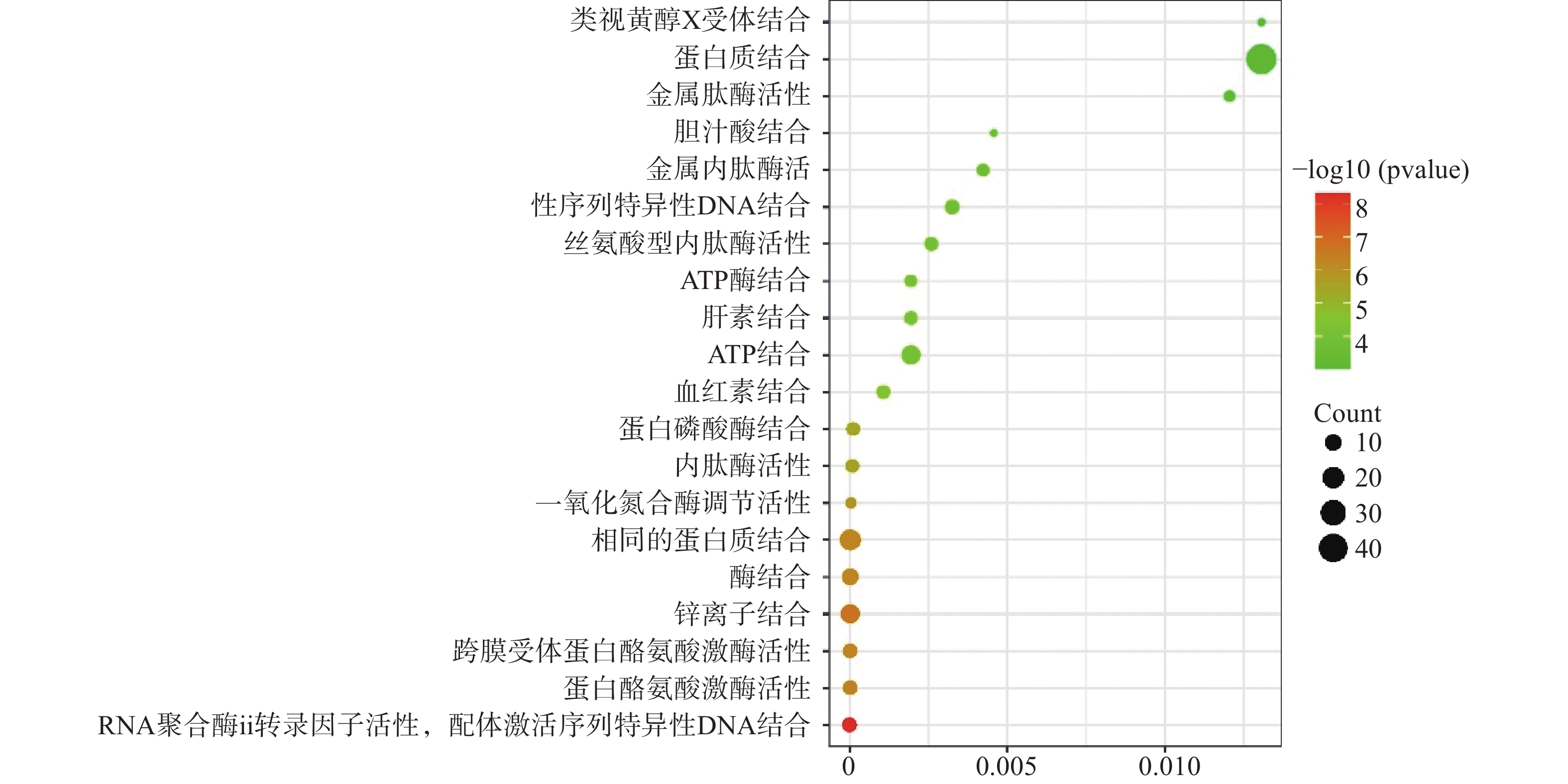
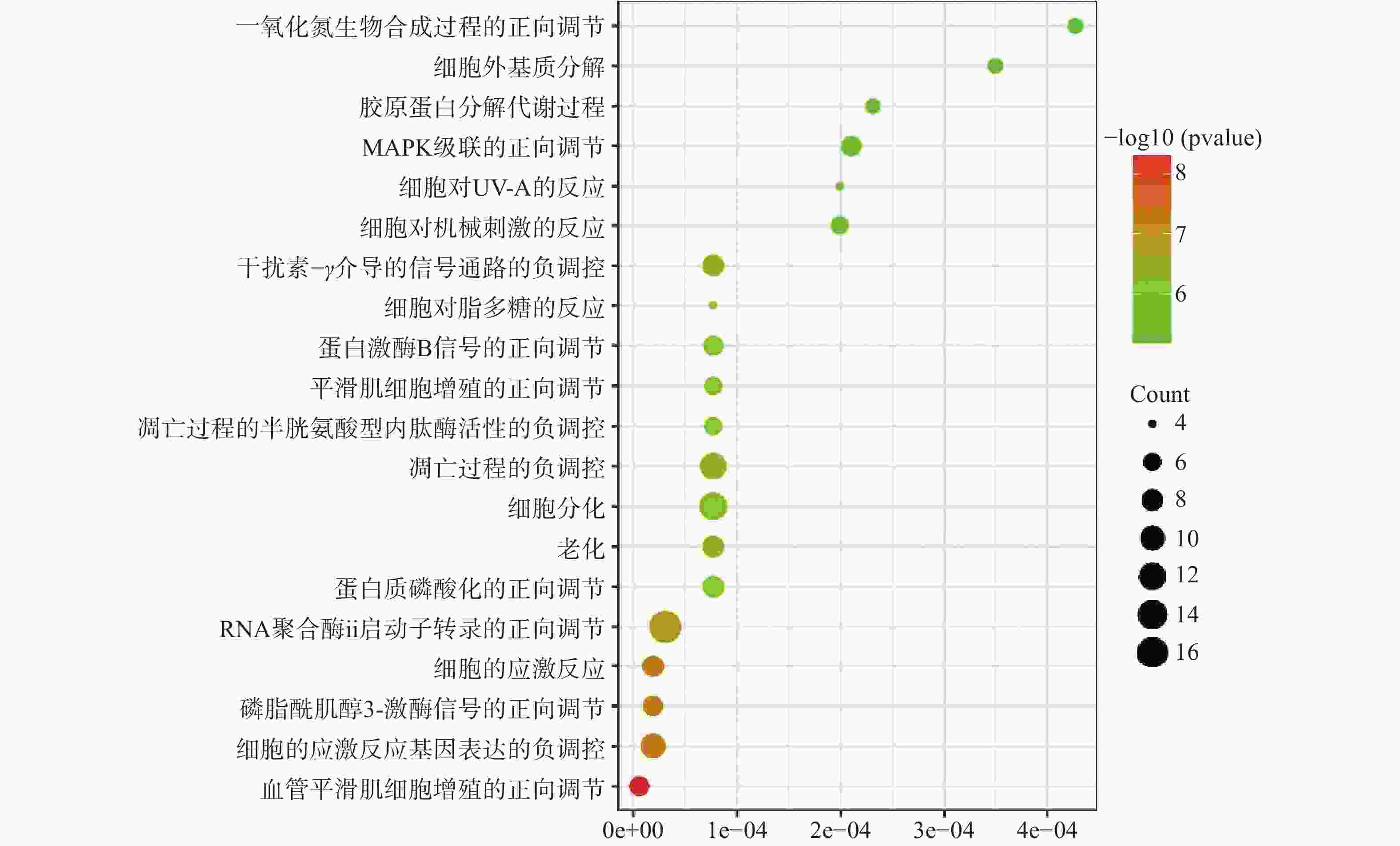
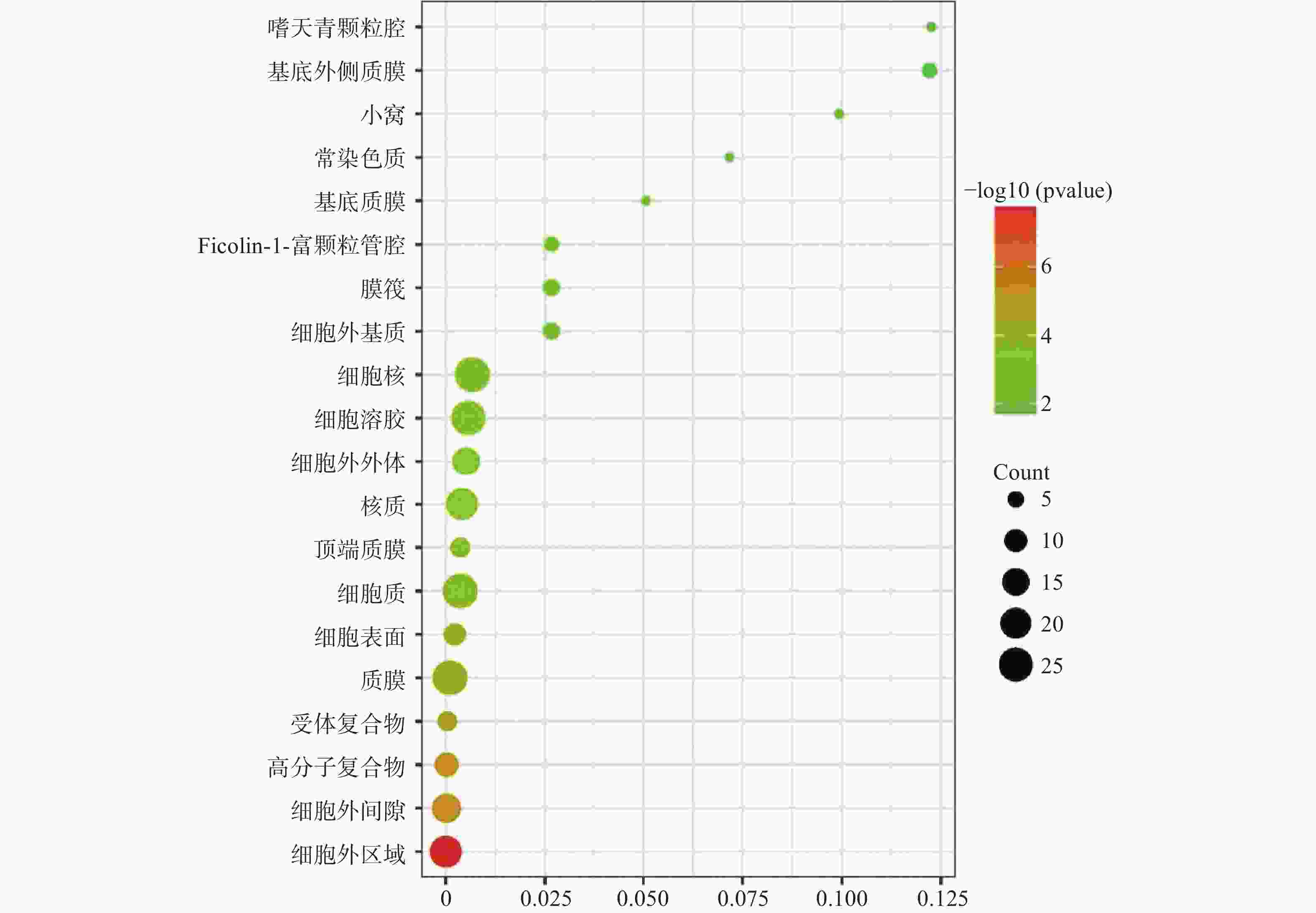
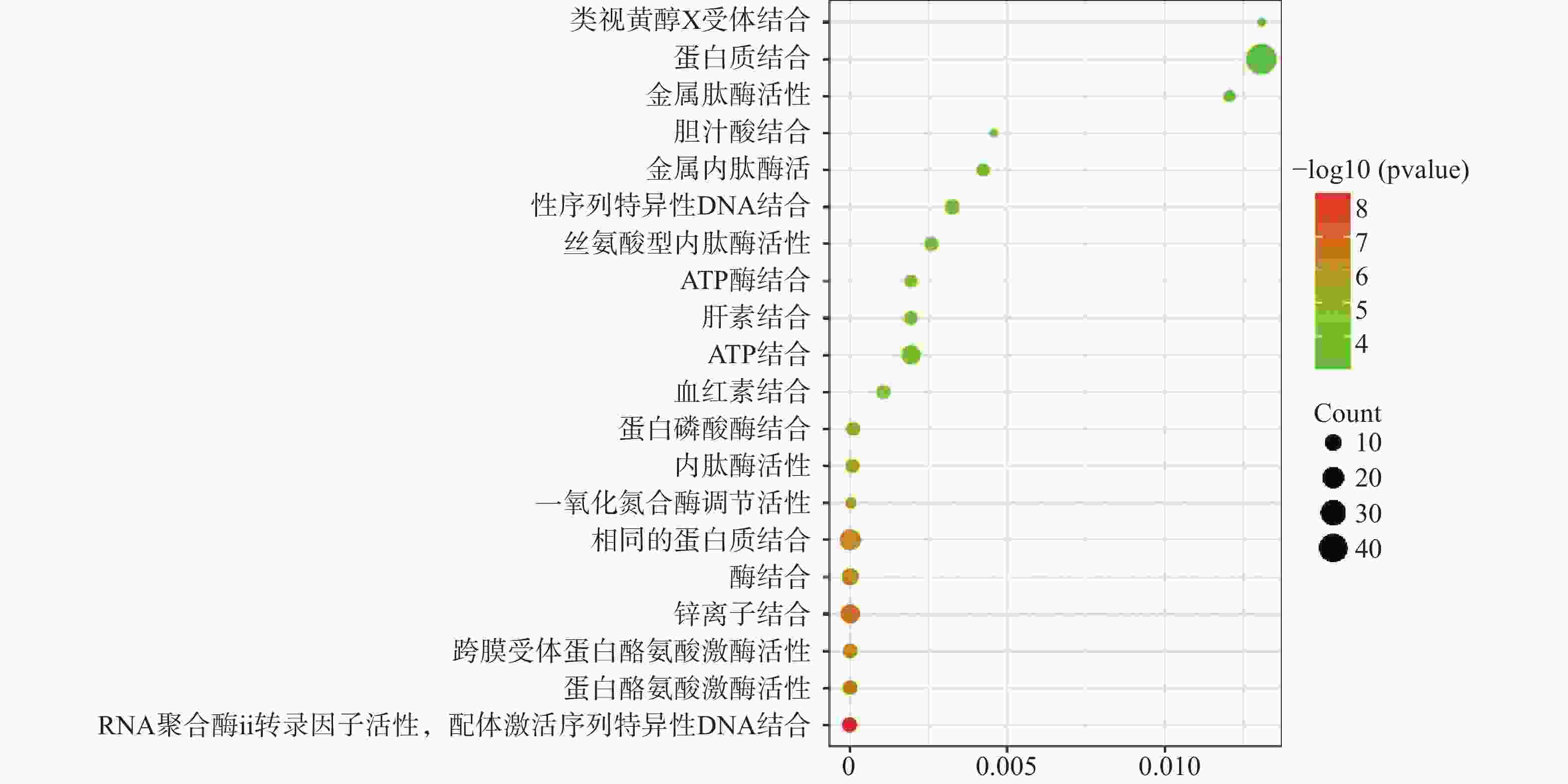
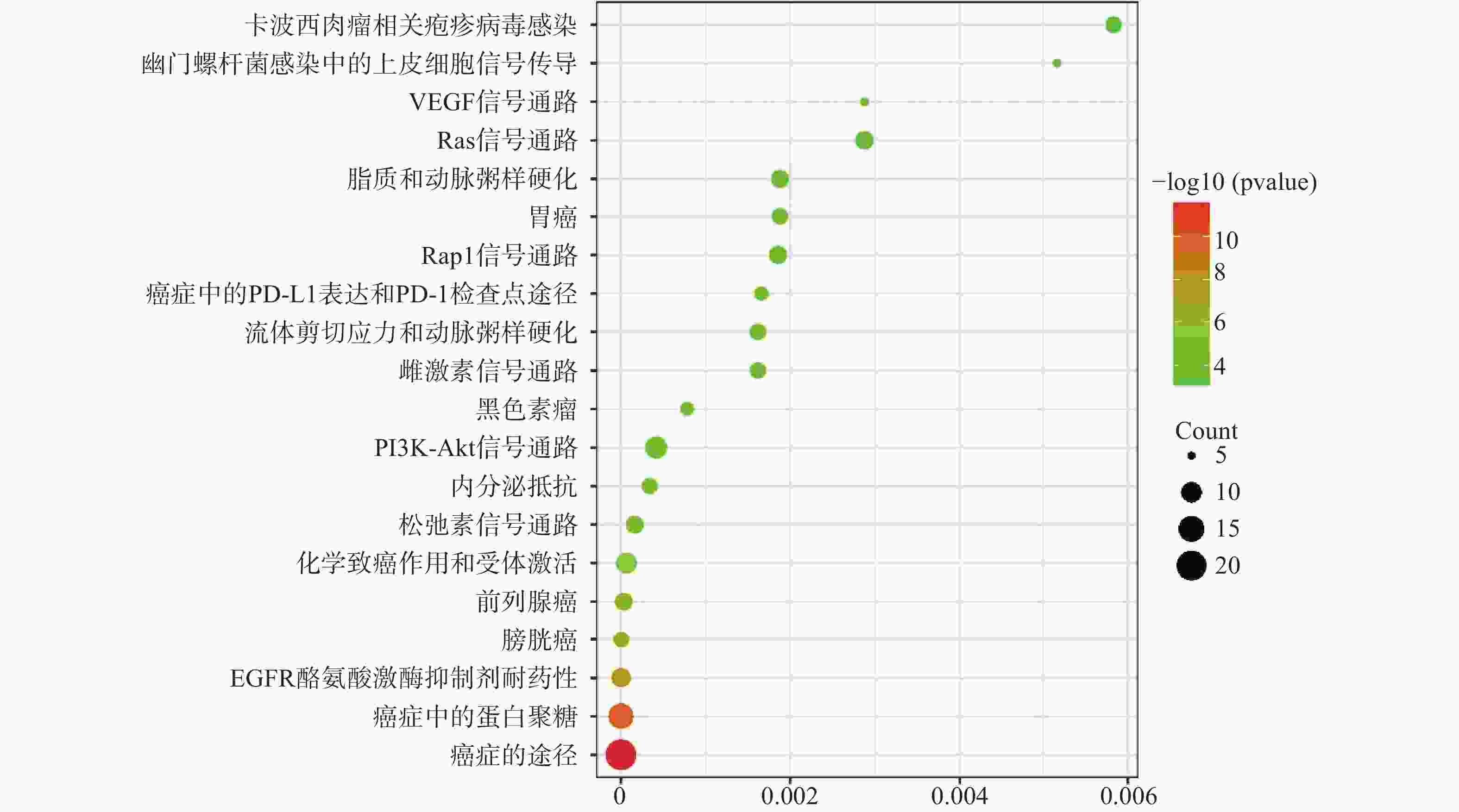
运用DAVID数据库,将药物与疾病的共同靶点进行GO(BP、CC、MF)分析以及KEGG分析,取P值<0.01,所得富集分析数据导入微生信平台,通过气泡图显示前20个分析结果。BP富集分析结果见图5、CC富集分析结果见图6、MF富集分析结果见图7、KEGG通路富集分析结果见图8。
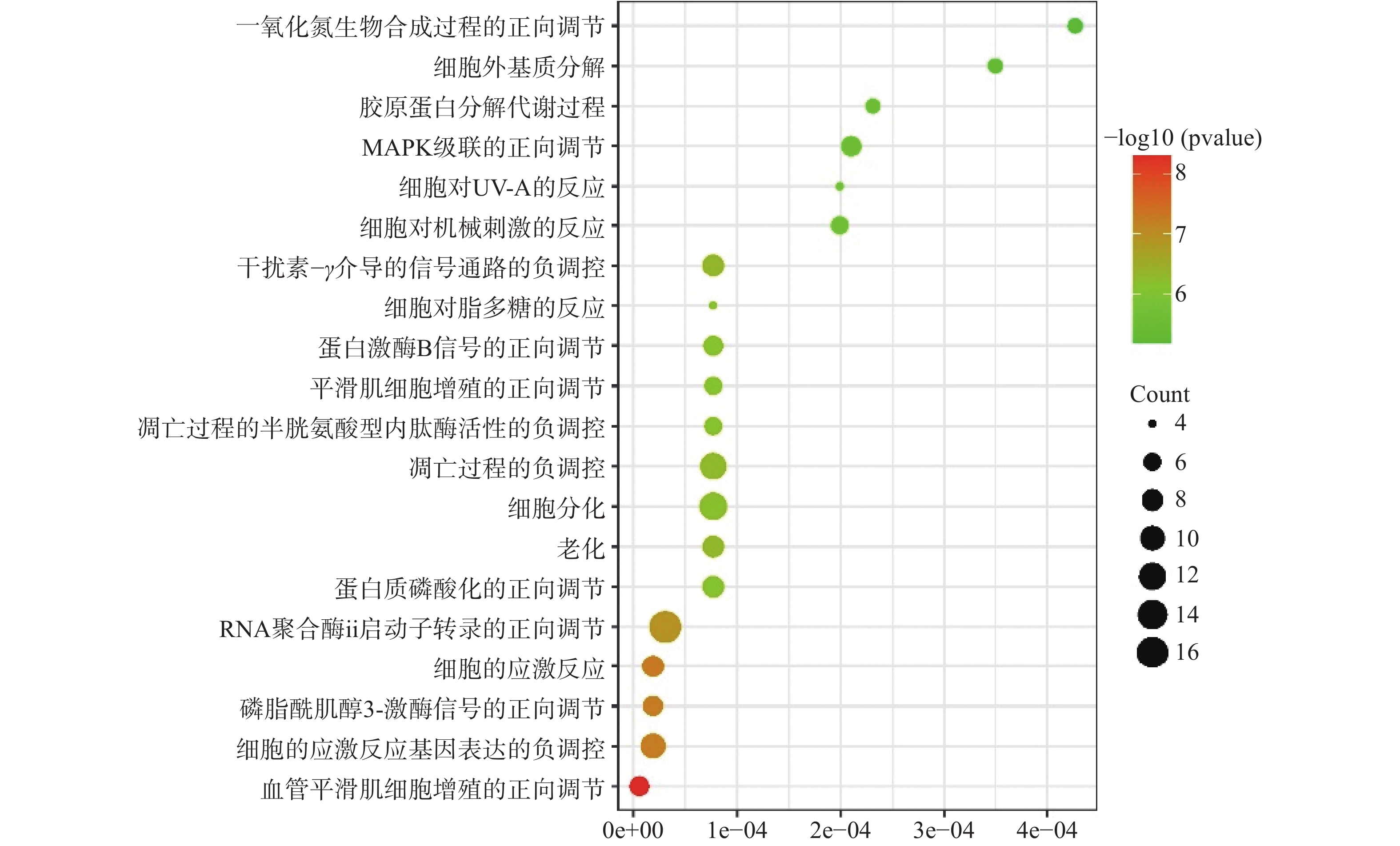
在GO富集分析中,分别对生物过程(BP)、细胞组成(CC)和分子功能(MF)的前20个条目制作气泡图进行可视化分析。其中,富集条目在纵坐标上表示,富集基因个数在横坐标上表示。图5显示的BP主要涉及血管平滑肌细胞增殖的正向调节、细胞应激反应、磷脂酰肌醇3-激酶信号的正向调节、基因表达的负调控等;图6显示的CC主要涉及细胞外基质、细胞外间隙、高分子复合物、受体复合体、质膜等部位;图7显示的MF主要涉及RNA聚合酶ⅱ转录因子活性、锌离子结合、蛋白酪氨酸激酶活性、跨膜受体蛋白激酶活性等,表明白芍在多种途径上对肝纤维化均产生影响。
KEGG通路富集分析共67条路径,选取前20个条目制作气泡图进行可视化分析,根据图8可知,与肝纤维化相关的分别有癌症通路(21个靶点)、癌症中的蛋白聚糖(14个靶点)、EGFR酪氨酸激酶抑制剂耐药性(9个靶点)、膀胱癌(8个靶点)、前列腺癌(7个靶点)等。其中涉及到的靶点基因,出现频率较高的为AKT1、EGFR、SRC、VEGFA、MMP3及MMP9。
-
肝纤维化的病理过程是由于肝细胞受损后,肝星状细胞(HSC)增殖活化,进一步分化成为肌成纤维(MFB),使细胞外基质(ECM)过度沉积的一种状态[8]。刘海成等[9]研究表明,中药对于肝纤维化的延缓及逆转是有效的。中药白芍味苦酸甘,性微寒,有敛阴止汗、柔肝止痛、平抑肝阳的功效[5],在肝纤维化治疗中疗效可靠。
本研究通过TCMSP数据库筛选白芍有效活性成分6个,分别是(3S,5R,8R,9R,10S,14S)-3,17-二羟基-4,4,8,10,14-五甲基-2,3,5,6,7,9-六氢-1H-环戊[a]菲-15,16-二酮、芍药苷、白桦脂酸、β-谷甾醇、谷甾醇及山萘酚。通过PubChem和Swiss Target Prediction数据库筛选出213个白芍作用靶点。通过GeneCards数据库和OMIM数据库检索并去重,筛出883个肝纤维化相关靶点。通过venny平台,取白芍作用靶点与肝纤维化靶点的交集部分,获得49个共同靶点。构建“白芍-有效成分-交集靶点-肝纤维化”网络图,得到白芍治疗肝纤维化的主要活性成分前四位分别为山奈酚、芍药苷、白桦脂酸及β-谷甾醇。将上述共同靶点导入String数据库,获得白芍与肝纤维化共同靶点蛋白PPI网络图,根据Degree值的大小筛选出5个关键靶点,分别是AKT1、EGFR、SRC、VEGFA、MMP3及MMP9。GO富集分析中显示白芍在生物过程、细胞组成、分子功能等多个途径上对肝纤维疾病均产生影响。KEGG通路富集分析中显示,癌症、炎症、EGFR酪氨酸激酶抑制剂耐药性等通路是白芍与肝纤维化疾病共同靶点富集最多的通路。
通过构建“白芍-有效成分-交集靶点-肝纤维化”网络图,可知白芍治疗肝纤维化的主要活性成分前四位为山萘酚、芍药苷、白桦脂酸及β-谷甾醇。山萘酚属于黄酮类化合物,具有抗炎、抗癌、免疫调节等作用[10],Taifu等 [11]研究发现,山萘酚可有效降低肝组织坏死程度,抑制胶原蛋白沉积和HSC活化。沈雨莎等[8]研究发现,芍药苷可通过抑制NOX、HIF-1α,激活Nrf2等的表达、抑制炎症因子的释放、在基因层面抑制NF-Kβ等多种途径抑制HSCs产生ECM发挥抗肝纤维化作用,从而形成抗炎保肝的作用[12]。白桦脂酸是三萜类化合物,具有抗炎、抗肿瘤等作用,通过增加MMP-13以及t-HSC/Cl-6细胞中P-STAT3的表达,发挥抗肝纤维化的作用[13]。Kripa等[14]研究发现,白术中的β-谷甾醇可有效降低佐剂诱导的关节炎大鼠血清和组织中的炎性指标含量,说明β-谷甾醇具有一定抗炎作用[15]。综上所述,白芍中的主要活性成分具有抗炎保肝等多种药理作用,这为治疗肝纤维化疾病提供支持,有一定的科学依据和研究价值。
GO富集分析显示269个生物过程、30个细胞组成、64个分子功能。根据此分析推测这些主要靶点主要集中在细胞外基质、细胞外间隙、高分子复合物、受体复合体、质膜等部位发挥作用,通过血管平滑肌细胞增殖的正向调节、细胞应激反应、磷脂酰肌醇3-激酶信号的正向调节、基因表达的负调控等生物过程,发挥RNA聚合酶ⅱ转录因子活性、锌离子结合、蛋白酪氨酸激酶活性、跨膜受体蛋白激酶活性等分子功能。KEGG通路富集分析显示共67条通路,排名较前列的通路集中在癌症、炎症、EGFR酪氨酸激酶抑制剂耐药性等通路。其中,癌症通路所连接的靶点最多(21个靶点),表明如抑制该通路可阻滞肝纤维化向肝癌发展。Feng等[16]研究发现,EGFR酪氨酸激酶抑制剂耐药性通路可通过抑制EGFR下游蛋白激酶B及其磷酸化,降低细胞周期蛋白B1的表达,从而抑制HSC增殖活化。
通过PPI网络的分析发现,Degree值较高的是AKT1、VEGFA、SRC、EGFR和MMP9,推测这些靶点在白芍治疗肝纤维化过程中具有较为重要的作用。AKT1是AKT激酶之一,AKT信号通路可通过抑制肝组织细胞EMT,发挥抗肝纤维化的作用[17]。VEGFA是促血管生成因子血管内皮生长因子A,肝细胞敲除VEGFA后可减轻血管内皮功能障碍,可抑制HSC活化增殖,进一步抑制肝纤维化[18]。SRC是肉瘤基因,可抑制HSC活化,从而抑制肝纤维化[19]。EGFR是表皮生长因子,可活化HSC,抑制其信号传导,可以起到延缓或逆转肝纤维化的作用[20]。MMP9 是基质金属蛋白酶-9,可直接或间接调控 ECM 的降解,研究表明其对肝纤维化的影响与炎症之间存在关联[21]。综上,这些靶点参与了肝纤维化的发展过程,主要涉及HSC的活化、炎症及ECM 的降解等,与当前研究相符,可作为药物的作用靶点。
本研究通过中药活性成分的筛选、靶点及有效活性成分的预测、蛋白相互作用网络图的构建等,利用网络药理学“多成分、多靶点、多途径”的分析方法,通过数据挖掘来阐述白芍治疗肝纤维化的作用机制,发现白芍多成分通过AKT1、VEGFA、SRC、EGFR和MMP9等多靶点,在HSC的活化、炎症及ECM的降解上抑制肝纤维化,并对肝纤维化的进程进行干预和调控。进而为开发治疗肝纤维化的中药新药提供有效的思路和方法。但是,本研究所得到的结果尚存一定局限性,因数据库数据有限会导致分析结果受限,获取靶点数量有限并不适用于新的作用靶点的发现,不能完全揭示药理作用。因此,为进一步明确白芍治疗肝纤维化的作用机制,仍需做相关动物实验进行深入验证,以准确揭示白芍抗肝纤维化的作用机制。
Mechanism of Radix Paeoniae Alba in the treatment of liver fibrosis based on network pharmacology
doi: 10.12206/j.issn.2097-2024.202208040
- Received Date: 2022-08-08
- Rev Recd Date: 2022-11-14
- Publish Date: 2023-08-25
-
Key words:
- Radix Paeoniae Alba /
- Liver fibrosis /
- Mechanism of action /
- network pharmacology
Abstract:
| Citation: | HUANG Qing, SHI Chunyan. Mechanism of Radix Paeoniae Alba in the treatment of liver fibrosis based on network pharmacology[J]. Journal of Pharmaceutical Practice and Service, 2023, 41(8): 485-491. doi: 10.12206/j.issn.2097-2024.202208040 |







 DownLoad:
DownLoad: