-
赤芍(Paeoniae Radix Rubra)为毛莨科植物芍药(Paeonia lactiflora Pall)或川赤芍(Paeonia veitchii Lynch)的干燥根,应用历史悠久,首载于《神农本草经》。赤芍之名最早在南北朝时期陶弘景所撰写的《本草经集注》中明确提出[1];其味苦,性微寒,归肝经,具有清热凉血、散瘀止痛、活血之功效,多用于热入营血,血热吐衄,斑疹紫暗,温毒发斑,热毒血瘀,肝郁肋痛等证[2-4]。
现代药理研究表明,赤芍作用广泛,主要含有赤芍苷、黄酮类及其苷、有机酸、挥发油及糖类等多种化学成分。本文就赤芍药理作用的研究进展进行综述,梳理赤芍已明确的药理作用及机制,为赤芍的进一步开发研究和临床应用提供科学依据。
HTML
-
继临床上广泛运用赤芍治疗黄疸性肝炎后赤芍的保肝作用成为一个研究热点。现代药理学研究发现,赤芍中发挥保肝作用的活性成分主要有芍药苷、棕榈酸乙酯及亚油酸乙酯。其保护肝脏的主要机制[5]为:抗氧化损伤;抑制炎性因子释放,改善肝脏微循环;降低肝脏总一氧化氮合酶(NOS)、诱导型一氧化氮合酶(iNOS)的活性及NO的量,阻断NO对肝脏的损伤。
-
赤芍主要通过减少氧化剂的产生,调节抗氧化的防御目标系统、维持细胞能量学系统来发挥抗氧化作用[6]。其中,赵艳玲等[7-9]发现芍药苷主要是通过减轻肝组织氧化应激来发挥保护肝脏的作用,它可以通过降低肝组织丙二醛(MDA)和NO的量,逆转还原型辅酶Ⅱ(NADPH)氧化酶4(NOX4)的过度表达,来抑制活性氧(ROS)的产生,增加谷胱甘肽(GSH)的量,从而避免肝氧化损伤。此外,赤芍多糖通过对自由基与超氧阴离子的清除发挥抗氧化作用,且清除率和多糖浓度呈量效关系[10];有研究表明[11],赤芍水提物可显著增加小鼠血清超氧化物歧化酶(SOD)和谷胱甘肽过氧化物酶(GSH-Px)的活性,降低MDA量,从而发挥抗氧化活性,赤芍中的没食子酸丙酯同样具有抗氧化作用。
-
赤芍发挥抗炎的化学成分主要有棕榈酸乙酯、亚油酸乙酯等。棕榈酸乙酯可以通过降低肿瘤坏死因子(TNF-α)和白介素-6(IL-6)水平,降低肝脏组织核转录因子κB(NF-κB)的表达,抑制髓过氧化物酶(MPO)活性导致中性粒细胞浸润的减少等[12],从而发挥抗炎作用来保护肝脏。亚油酸乙酯可通过NF-κB易位受损和抑制丝裂原活化蛋白激酶磷酸化,下调iNOS和环氧合酶-2(COX-2)的表达,减少NO和前列腺素E2的产生,发挥保护肝脏的作用[13]。
-
罗琳等[14]通过体内实验研究发现,赤芍总苷(TPG)下调α-萘异硫氰酸酯(ANIT)诱导的黄疸模型小鼠的血清生化指标(总胆红素、直接胆红素、胆汁酸、丙氨酸转氨酶、天冬氨酸转氨酶、碱性磷酸酶等)。此外,TPG可通过增加小鼠胆汁分泌量、提高肝组织中的肝药酶及尿苷二磷酸葡萄糖酸转移酶(UDPG-T)的活性,发挥退黄降酶的作用;赤芍还可上调胆碱、5-甲基四氢叶酸水平而起到保肝作用[15]。
-
肝组织中高水平的IL-13与日本血吸虫诱导的肉芽肿相关肝纤维化的发展密切相关,而IL-13受体a2(IL-13Ra2)能减轻纤维化。Li等[16]用赤芍苷对日本血吸虫幼虫通过皮肤感染建立的BALB/c小鼠肝纤维化模型进行治疗,结果显示赤芍苷干预后肝组织中羟脯氨酸(HYP)、胶原蛋白I和III被显著抑制。同时,与模型对照组相比,赤芍苷不仅抑制了小鼠肝组织中IL-13的分泌,还提高了IL-13Ra2的含量。以上结果均表明赤芍苷可以改善日本血吸虫感染引起的肝纤维化。
1.1. 抗氧化作用
1.2. 抗炎作用
1.3. 退黄降酶作用
1.4. 抗肝纤维化作用
-
赤芍可通过多种途径,如调节免疫系统、抑制肿瘤细胞G0/G1期的比例及向S期细胞的转化、下调肿瘤细胞中抗凋亡基因蛋白以及上调拮抗促凋亡基因蛋白的表达等,抑制肿瘤细胞的生长和转移,导致肿瘤细胞的死亡。
许惠玉等[17-19]研究表明,TPG主要通过线粒体途径诱导肿瘤细胞死亡。TPG一方面提高细胞内的钙离子浓度,诱导肿瘤细胞的凋亡,另一方面引起线粒体的膜电位下降,并释放细胞色素C到细胞液中。此外,TPG可抑制bcl-2、bcl-xL等的表达,从而上调bax、p16的表达。在免疫系统方面,TPG能够增加荷瘤鼠的胸腺指数、脾指数及白介素-12(IL-12)的分泌,降低白介素-10(IL-10),转化生长因子-β1(TGF-β1)的分泌,改善荷瘤机体的Th1/Th2漂移现象,从而调节荷瘤鼠的免疫功能;TPG通过提高小鼠腹腔巨噬细胞吞噬指数,增强B淋巴细胞产生抗体的能力和T淋巴细胞的增殖能力,从而调节CD4+/CD8+细胞的比例,达到对化疗后小鼠免疫抑制状态的逆转。
CD4+T细胞分为Thl细胞和Th2细胞,它们分泌着不同的细胞因子。Thl细胞主要分泌白介素-2(IL-2),参与细胞毒性T淋巴细胞(CTL)介导的细胞免疫,在抗肿瘤和抗细胞内感染发挥重要作用;Th2细胞主要分泌白介素-4(IL-4),其功能是刺激B细胞增殖,促进抗体产生,从而参与体液免疫,并在由过敏原引起的抗细胞外感染和免疫应答中起主要作用。而Xu等[20]在TPG对S180荷瘤小鼠抗肿瘤的相关研究中,得出TPG可以上调IL-2和IL-4的表达,通过免疫作用发挥抗肿瘤的作用。相关研究报道[21-22]表明,TPG可通过上调p21、p27、p53的表达和下调增殖细胞核抗原、周期蛋白D的表达,抑制人黑色素瘤的增殖;而TPG通过下调金属蛋白酶-2/9(MMP-2/9)及上调基质金属蛋白酶组织抑制因子2(TIMP-2)水平,使MMP-TIMP达到平衡,从而影响黑色素瘤细胞迁移和侵袭;还可下调细胞多药耐药基因1、拓扑异构酶Ⅱ同工酶、多药耐药相关蛋白1(MRP1)的mRNA及蛋白的表达。也有研究显示[23],赤芍中的没食子酸和川芎的没食子酸可通过二者的协同作用,诱导LTB4DH抑癌基因的表达来发挥抗肿瘤作用。
-
芍药苷通过抑制细胞凋亡、活化腺苷A1受体、阻断钠通道、减轻细胞钙超载损伤等作用机制发挥保护神经细胞的作用。此外,M胆碱受体、阿片受体、NF-κB也都可能参与了芍药苷对神经系统的作用。有研究表明[24],芍药苷及其同分异构体芍药内酯苷均能够改善谷氨酸引起的细胞活性的降低,降低活性氧的积累以及调节Bcl-2/Bax的比例,从而发挥一定的神经保护作用,但起到抑制细胞内的Ca2+的超载和钙/钙调蛋白激酶Ⅱ表达的作用为芍药苷,而非芍药内酯苷。同时,Kapoor[25]也报道,芍药苷是通过PC12细胞中的Bcl-2/Bax信号通路防止谷氨酸诱导的神经毒性来发挥神经保护作用。Guo等[26]通过芍药苷可以预防小鼠缺血引起的脑损伤的实验,证明芍药苷可能是一种潜在的对中风时神经损伤的保护剂。
芍药还可以抗抑郁,其作用机制可能是提高单胺类神经递质的量、调节下丘脑-垂体-肾上腺轴的功能异常、修复受损神经元、抑制单胺氧化酶表达、增强神经保护作用等[27]。研究表明[28],芍药内酯苷和芍药苷均能够降低急性应激小鼠中IL-6的量,并且芍药苷可以降低急性应激小鼠血浆中皮质酮的分泌,芍药内酯苷可以上调急性应激小鼠脑组织中单胺类神经递质水平,进而发挥抗抑郁的作用。Mao等[29]发现芍药苷可减少氧化应激和上调神经生长因子的表达从而表现出抗抑郁作用。TPG可抑制糖基化-氧化应激反应,降低早期糖基化终产物及脂质过氧化产物浓度,抑制应激醛糖还原酶活性,改善D-gal诱导衰老大鼠学习记忆能力,且呈剂量依赖性[30]。Hu等[31]研究发现,以芍药苷为主要成分的中药活性部位JD-30能够明显改善β-淀粉样蛋白侧脑室注射的小鼠和快速老化模型小鼠学习记忆功能的下降。
-
赤芍可以通过避免氧化损伤、调节凋亡基因与促凋亡基因的表达,以及维持细胞内外环境的平衡来发挥对心脏的保护作用。TPG可通过调节多种心肌酶、脂质氧化产物MDA等水平而发挥心肌保护作用[32],且呈剂量依赖性[33];TPG还可延长凝血酶原时间和活化部分凝血酶原时间等;TPG亦可明显改善心血管系统功能[34],降低NOX2和NOX4的表达和NOX的活性[35],从而减少氧化应激而达到保护肌细胞的作用。芍药苷可抑制促炎介质如TNF-α、IL-1β、iNOS等的上调,从而抑制JNK,p38 MAPK的活化,最终对缺血性脑损伤发挥保护作用[26]。
TPG可以通过降低血液黏度、纤维蛋白原量、红细胞聚集指数、血小板聚集等来发挥抗凝血、抗血栓的作用。一方面,TPG可显著降低血小板与红细胞的聚集,增强红细胞的变形能力,活化及延长凝血酶原时间,降低高、低切变率下全血黏度及血浆黏度,从而减少血栓的生成[36];另一方面,赤芍的乙醇提取物可舒张内膜,从而激活KCa与KATP介导的AKT-e NOS-c GMP和SOCE-e NOS-c GMP通路,抑制L型钙离子通道,达到扩张血管的作用[37]。
-
章津铭等[38]通过实验发现,高剂量的TPG可抑制幽门结扎型胃溃疡大鼠胃液量、总酸度及胃蛋白酶活性,增加大鼠血清中NO含量,提高血清中SOD活性并降低MDA含量,说明TPG主要是通过减少胃酸分泌、增加胃部血流量和清除氧自由基的能力发挥抗幽门结扎型胃溃疡的作用;Hino等[39]在海马神经元细胞实验中,发现赤芍苷可抑制谷氨酸诱导的细胞内Ca2+的升高、谷氨酸受体介导的膜去极化和谷氨酸诱导的神经元死亡,还可部分抑制代谢型谷氨酸受体5(mGluR5)激活引起的Ca2+升高,但对α-氨基-3-羟基-5-甲基-4-异恶唑丙酸或N-甲基-D-天冬氨酸受体介导的升高以及海马神经元c-氨基丁酸的产生和释放无影响。这些结果都表明,赤芍苷可通过部分阻止mGluR5依赖性Ca2+释放而发挥抗惊厥作用;Chen等[40]通过实验发现芍药苷可降低组胺能性结节-基底膜核(TMN)c-fos的表达,而腺苷A1受体拮抗剂8-环戊基-1,3-二甲基黄嘌呤(CPT)可逆转赤芍苷诱导的小鼠体内c-fos的变化,且在腺苷A1受体敲除的小鼠中未观察到赤芍苷诱导的睡眠。这些结果都表明,芍药苷可通过腺苷A1受体抑制组胺能系统,从而增加非快动眼睡眠。研究显示[41-42],芍药苷可抑制β-抑制蛋白2抗体的表达,同时下调环磷酸腺苷-蛋白激酶A信号,改善G蛋白偶联受体信号转导的过度脱敏,降低炎性因子水平,从而抑制人类成纤维样滑膜的增殖和炎症的发生,同时,目前的研究数据表明,芍药苷在发挥神经保护作用时显著降低了AD小鼠NF-κBp65、TNF-α、IL-1β和IL-6的活性,从而达到抑制炎症的作用[43];Sun等[44]指出芍药苷可以抑制哮喘小鼠的炎症反应;Jiang等[45]报道芍药苷可抑制实验性败血症的全身炎症反应和NF-κB的活化。以上相关研究都证明赤芍对炎症有很好的抑制作用。
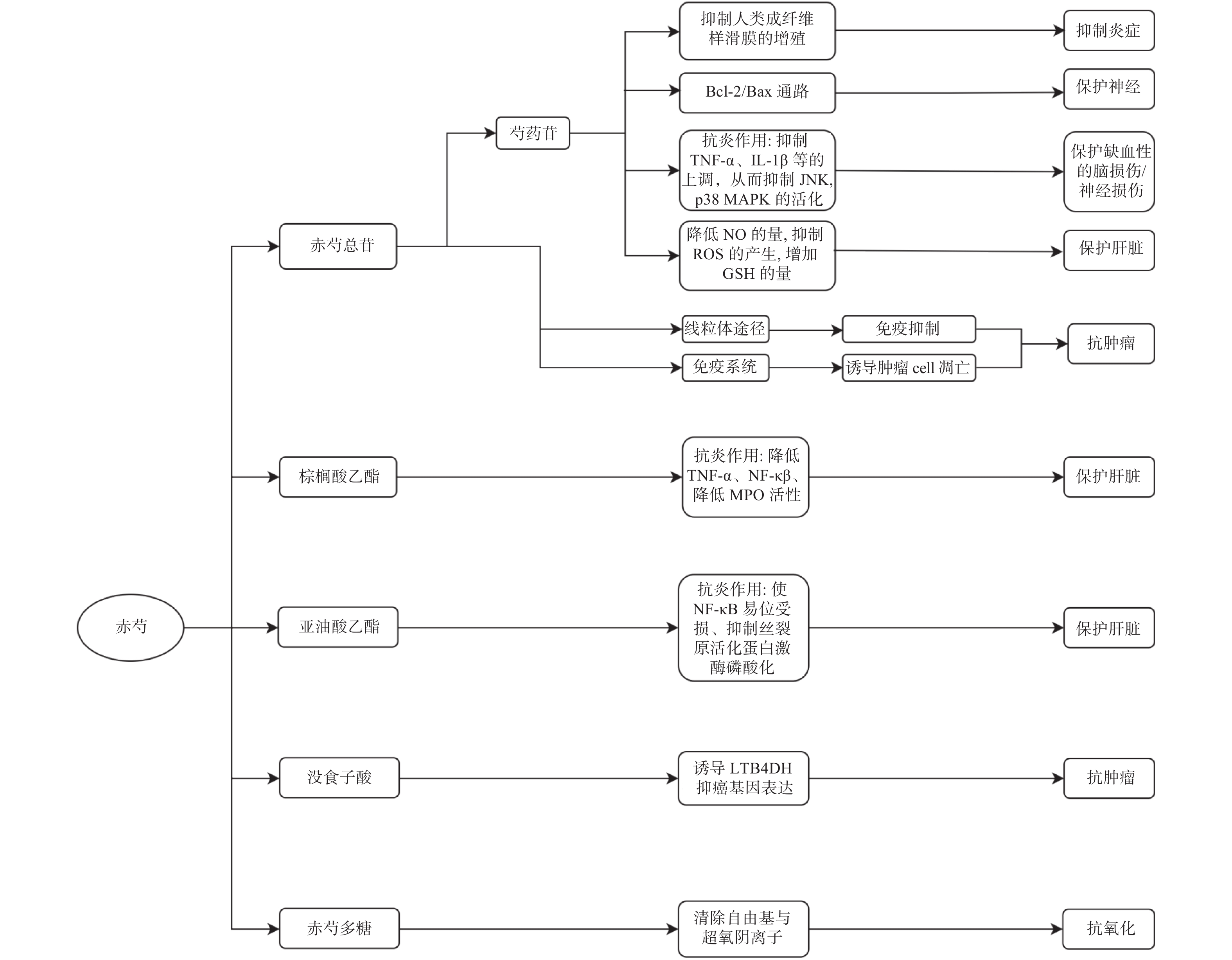
对赤芍主要成分、药理作用及机制总结如图1。
赤芍因其广泛而显著的药理作用,备受国内外中医药界人士的推崇。近年来,随着高效、高灵敏度的检测技术和方法学的进步,多种新的化合物被发现,为赤芍的物质基础及药理作用机制研究提供了更多、更扎实的理论依据。目前,赤芍的研究多集中于单萜苷类成分,研究发现赤芍苷具有保肝、抗肿瘤及神经保护等多种有效作用,但相关的临床药物研究较少。此外,由于中药的多成分、多靶点、多疗效的特点,仅对单一成分的药理作用机制进行研究是不完善的,对其他成分如多糖、黄酮等的药理作用及其机制研究仍不可忽视。因此,明确赤芍的化学成分,阐明其药效物质基础,利用赤芍开发出更多安全有效的药物仍是我们未来需要努力的方向。








 DownLoad:
DownLoad: