-
颅内感染尤其是多重耐药菌感染具有进展快、反应重、治疗难度大、病死率高的特点,故提高颅内感染治愈率受到患者及临床的广泛关注。替加环素(TGC)作为首个甘氨酰四环素类抗菌药物,具有抗菌谱广、抗耐药活性强的特点,对临床上常见耐药菌(如鲍曼不动杆菌、产碳青霉烯酶肺炎克雷伯菌、耐甲氧西林金黄色葡萄球菌等)均有较好的疗效[1]。在耐药菌治疗药物不足的情况下,临床医生将TGC用于颅内感染的治疗,此外,越来越多的案例报道称,TGC可有效清除致病菌[2-3]。
TGC成功治疗颅内感染与脑脊液中有效药物浓度密切相关,TGC浓度监测对于提高颅内感染治愈率、精准指导临床合理用药具有重要意义[4]。本研究将利用二维液相色谱高效的自动化在线样品处理能力,建立脑脊液中TGC浓度测定方法。该方法与已报道的质谱法相比,具有操作简便、成本低、抗干扰能力强、基质效应小等优势,脑脊液样品无需复杂的前处理,高速离心后直接进样,短时间内即可完成萃取、转移及分析,更易于临床推广应用。
HTML
-
二维高效液相色谱由FLC-2701全自动二维液相色谱耦合仪(湖南德米特仪器有限公司)和LC-20A色谱模块(日本岛津公司)构成;−80 ℃冰箱(美国赛默飞科技公司);十万分之一电子天平(德国赛多利斯仪器公司);涡旋混匀器(美国SI仪器公司);低温高速离心机(美国贝克曼仪器公司)。
-
TGC对照品(北京百灵威科技公司,批号: 10-MWV-62-1);乙腈、甲醇、磷酸为色谱纯;高氯酸、氨水为分析纯;超纯水自制。
-
入住神经外科且未使用TGC的患者,住院期间需开展脑脊液生化检查时留取或从留置腰大池/脑室引流管中适量抽取。
1.1. 仪器
1.2. 药品与试剂
1.3. 空白脑脊液
-
精密称取TGC对照品1.29 mg,用20 mg/ml精氨酸水溶液定容至100 ml容量瓶中,即得12.90 μg/ml的TGC标准溶液。
-
预处理方法考察时,取脑脊液样品500 μl,直接离心、分别加入3倍体积甲醇、乙腈、10%高氯酸沉淀蛋白,涡旋混匀5 min,13 000 r/min离心10 min,取上清液进样分析。最终确定预处理方法为: 脑脊液样品13 000 r/min离心10 min后直接进样,采用外标法定量分析。
-
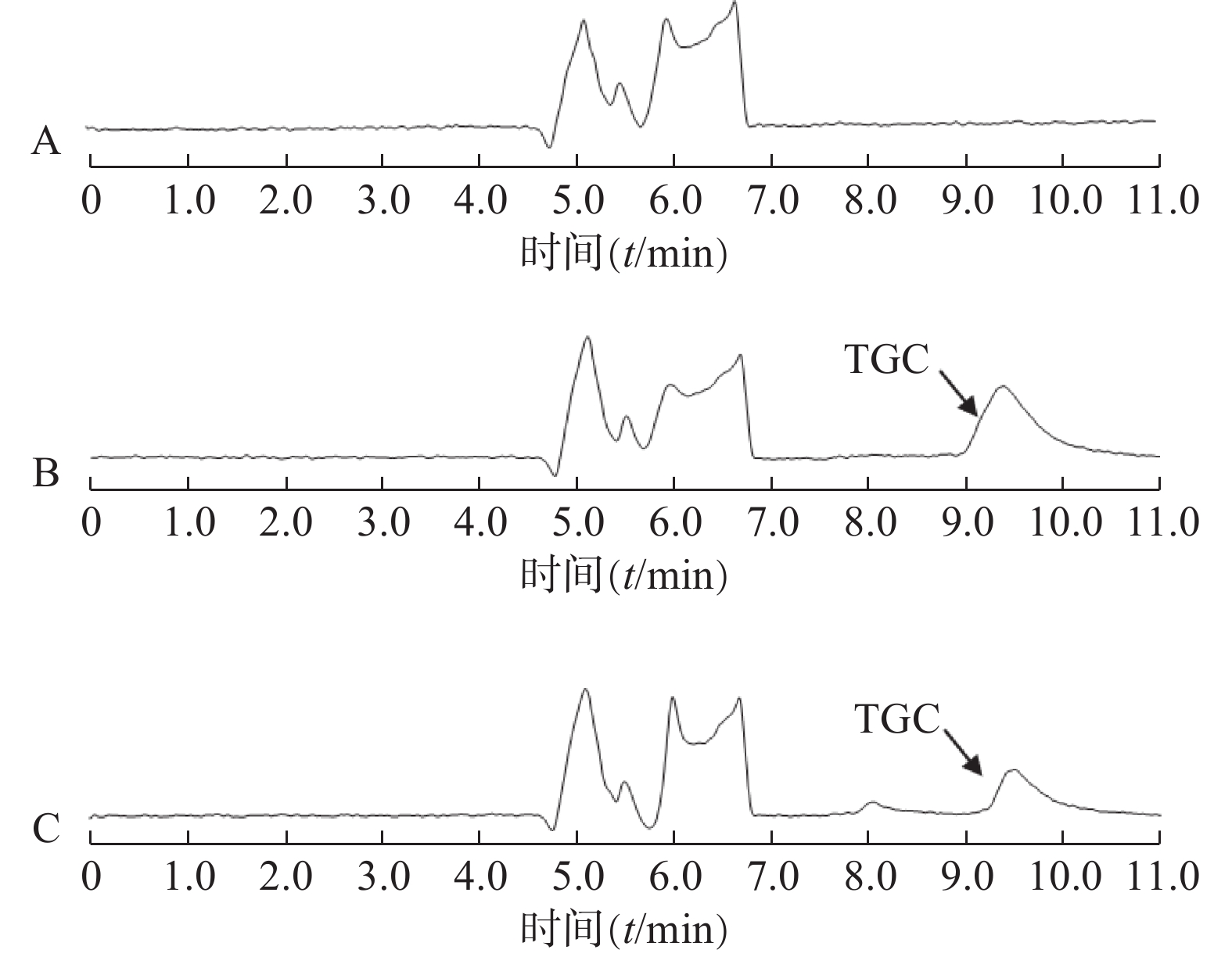
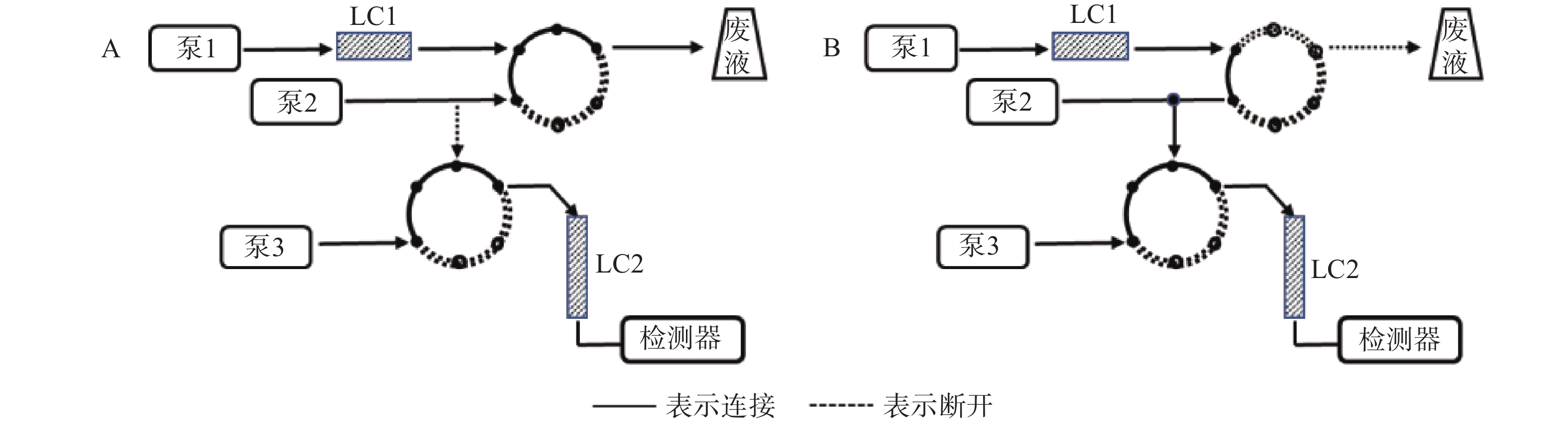
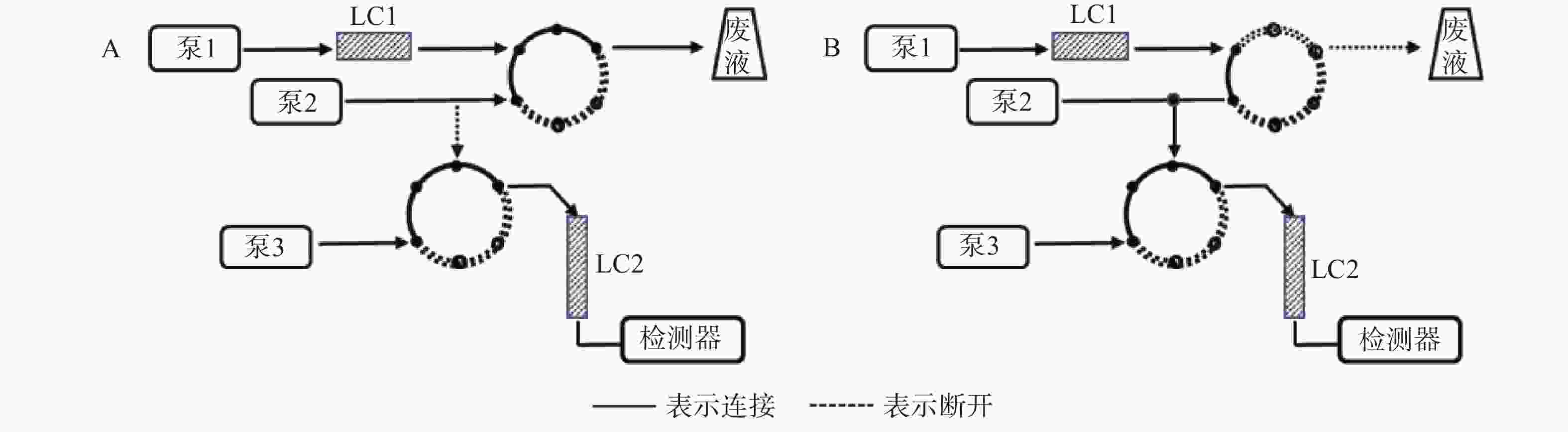
第一维色谱柱LC1为Aston SNX5苯基色谱柱(50 mm×4.6 mm,5 μm),流动相为磷酸铵(氨水调pH7.5)-甲醇 (45∶55,V/V),第二维色谱柱LC2为Aston SC5 C18色谱柱(275 mm×4.6 mm,5 μm),流动相为磷酸铵(氨水调pH7.4)-磷酸铵(氨水调pH3.0)-乙腈(30∶50∶20,V/V/V),辅助流动相为纯化水。检测波长340 nm,色谱柱温40 ℃,进样量:200 μl,工作原理图见图1,时间程序见表1。
时间(t/min) 流速(ml/min) 功能 LC1 LC2 辅助流动相 0.01~0.80 1.00 1.20 2.00 脑脊液样品于LC1中富集 0.81~3.49 1.00 1.20 0.01 目标物在LC1中初步分离 3.50~5.50 1.00 1.20 0.01 LC1与LC2串联,目标物洗脱至LC2 5.51~11.00 1.50 1.20 0.01 目标物在LC2中洗脱分离,清洗泵反向冲洗LC1 -
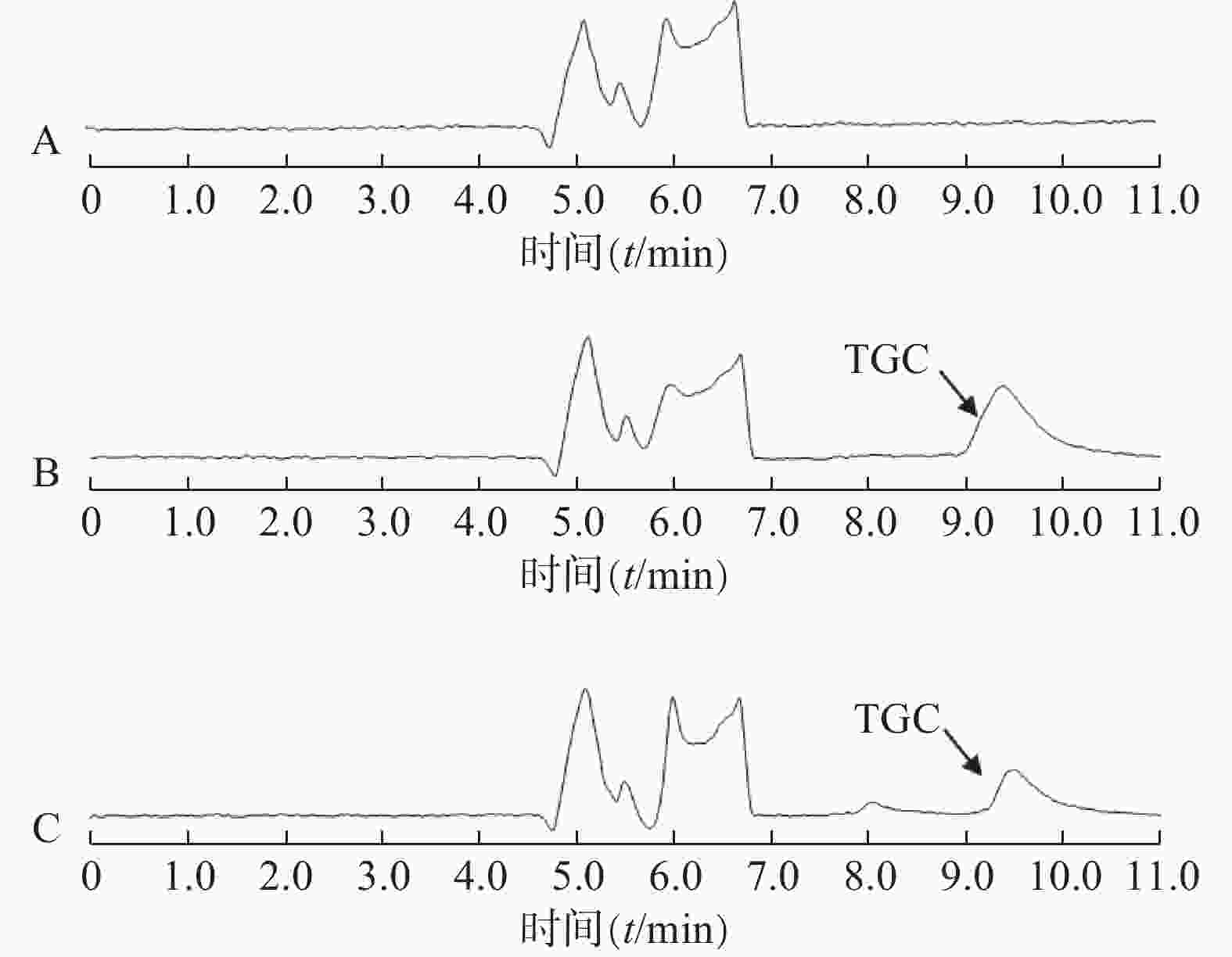
分别制备空白脑脊液样品、含TGC的标准脑脊液样品、患者用药后的脑脊液样品,进行二维液相分析,得到色图谱,观察有无内源性干扰,如图2所示。结果表明,TGC的出峰时间9.38 min,脑脊液的内源性成分对TGC的测定无干扰。
-
取不同体积TGC标准溶液,加入空白脑脊液定容,配制成浓度为64.5、129.0、387.0、645.0、1 290.0 ng/ml的系列对照溶液,按“2.2”项下操作后进样分析。以TGC浓度为自变量(X),脑脊液中TGC的峰面积为因变量(Y)进行线性回归,得回归方程为:Y=116.32X-3 223.6(r=0.999 8)。结果表明TGC浓度在64.5~1 290.0 ng/ml范围内线性关系良好,最低定量限为64.5 ng/ml。
-
分别配制含TGC低、中、高及定量下限(225.0、450.0、900.0、64.5 ng/ml)4个浓度的质控(QC)脑脊液样本,按“2.2”项下操作后进样分析。1 d内每个浓度平行测定5份QC样品,连续测定3 d。将测得的峰面积代入“2.4.2”项下,计算各质控样品的浓度,并根据样本实际浓度计算本法的精密度与准确度。结果如表2所示,日内、日间RSD均小于5%,准确度均在98.80%~106.51%之间。可见本实验所建立的二维液相色谱法测定脑脊液中TGC的精密度和准确度符合《中国药典》(2015年版)检测要求[5]。
浓度(ng/ml) 日内(n=5) 日间(n=3) 准确度 RSD 准确度 RSD 225.0 100.31 ± 2.83 2.82 98.80 ± 0.95 0.96 450.0 104.58 ± 2.19 2.09 103.51 ± 2.72 2.63 900.0 106.51 ± 2.06 1.94 101.82 ± 4.28 4.20 64.5 105.04 ± 2.47 2.35 99.01 ± 2.05 2.08 -
配制“2.4.3”项下低、中、高及定量下限4个浓度的QC样品,每个浓度平行3份,分别考察室温放置4 h、进样器放置6 h、反复冻融3次、冰冻放置1周后的稳定性。结果如表3所示,表明上述条件对TGC的检测结果无明显影响。
样品浓度(ng/ml) 室温放置4 h 进样器放置6 h 反复冻融3次 冰冻放置1周 平均浓度(ng/ml) RSD(%) 平均浓度(ng/ml) RSD(%) 平均浓度(ng/ml) RSD(%) 平均浓度(ng/ml) RSD(%) 64.5 68.67 ± 2.93 4.27 65.52 ± 1.52 2.32 65.01 ± 1.43 2.20 68.56 ± 3.06 4.46 225 223.16 ± 5.06 2.27 221.62 ± 2.45 1.11 224.72 ± 4.50 2.00 222.99 ± 5.40 2.42 450 452.44 ± 9.11 2.01 459.04 ± 13.45 2.93 464.03 ± 8.39 1.81 459.68 ± 8.25 1.80 900 885.14 ± 15.09 1.70 881.32 ± 13.36 1.52 888.13 ± 13.80 1.55 899.79 ± 10.13 1.13 -
本实验选取2例接受TGC治疗的多重耐药菌所致的重症颅内感染患者,脑脊液标本药敏试验均报告对TGC敏感。患者1接受说明书推荐剂量,即首剂静脉滴注100 mg,后以50 mg每12 h维持治疗。患者2同样接受静脉给药,剂量为受试者1的2倍。达到稳定药物浓度后,留取两位受试者的脑脊液,按“2.2”项下操作后进样分析。受试者脑脊液中TGC浓度分别为187.42、275.41 ng/ml。
2.1. 标准溶液的配制
2.2. 样品前处理
2.3. 色谱条件
2.4. 方法学考察
2.4.1. 专属性
2.4.2. 线性关系
2.4.3. 精密度与准确度
2.4.4. 稳定性
2.5. 临床应用
-
甲醇、乙腈、10%高氯酸是常用蛋白沉淀剂,本研究在空白脑脊液中分别加入3倍体积上述沉淀剂,离心后与不加蛋白沉淀剂组比较,沉淀量无显著差异,且所得上清液与沉淀完全分离。现多项研究认为,因脑脊液中蛋白质含量低,故直接离心更利于生物样品的微量分析[6]。另直接离心法进样,脑脊液中TGC浓度无稀释,也无其他前处理方法造成的误差,更利于临床样本的分析。
-
TGC对G-菌(如流感嗜血杆菌、大肠杆菌、对鲍曼不动杆菌等)MIC90为2~4 mg/L[7-8]。本试验中,无论是常规给药还是加倍剂量给药的患者,稳态脑脊液浓度显然均未起到杀菌作用,导致抗感染治疗效果不佳。这可能与以下因素有关:①TGC相对分子质量大而且水溶性强,很难进入到脑脊液中。有研究报道在血脑屏障正常的志愿者中,脑脊液中TGC浓度仅为血浆的11%。而对于脑膜炎患者,血脑屏障通透性可增至33%~52%,这可能也是静脉注射TGC成功治疗颅内感染的主要原因[9-10],但血脑屏障破坏的程度个体差异较大。②重症感染患者常伴有全身炎症反应、肝肾功能异常、多器官功能障碍综合征等,血药浓度低于正常水平,在同等穿透率的情况下,药物从血液进入脑脊液中的剂量减少[11]。③TGC的蛋白结合率较高,为71%~87%[12]。颅内感染时,脑脊液蛋白水平提高,使游离的药物浓度降低[13]。④ 脑脊液引流量与药物清除率呈正相关,引流量越大,脑脊液中的药物浓度越低[14]。
目前,TGC治疗方案大多参照说明书或文献报道推荐剂量,未考虑血脑屏障、脑脊液引流量、给药途径等患者自身因素的影响,使颅内TGC的浓度不足、疗效不佳。本研究建立的脑脊液中抗菌药物TGC的二维液相色谱分析方法简便、准确、稳定,对促进TGC的合理使用、改善临床治疗结局具有重要意义。临床可根据脑脊液中TGC的浓度,及时调整给药剂量或给药途径,提高治愈率,节省医疗费用。此外,也为研究TGC在颅内的药动学及量效关系奠定了基础。







 DownLoad:
DownLoad: