-
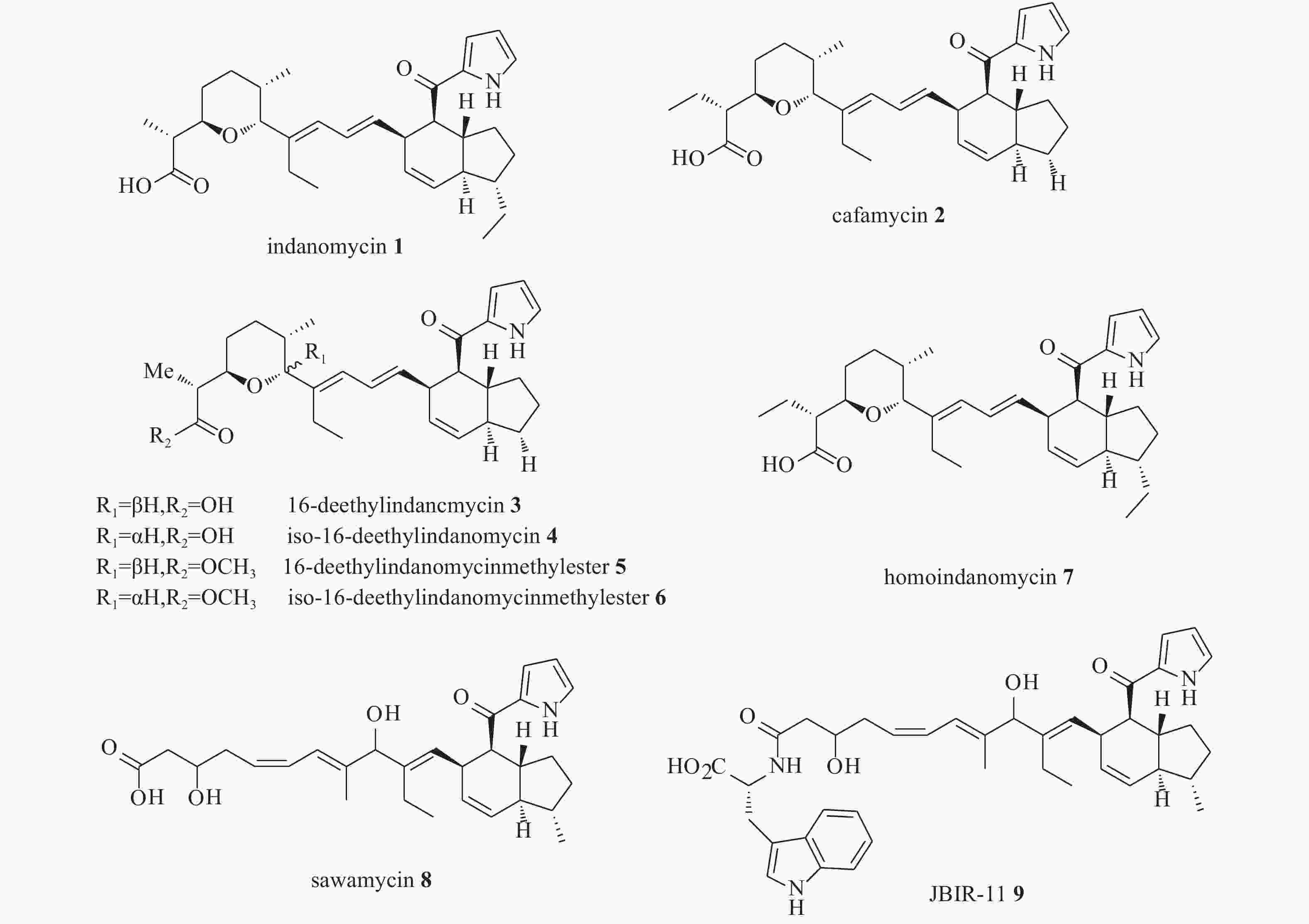
聚醚类抗生素是一类重要的微生物次级代谢产物,其结构特征为分子中含有多个环醚单元,且分子一端有羧基,该类抗生素主要由链霉菌产生,具有离子载体性质,容易络合金属离子,常见的聚醚类抗生素有莫能菌素、南昌霉素、尼日利亚菌素等。聚醚类抗生素家族中含有一类特殊的天然产物,即茚满霉素类,该类化合物含有反式四氢茚满环和吡咯酮结构单元,其代表分子是茚满霉素(indanomycin,X-14547A),最早分离自链霉菌Streptomyces sp. NRRL 8167[1]。与其结构相似的化合物还有cafamycin[2]、16-deethylindanomycin[3]及其类似物[4]、homoindanomycin、stawamycin[5-6]和JBIR-11[7]等。茚满霉素类化合物均具有良好的抗菌、杀虫和抗原虫等活性,其特殊的化学结构和显著的生物活性引起了药物学家们的广泛兴趣,不少化学家对其进行全合成,生物学家也对含有该类特殊结构的天然产物的生物合成机制进行研究。
本文就茚满霉素类化合物的天然发现、生物活性、化学合成和生物合成进行总结,为开发该类天然产物的药用价值提供科学基础,为采用组合生物合成的方法对该类化合物进行结构改造提供新思路。
-
在从土壤培养物中寻找新抗生素的过程中,Miller课题组从链霉菌Streptomyces sp. NRRL 8167的发酵液中分离得到了茚满霉素(1),为该家族第一例化合物。化合物1能够将1价和2价阳离子从水溶液中萃取到不相溶的有机溶剂中,另外,与一些只能运输特定单价阳离子(如K+或Na+)的离子载体抗生素不同,化合物1还能通过溶剂屏障(CHCl3)将Rb+和Ca2+从一个水相转移到另一个水相,具有介导跨生物膜转运2价阳离子的特殊能力[8],迄今为止,仅有少数离子载体抗生素(如拉沙里菌素和离子霉素等)具有相似的运输能力[1]。化合物1具有良好的抗菌、杀虫和抗原虫等活性[9-10],具有与其他离子载体抗生素类似的抗菌谱,在体外对G+菌Mycobacterium phlei、Streptomyces cellulosae、Staphylococcus aureus、Bacillus sp. E、Bacillus sp. TA、Sarcina lutea、Bacillus megate- rium、Bacillus subtilis的最低抑菌浓度(MIC)分别为3.1、0.8、0.2、0.2、0.2、0.1、0.1、0.1 μg/ml。研究显示,浓度为100 ppm的化合物1连续使用6 d可以使舞毒蛾和烟草天蛾幼虫的数量减少50%,使玉米穗虫的数量减少33%;浓度为20 ppm的化合物1可以使四龄的埃及伊蚊(Aedes aegypti)的死亡率达100%[1]。王继栋等人发现,化合物1对人乳腺癌细胞(MDA-MB-231)和人肝腺癌细胞(HepG-2)具有一定程度的抑制作用,其IC50值分别为14.01和7.26 μg/ml[11]。
Kliuev等人从产生蒽环类抗生素galtamycin的链霉菌培养液中分离得到了一种新型类似物cafamycin(2)[2],其与化合物1的区别在于2位甲基被乙基取代,18位乙基被脱除。Occolowitz等人从美国蒙大拿州收集的土壤样品中分离出一种新的链霉菌Streptomyces setonii,并从中分离得到了一种新的类似物,即16-deethylindanomycin(3)[3],该化合物对Streptococcus pneumoniae Park I的MIC值为2 μg/ml,对Staphylococcus aureus X1.1、S. aureus V41、S. aureus V400、S. aureus S13E的MIC值为4 μg/ml。当化合物3的浓度为0.31μg/ml时,可以100%抑制柔嫩艾美耳球虫(Emeria tenella)的生长。Zhang等人从海洋链霉菌Streptomyces antibioticus PTZ0016中分离得到了化合物3的类似物,iso-16-deethylindanomycin(4)、16-deethylindanomycin 甲酯(5)和iso-16-deethylindanomycin 甲酯(6),这3种化合物在体外实验中都显示出对金黄色葡萄球菌的抑制活性,其MIC值为4.0~8.0 μg/ml[4]。有趣的是,化合物4和6分别为化合物3和5的C-7手性异构体,这一现象在其他茚满霉素类似物中并不多见,提示该菌株中负责呋喃环形成的酶的立体选择性低。Homoindanomycin (7)分离自菌株Streptomyces galbus,其与化合物1唯一的区别在于2位上的甲基被乙基取代。Miao等人从链霉菌菌株Strepto-myces sp.的液体培养物中分离出一种新的天然产物stawamycin(8),化合物8保留了与化合物1类似的吡咯和四氢茚满结构,但不具有呋喃环,并且双键位置和构型与其他化合物相比也有明显区别,另外,该化合物的绝对构型并没有完全确定。化合物8具有抗人类疱疹病毒EB病毒(epstein-barr virus,EBV)活性,可以抑制病毒转录因子BZLF1与其DNA靶标的结合[5]。Miho等人从绿色链霉菌Streptomyces viridochromogenes的菌丝体中分离得到了JBIR-11(9),是化合物8的衍生物,不同的是化合物9在末端羧基上结合了一分子色氨酸,而且化合物9具有抗肿瘤活性,对人纤维肉瘤HT1080细胞具有生长抑制作用,其IC50值为25 μmol/L[7]。茚满霉素及其天然类似物的结构式如图1所示。
-
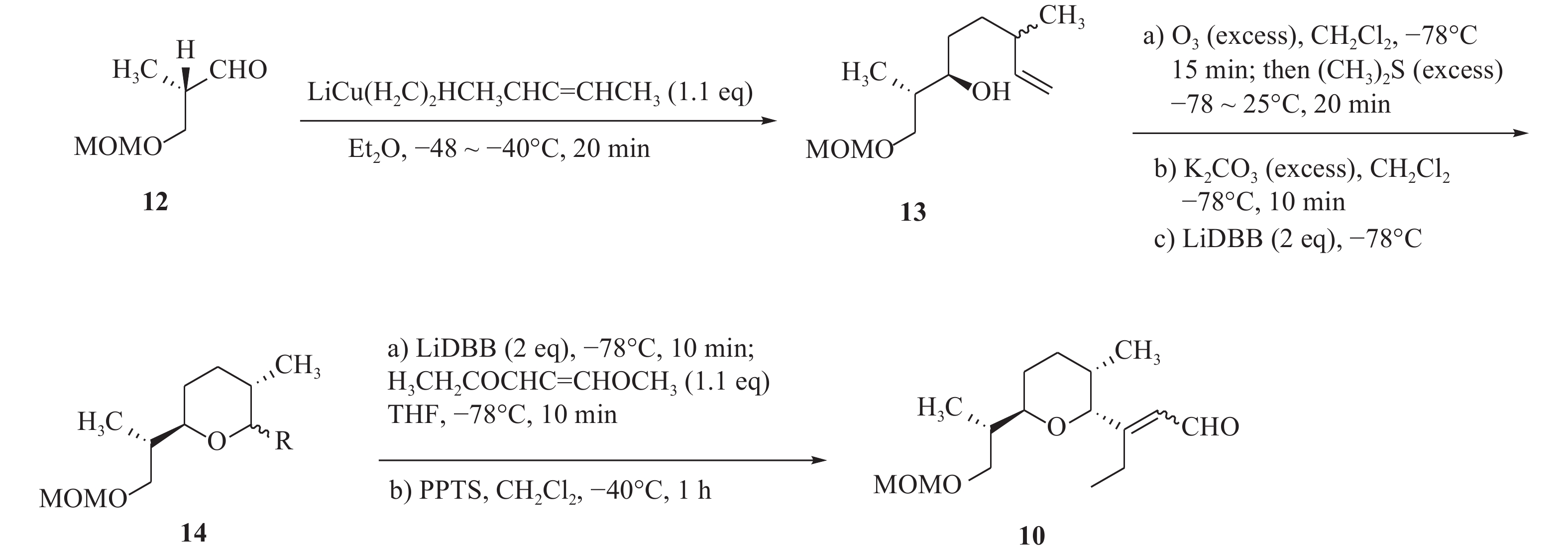
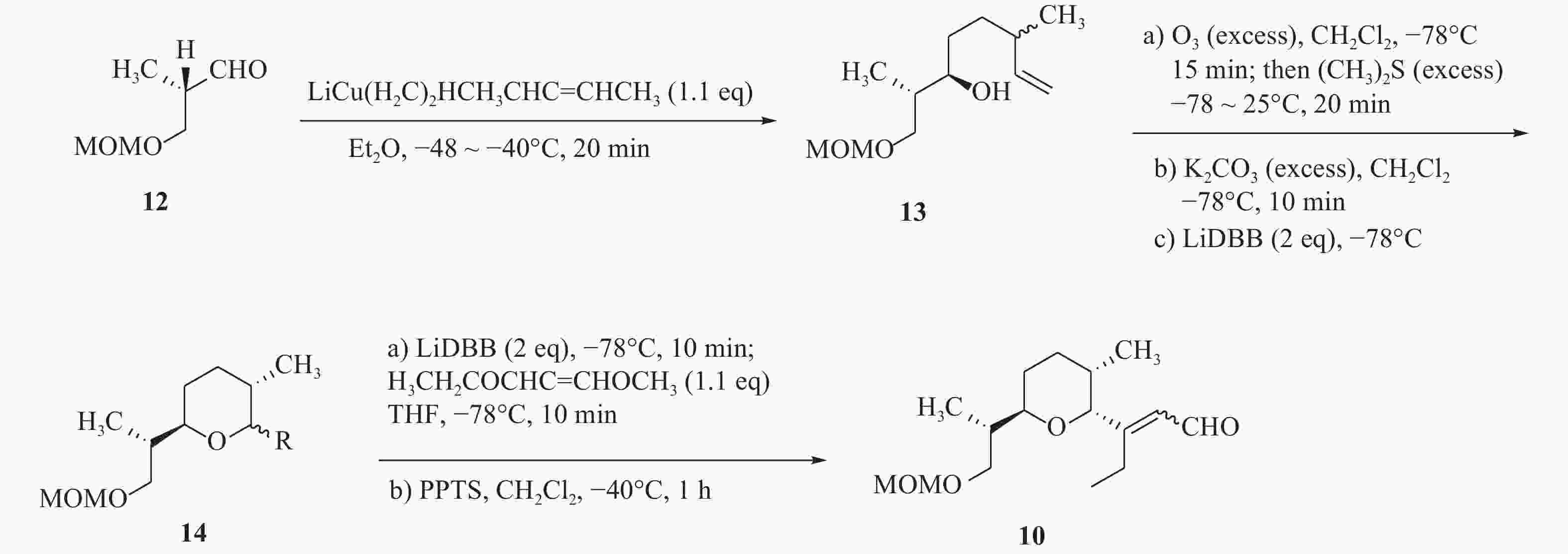
由于茚满霉素中不同寻常的结构,如反式四氢茚满环和吡咯酮,其全合成被多次报道[12-15]。Boeckman[16]等人对茚满霉素进行了逆合成分析,选择利用串联Wittig反应与分子内Diels-Alder环加成反应来合成反式四氢茚满环骨架。吡喃醛中间体(10)和磷叶立德(11)发生wittig反应得到中间体(20),随后由分子内[4+2] Diels-Alder环加成反应得到化合物1。
化合物10的构建以活泼醛(12)为原料,在二烷基铜锂的作用下发生羟醛缩合反应得到醇类中间体(13),化合物13在过量臭氧下双键发生断裂后,被硫醚还原得到化合物14。在二叔丁基联苯锂的存在下,化合物14发生锂盐化,最后经PPTS催化得到化合物10(图2)。
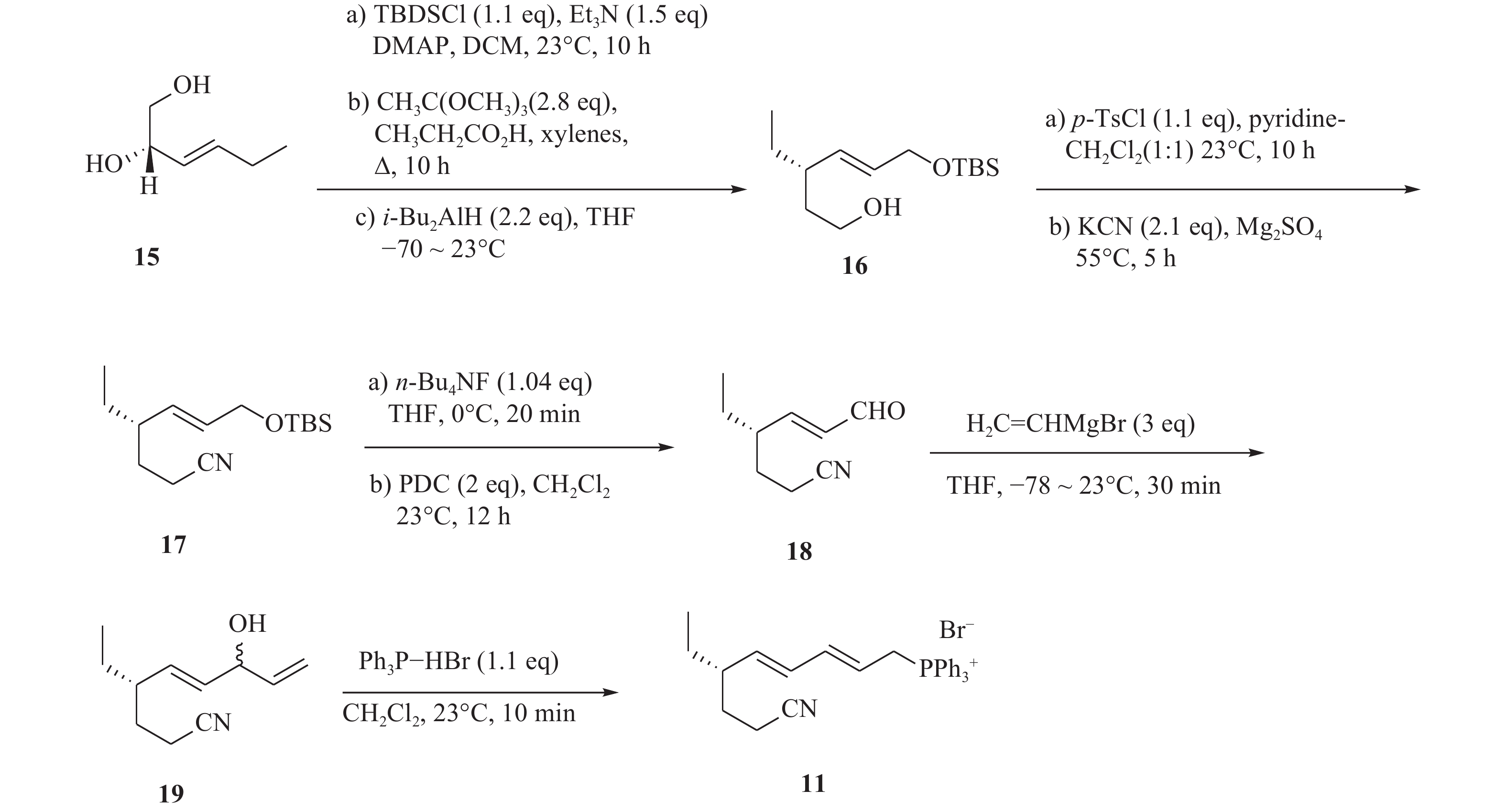
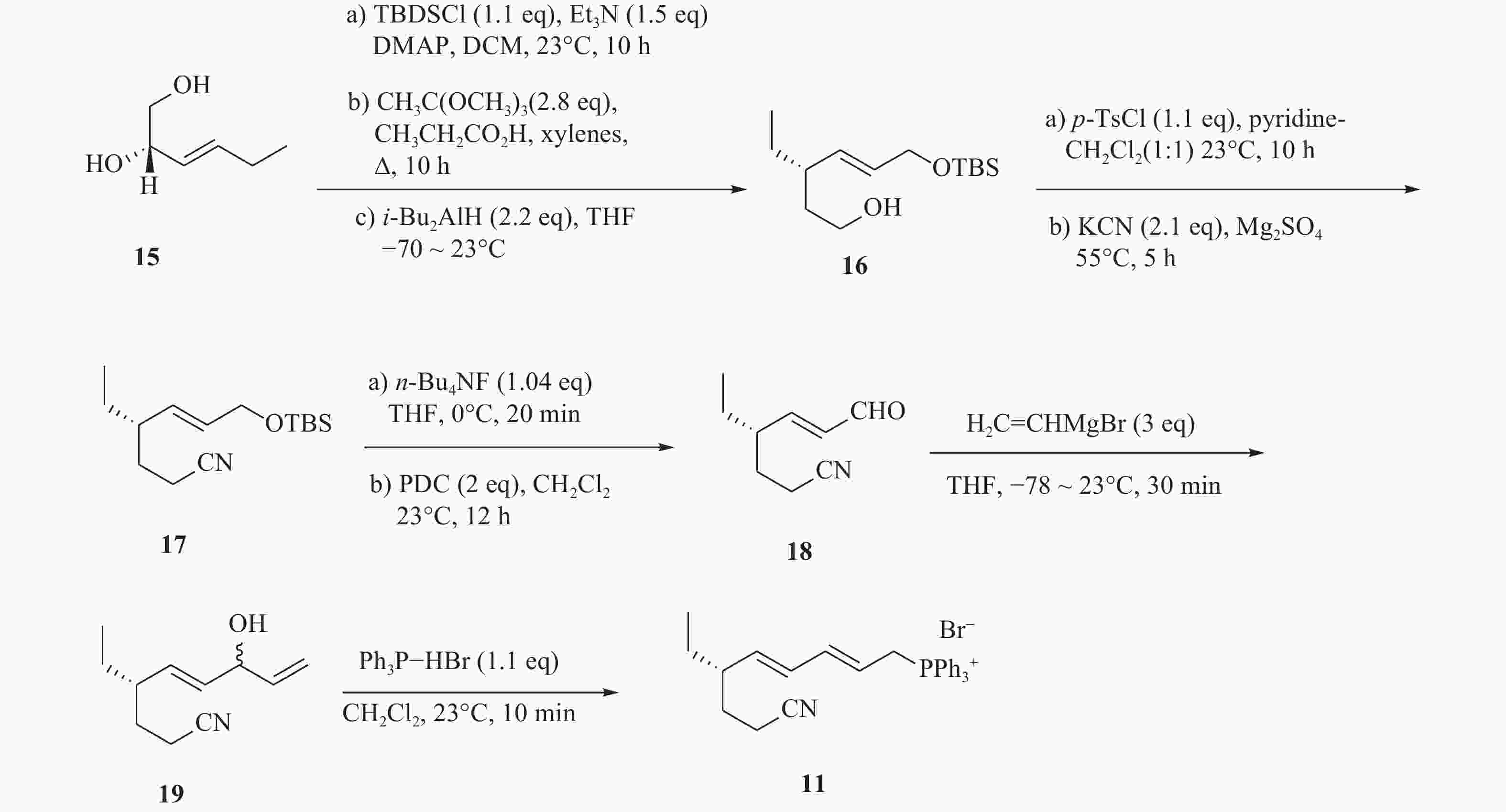
化合物11的合成以二醇化合物(15)为起始原料,在DMAP催化作用下,伯羟基发生硅基烷基化反应,随后与二异丁基氢化铝在−78 ℃发生Claisen重排,得到烯醇(16)。化合物16进行磺基化反应后,以氰化钾作为氰源,合成氰化物(17)。化合物17在四丁基氟化铵和重金属氧化剂PDC作用下,得到α, β不饱和醛(18)。最后将化合物18与格氏试剂乙烯基溴化镁在−78 ℃进行无水无氧反应,由此得到的化合物19再与三苯基膦溴化氢反应,生成化合物11(图3)。
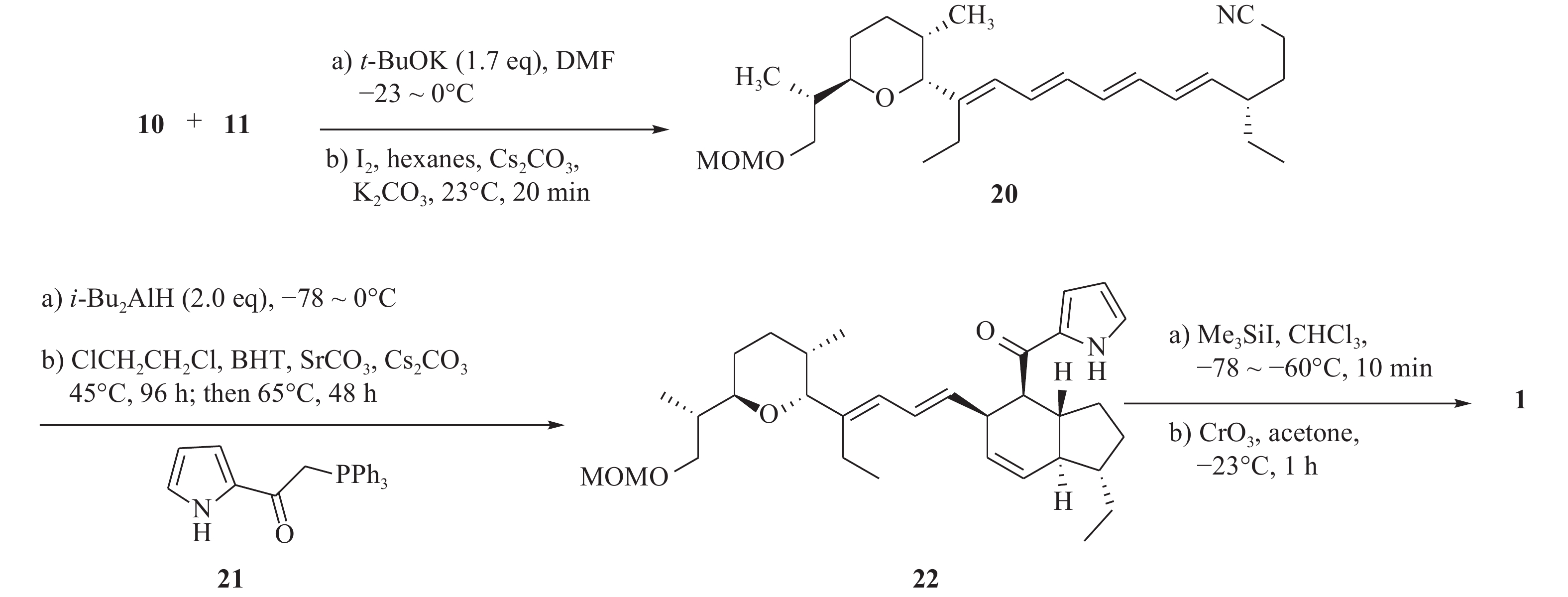
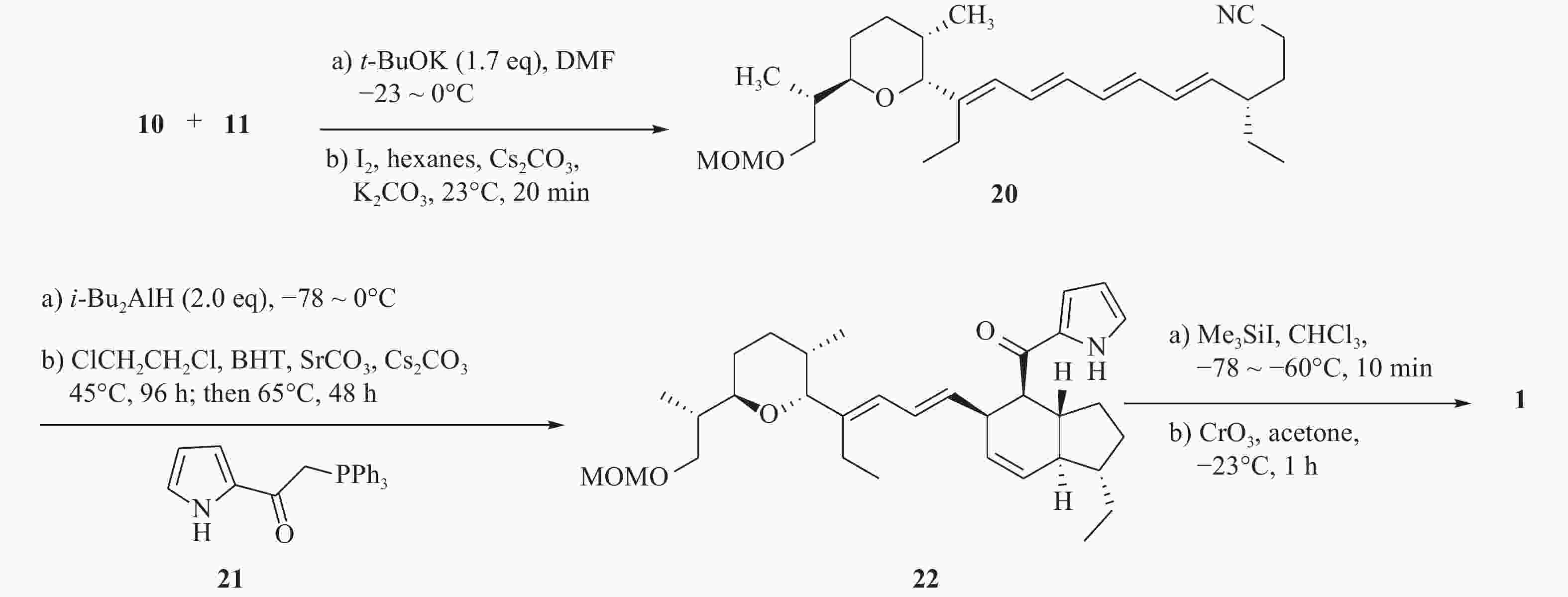
最后,化合物10和11在叔丁醇钾的作用下,发生wittig反应得到中间体20。化合物20被i-Bu2AlH还原为醛,随后在1,2-二氯乙烷中与吡咯酮(21)反应,先后进行wittig反应与分子内Diels-Alder环加成反应,得到化合物22。化合物22在三甲基碘硅烷作用下脱保护,再与过量的三氧化铬发生氧化反应,得到目标化合物1(图4)。
该化合物的全合成历经21步,总体收率不高。反应过程需要使用锂化物、氢化铝、格氏试剂等危险品,还需要–78 ℃的低温无水反应,条件苛刻,并且使用到了剧毒化合物氰化钾、重金属试剂PDC及三氧化铬。因此,该方法对环境不友好,不符合绿色化学的理念,有待进一步的改善。
-
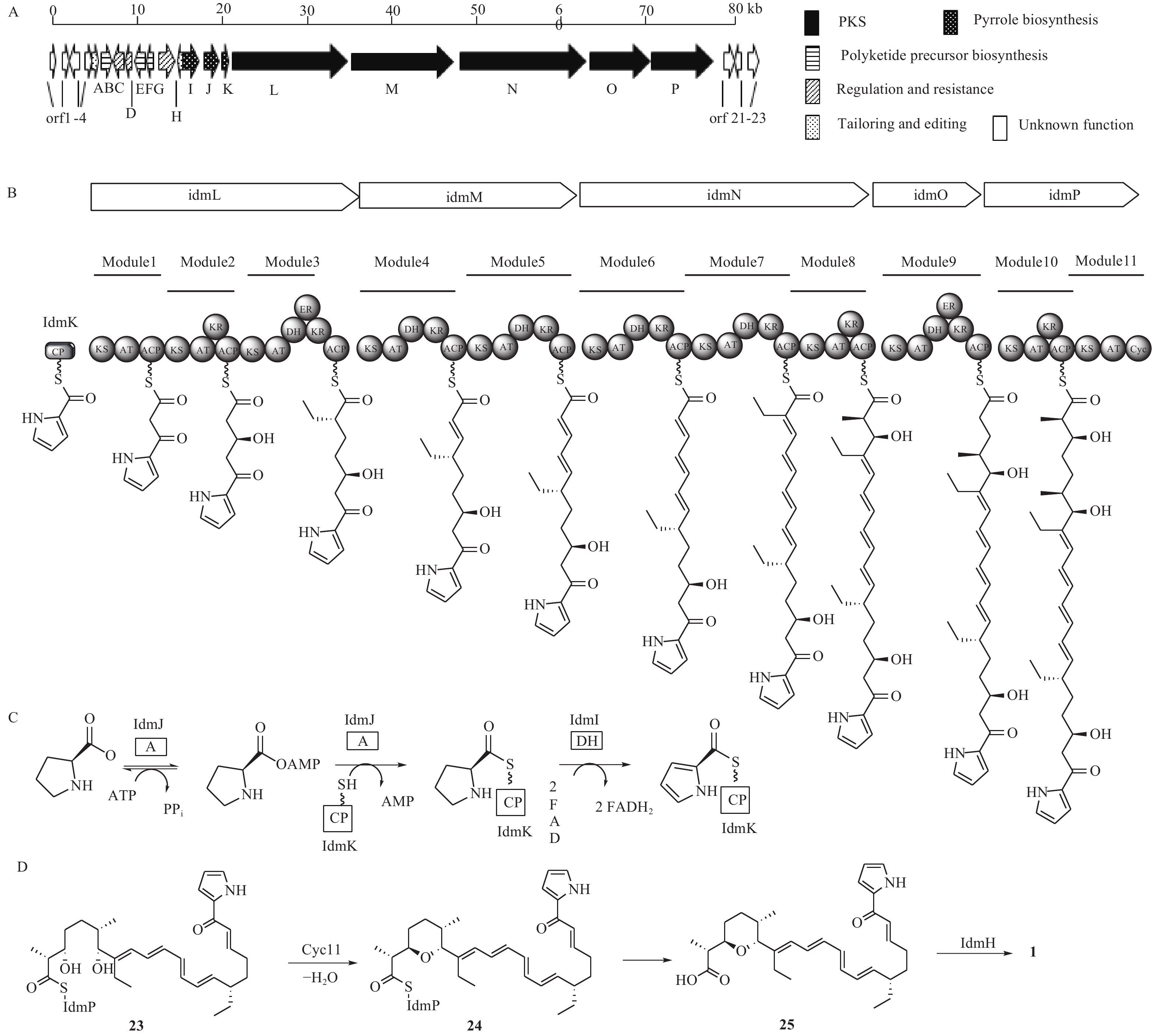
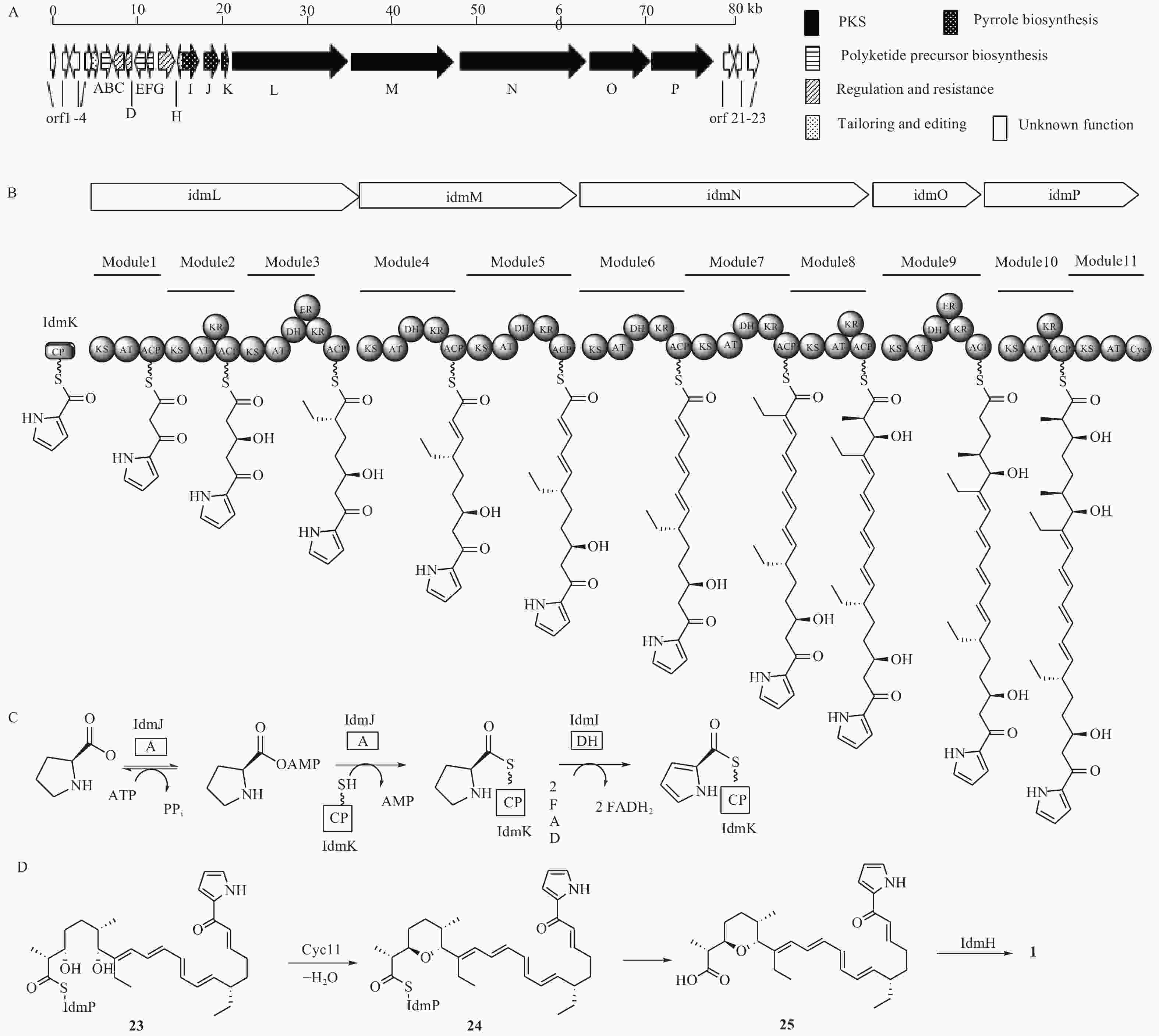
化合物1是杂合了非核糖体肽合成酶-聚酮合酶(NRPS-PKS)装配线的天然产物,Roege等人用13C标记的前体喂养实验确定了其代谢起源,包括1个L-脯氨酸、6个丙二酰辅酶A、2个甲基丙二酰辅酶A和2个乙基丙二酰辅酶A[17-18]。Kelly课题组从抗生素链霉菌NRRL 8167中确认了化合物1的生物合成基因簇idm,其大小为80 kb左右(图5A)[19]。其中16个基因参与了化合物1的生物合成(idm A-P),包括吡咯合成[20](pyrrole biosyn-thesis,idmI-K),调控和抗性基因(idmC,D,G),聚酮合成酶基因(idm L-P),聚酮前体合成基因(idmB,E,F),后修饰基因(idmA,H),另外7个基因经基因敲除实验验证与化合物1的合成无关(orf 1-4,orf 21-23)。起始单元吡咯-2-甲酰CoA是由L-脯氨酸经过脯氨酰依赖的转移酶(idmJ),载体蛋白(idmK)和黄素依赖的L-脯氨酰CoA脱氢酶(idmI)3个酶催化形成的(图5C)。IdmJ基因缺失实验证实idmJ参与了化合物1的生物合成。编码PKS的基因位于idmI-K的下游,包含编码idmL-P 5个酶,根据生物信息分析划分成10个模块:idmL(模块1~3),idmM(模块4和5),idmN(模块6~8),idmO(模块9),idmP(模块10和11)。PKS模块的结构域由酮基合成酶(KS)、酰基转移酶(AT)、脱氢酶(DH)、烯酰还原酶(ER)、酮基还原酶(KR)和酰基载体蛋白(ACP)等结构域组成,根据模块中的结构域分析,推测化合物1的PKS骨架形成与延伸过程如图5B所示。
模块1~10完成了化合物1的PKS骨架搭建,模块11是化合物1生物合成中的特殊PKS模块,它不参与聚酮链的延伸,而且它的模块结构不完整,仅包含一个KS单元、一个AT单元和一个特殊的cyc11单元,其中,cyc11单元与盐霉素(salinomycin)生物合成中的吡喃合成酶(SalBIII)的同源性较高,序列比对显示,cyc11(Asp28和Asp94)含有SalBIII(Asp38和Asp104)活性必需的残基[21-22],因此cyc11可能具有与盐霉素中吡喃形成类似的催化机制[23],即负责催化化合物23的C-3羟基脱水生成α, β-不饱和酮,然后进行C-7羟基的Michael加成产生化合物24。根据生物信息学预测,茚满霉素PKS模块最终对应的产物为含19-OH的中间体,而不是化合物23,因为其PKS模块2中无DH结构域,不能直接产生Δ19(20)双键。但是,该位置上双键需要作为化合物24上的亲双烯体进行[4+2]环加成以产生茚满环,具体哪个酶负责催化形成Δ19(20)双键目前尚不明确。另外,序列比对表明idmH与环化酶SnoaL[24-25]存在很大的相似性,所以负责[4+2]环化形成茚满环结构的酶可能是idmH[19, 26],但目前尚无体外生化反应验证。根据生物信息学推测的茚满霉素后修饰合成路线如图5D所示。
-
含反式四氢茚满环结构的化合物在天然产物中比较少见,自1979年茚满霉素首次报道以来,这类化合物就引起了药物化学家和生物学家的广泛兴趣,本综述总结了其在生物活性、化学全合成以及生物合成等方面获得的研究成果,为该类天然产物的药用价值开发提供科学依据。虽然茚满霉素的生物合成步骤尚未完全阐明,但随着其生物合成基因簇的发现,利用组合生物合成的方法对该类化合物进行结构改造将成为可能。
Research progress on indanomycin natural products
doi: 10.12206/j.issn.1006-0111.201910034
- Received Date: 2019-10-14
- Rev Recd Date: 2020-03-11
- Available Online: 2020-05-20
- Publish Date: 2020-05-01
-
Key words:
- indanomycin /
- indane ring /
- biological activity /
- chemical synthesis /
- biosynthesis
Abstract: Indanomycins are a class of secondary metabolites of microorganisms with a trans-tetrahydroindan (indane) ring. These compounds generally have good antibacterial, insecticidal and antitumor biological activities, which have caused wide interest for medicinal chemists and biologists. This review summarizes the research progress of the discovery, biological activity, chemical synthesis and biosynthesis of indanomycin compounds since 1979 and provides scientific reference for the research and development of indanomycin antibiotics.
| Citation: | ZHU Yuqin, WU Jiequn, SUN Peng. Research progress on indanomycin natural products[J]. Journal of Pharmaceutical Practice and Service, 2020, 38(3): 211-215, 226. doi: 10.12206/j.issn.1006-0111.201910034 |








 DownLoad:
DownLoad: